L’utilisation peropératoire de l’ETO lors de correction chirurgicale des complications de l’ischémie permet de définir la stratégie, de contrôler le résultat et de gérer l’hémodynamique.
Ruptures myocardiques
Les ruptures de structures myocardiques (paroi libre 10% des STEMI, muscle papillaire 3%, septum interventriculaire 1.5%) sont le fait de l’obstruction aiguë d’un vaisseau terminal non collatéralisé [2]. Elles surviennent typiquement dans les premiers jours qui suivent un infarctus transmural de petite taille chez des malades souffrant en général d’une maladie monotronculaire. Leur manifestation clinique va de l'épanchement péricardique insidieux à la survenue brutale d’un choc cardiogène accompagnée d’un souffle systolique [6]. Sans traitement chirurgical d’urgence, leur pronostic est catastrophique. Ces lésions sont souvent inféro-postérieures et ne sont pas visibles dans les vues mi-oesophagiennes, en particulier en 4-cavités ; on ne les met en évidence que dans des vues transgastriques, en balayant le coeur de 0° à 120° et en les recherchant en 2D et avec le Doppler couleur.
Une rupture de paroi libre se manifeste souvent par une tamponnade et des caillots péricardiques, cloisonnés de manière plus ou moins étanche. L’image 2D montre la rupture et le flux couleur met en évidence un va-et-vient systolo-diastolique (Vidéos) (Figures 27.27). L’image est parfois difficile à différencier de celle d’un anévrysme ou d’un pseudo-anévrysme, mais la cavité n’a en général pas de forme géométrique précise et se présente plutôt comme une zone de flux systolo-diastolique extra-ventriculaire [3]. La survie n’est possible que si la rupture est contenue par une réaction péricardique, sans quoi le patient décède brutalement de tamponnade aiguë.
Vidéo: rupture pariétale inférieure cloisonnée par le péricarde. Une telle image contraint le chirurgien à n'aborder le ventricule gauche qu'une fois l'aorte clampée et le coeur arrêté, car toute manoeuvre peut entraîner un cataclysme hémorragique.
Vidéo: vue court-axe transgastrique apicale d'une poche péricardique créée par une rupture ventriculaire inférieure; elle est alimentée par un flux systolo-diastolique, donc communiquant avec le VG (voir Figure 27.27B).
Vidéo: rupture ventriculaire inférieure en vue court-axe transgastrique; la poche qui la contient chemine au sein du péricarde entre le coeur et le diaphragme, contenue par des adhérences péricardiques fibreuses (voir Figure 27.27C).
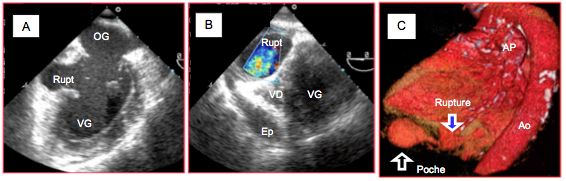
Figure 27.27 : Rupture ventriculaire inférieure. A : orifice de rupture dans la paroi inférieure en vue 2-cavités ; le collet est relativement étroit. B : poche située entre les ventricules et le diaphragme en vue transgastrique court axe du VG (0°) ; elle contient un flux couleur systolique turbulent ; le VD est écrasé par cette poche ; il existe par ailleurs un épanchement péricardique. C : reconstruction 3D du coeur ; la rupture inférieure du VG débouche dans une poche située sous le coeur, délimitée par des adhérences péricardiques fibreuses dues à une ancienne péricardite (même cas que sous B et que dans les deux vidéos précédentes).
La communication interventriculaire (CIV) peut survenir dans le corps ou dans la base du septum. Lorsqu’elle est due à une obstruction de la CD, elle apparaît sur la partie postérieure du septum et n’est visible qu’en vue transgastrique 0° ; due à une lésion de l’IVA, elle apparaît dans la partie moyenne et antérieure du septum. Elle s'accompagne d'une dilatation et d'une défaillance du VD [5]. La CIV peut se présenter comme une perforation à l’emporte-pièce bien visible en imagerie 2D, mais elle est souvent serpentigineuse et n’est alors mise en évidence qu’au flux couleur. Après repérage au Doppler couleur, on recherche un plan de coupe où le passage est visible de part en part, ce qui est souvent malaisé et demande des vues inhabituelles. Le flux de CIV présente trois caractéristiques (Vidéos et Figure 27.28).
Ruptures myocardiques
Les ruptures de structures myocardiques (paroi libre 10% des STEMI, muscle papillaire 3%, septum interventriculaire 1.5%) sont le fait de l’obstruction aiguë d’un vaisseau terminal non collatéralisé [2]. Elles surviennent typiquement dans les premiers jours qui suivent un infarctus transmural de petite taille chez des malades souffrant en général d’une maladie monotronculaire. Leur manifestation clinique va de l'épanchement péricardique insidieux à la survenue brutale d’un choc cardiogène accompagnée d’un souffle systolique [6]. Sans traitement chirurgical d’urgence, leur pronostic est catastrophique. Ces lésions sont souvent inféro-postérieures et ne sont pas visibles dans les vues mi-oesophagiennes, en particulier en 4-cavités ; on ne les met en évidence que dans des vues transgastriques, en balayant le coeur de 0° à 120° et en les recherchant en 2D et avec le Doppler couleur.
Une rupture de paroi libre se manifeste souvent par une tamponnade et des caillots péricardiques, cloisonnés de manière plus ou moins étanche. L’image 2D montre la rupture et le flux couleur met en évidence un va-et-vient systolo-diastolique (Vidéos) (Figures 27.27). L’image est parfois difficile à différencier de celle d’un anévrysme ou d’un pseudo-anévrysme, mais la cavité n’a en général pas de forme géométrique précise et se présente plutôt comme une zone de flux systolo-diastolique extra-ventriculaire [3]. La survie n’est possible que si la rupture est contenue par une réaction péricardique, sans quoi le patient décède brutalement de tamponnade aiguë.
Vidéo: rupture pariétale inférieure cloisonnée par le péricarde. Une telle image contraint le chirurgien à n'aborder le ventricule gauche qu'une fois l'aorte clampée et le coeur arrêté, car toute manoeuvre peut entraîner un cataclysme hémorragique.
Vidéo: vue court-axe transgastrique apicale d'une poche péricardique créée par une rupture ventriculaire inférieure; elle est alimentée par un flux systolo-diastolique, donc communiquant avec le VG (voir Figure 27.27B).
Vidéo: rupture ventriculaire inférieure en vue court-axe transgastrique; la poche qui la contient chemine au sein du péricarde entre le coeur et le diaphragme, contenue par des adhérences péricardiques fibreuses (voir Figure 27.27C).

Figure 27.27 : Rupture ventriculaire inférieure. A : orifice de rupture dans la paroi inférieure en vue 2-cavités ; le collet est relativement étroit. B : poche située entre les ventricules et le diaphragme en vue transgastrique court axe du VG (0°) ; elle contient un flux couleur systolique turbulent ; le VD est écrasé par cette poche ; il existe par ailleurs un épanchement péricardique. C : reconstruction 3D du coeur ; la rupture inférieure du VG débouche dans une poche située sous le coeur, délimitée par des adhérences péricardiques fibreuses dues à une ancienne péricardite (même cas que sous B et que dans les deux vidéos précédentes).
La communication interventriculaire (CIV) peut survenir dans le corps ou dans la base du septum. Lorsqu’elle est due à une obstruction de la CD, elle apparaît sur la partie postérieure du septum et n’est visible qu’en vue transgastrique 0° ; due à une lésion de l’IVA, elle apparaît dans la partie moyenne et antérieure du septum. Elle s'accompagne d'une dilatation et d'une défaillance du VD [5]. La CIV peut se présenter comme une perforation à l’emporte-pièce bien visible en imagerie 2D, mais elle est souvent serpentigineuse et n’est alors mise en évidence qu’au flux couleur. Après repérage au Doppler couleur, on recherche un plan de coupe où le passage est visible de part en part, ce qui est souvent malaisé et demande des vues inhabituelles. Le flux de CIV présente trois caractéristiques (Vidéos et Figure 27.28).
- Une zone d’accélération concentrique (PISA) sur le versant gauche, dont la dimension est un bon indice de l’importance de la CIV.
- Un flux couleur à travers le septum, rectiligne ou sinueux, dont l’image est inconstante à cause du trajet parfois tortueux du flux.
- Une zone tourbillonnaire au sein du VD, en général mieux visible en diastole qu’en systole.
Vidéo: vue court-axe transgastrique d'une CIV post-infarctus située au pied du septum; cette lésion est invisible dans les vues transoesophagiennes rétrocardiaques.
Vidéo: vue 4-cavités modifiée du flux à travers une CIV post-infarctus; le flux passe du VG au VD (coupé tangentiellement, voir Figure 27.28C).
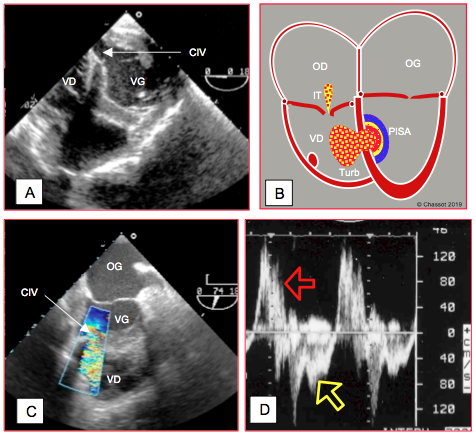
Figure 27.28 : Communication interventriculaire (CIV). A : vue court-axe transgastrique du VG (0°) montrant une CIV postérieure au pied du septum sur occlusion de la coronaire droite. B : schéma du flux Doppler couleur en cas de CIV, avec la zone d’accélération côté ventriculaire gauche (PISA), le flux trans-septal et la zone de turbulence (Turb) au sein du VD ; celle-ci est surtout visible en diastole, car le flux est emporté par l’éjection du VD en systole. Une insuffisance tricuspidienne est fréquente (IT) ; elle ne permet toutefois pas de calculer la PAPsyst parce que la pression systolique du VD est contaminée par celle du VG à travers la CIV. C: flux couleur à travers une CIV post-infarctus; le VD est dilaté et empiète sur le VG. D: image spectrale du flux à travers la CIV; le shunt est G-D en systole (flèche rouge), mais D-G en diastole (flèche jaune) à cause de la défaillance du VD (PtdVD > PtdVG). Les vélocités sont basses parce que la pression est élevée dans le VD et parce que le VG est en insuffisance aiguë.
Le flux à travers la CIV est systolo-diastolique. En cherchant une vue qui permette d’aligner l’axe du Doppler continu avec celui du chenal, il est possible d’en mesurer la vélocité maximale (VmaxCIV 1.5-4 m/s), et d’en déduire le gradient de pression entre les deux ventricules (équation de Bernoulli : ΔP = 4 V2). En l’absence de lésion aortique, on peut calculer la pression systolique du VD, donc la PAPsyst, par soustraction du ΔP de la pression artérielle systémique en systole (PAs) :
PAPsyst = PAs - ΔPCIV
La PAPsyst ne peut pas être estimée à partir de la Vmax de l’insuffisance tricuspidienne, souvent présente à cause de la défaillance du VD, parce que la pression du VD est contaminée par celle du VG à travers la CIV. Le ΔP mesuré serait en réalité celui qui règne entre le VG et l’OD, ce qui donnerait une pression pulmonaire équivalente à la pression systémique. La présence d’une IM ou d’une IT est en général liée à la dilatation ventriculaire ; dans ce cas, l’insuffisance est de type restrictive centrale. Toutefois, l’IT peut être due au dysfonction du muscle papillaire septal, auquel cas elle est excentrique par restriction ou prolapsus de la commissure septale. Une CIV de > 1.5 cm est une indication chirurgicale, alors qu'une CIV de < 1.5 cm peut être fermée par un dispositif d'occlusion percutané [7].
La rupture de muscle papillaire est plus fréquente dans le muscle papillaire postéro-médian (VIdéos), qui est vascularisé seulement par la CD, que dans le muscle antéro-latéral doublement vascularisé par l’IVA et la CX. Les ruptures complètes se traduisent par le basculement total d’une commissure et une IM massive non compatible avec la survie, sauf si on l’opère en urgence (Rupt tot MPA). A cause de la défaillance ventriculaire et de la grande taille de l’orifice de régurgitation, la Vmax de l’IM est basse (1-3 m/s) ; il y a peu ou pas de flux tourbillonnaire au Doppler couleur [3]. On rencontre plus fréquemment des ruptures partielles caractérisées par la bascule systolique dans l’OG de la partie commissurale d’un ou des deux feuillets mitraux, accompagné d’un fragment de pilier qui oscille indépendamment de la paroi dans le VG (Figure 27.29) ; le jet de l’IM est excentrique et le reflux systolique massif dans les veines pulmonaires (inversion de la composante systolique du flux veineux pulmonaire, onde "v" majeure sur le tracé de PAPO, œdème pulmonaire).
Vidéo: prolapsus de la commissure postérieure sur rupture partielle du muscle papillaire postérieur (vue bicommissurale).
Vidéo: vue court-axe transgastrique montrant la rupture partielle du muscle papillaire postérieur dans le cas de la vidéo précédente.
Vidéo: rupture totale du muscle papillaire antérieur que l'on voit flotter à l'extrémité des feuillets, faisant des aller-retours entre le VG et l'OG. L'IM est massive et non-compatible avec la survie au-delà de quelques heures.
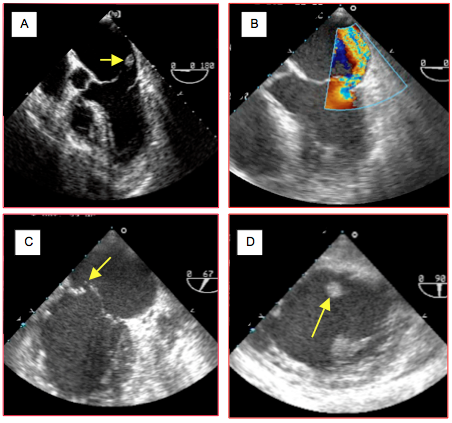
Figure 27.29 : Rupture de muscle papillaire. A : rupture totale du muscle papillaire antérieur. On aperçoit un fragment de pilier à l’extrémité de cordages, flottant dans l’OG en systole et dans le VG en diastole. B : IM excentrique secondaire à un prolapsus de la commissure antérieure à la suite d'une rupture partielle du muscle papillaire antérieur (vue 5-cavités). C: rupture partielle du muscle papillaire postérieur ; la commissure postérieure est basculée dans l’OG en systole (vue bicommissurale 60°). D: en vue transgastrique du même cas, la tête du muscle papillaire postérieur flotte librement dans la cavité du VG.
Anévrysme et pseudo-anévrysme
L’anévrysme est un cas extrême de dyskinésie survenant après un infarctus transmural, un traumatisme ou certaines affections (maladie de Chagas, sarcoïdose): le ou les segments non perfusés et cicatriciels sont amincis (épaisseur < 0.5 cm), inertes, et bombent vers l’extérieur en systole. A l’origine, l’anévrysme est constitué de toute l’épaisseur de la paroi ventriculaire ; son collet est large (Vidéo). Il contient fréquemment un thrombus mural qui peut faire croire que la paroi est plus épaisse qu'elle ne l'est en réalité. Il est à l’origine d’arythmies ventriculaires malignes. Le flux systolique tournoie à l’intérieur. Les deux endroits les plus fréquents sont l’apex du VG et la paroi inféro-basale (Figure 27.30).
Vidéo: vaste anévrysme de la paroi latérale du VG en vue court-axe transgastrique; le collet est très large. Le contraste spontané signale le bas débit.
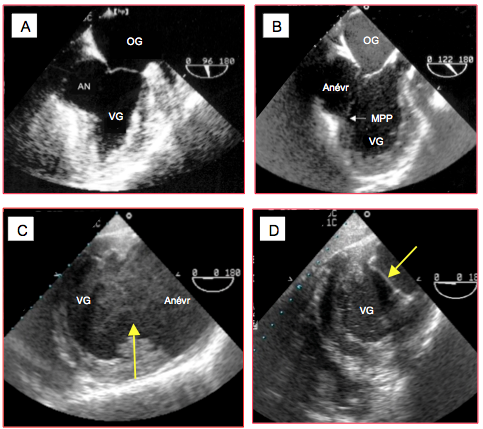
Figure 27.30 : Images d’anévrysme ventriculaire gauche. A : anévrysme postéro-basal (AN) en vue 2-cavités (90°) ; sur cette image, l’occlusion de la valve mitrale est satisfaisante. B : anévrysme postéro-latéral en vue long-axe du VG (120°) ; le collet englobe le pilier postérieur (MPP), la valve mitrale est incompétente. C : immense anévrysme postéro-latéral avec du contraste spontané en vue transgastrique court-axe du VG; la flèche indique le très large collet. D: vue après résection de l'anévrysme postéro-latéral précédent; la flèche montre le patch qui ferme l’ancien collet.
Le pseudo-anévrysme est une rupture partielle de la paroi ventriculaire sous forme d’une poche contenue par l’épicarde. Plus fréquent dans la paroi postérieure, son collet est en général étroit et sa paroi mince. Le pseudo-anévrysme contient du contraste spontané mis en mouvement en systole et fréquemment des thrombi muraux (Figure 27.31) [8]. C’est souvent un diagnostic anatomo-pathologique, car le pseudo-anévrysme ne se différencie de l’anévrysme à l'écho que par son collet plus étroit et la minceur de sa paroi.
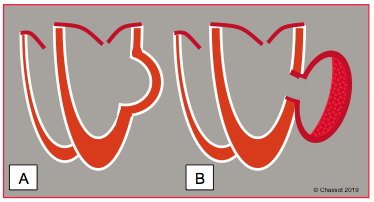
Figure 27.31 : Différence entre un anévrysme (A, dilatation de toute la paroi ventriculaire) et un pseudo-anévrysme (B, rupture partielle de la paroi avec contention par les couches externes). En général, le collet du pseudo-anévrysme est plus étroit et sa paroi plus mince ; il contient fréquemment un thrombus mural.
La fragilité de la paroi des anévrysmes et des ruptures couvertes du VG fait courir un risque élevé d'hémorragie cataclysmique lors de la dissection intrapéricardique ; la prudence est de réaliser cette dernière une fois le malade en CEC et l’aorte clampée. Il est du ressort de l'anesthésiste-échocardiographeur d'en avertir le chirurgien.
Lors de ces différentes situations de nécrose pariétale du VG (CIV, anévrysme, rupture), il est important de bien évaluer le fonctionnement des muscles papillaires et le mécanisme de l’IM si elle est présente, car le dysfonctionnement de l’appareil sous-valvulaire de la valve mitrale modifie la stratégie chirurgicale (Vidéo) [3]. L’examen doit également tenter d’évaluer le volume ventriculaire qui subsistera après résection de la masse nécrosée, en tenant compte du fait que les sutures de l’orifice ou du patch se placent en tissu sain (Vidéos) ; le VG sera donc amputé de davantage de masse contractile que ne le laisse prévoir l’image échocardiographique. La résection d’un volume non-contractile améliore la fraction d’éjection du ventricule mais diminue considérablement son volume systolique : malgré une FE satisfaisante, le débit cardiaque est bas et la tachycardie obligatoire.
Vidéo: vue 4-cavités d'un vaste anévrysme de la paroi latérale du VG, avec présence d'une discrète insuffisance mitrale.
Vidéo: vue court-axe transgastrique du patch de correction de l'anévrysme latéral du VG de la vidéo précédente; le patch a un mouvement dyskinétique.
Vidéo: vue 4-cavités du patch de correction du même anévrysme latéral du VG; le rétrécissement de la cavité ventriculaire effective est évident.
Après la correction en CEC, il est nécessaire de contrôler un certain nombre d’éléments.
- Etanchéité du patch;
- Degré de restriction : volumes ventriculaires télédiastolique et télésystolique (règle de Simpson);
- Modifications de la cinétique segmentaire (le patch fonctionne comme une zone dyskinétique);
- Recherche d’une IM résiduelle et de son mécanisme;
- Recherche d’une IT résiduelle, particulièrement en cas de correction de CIV;
- Recherche de CIV résiduelle.
Thrombus
L’immobilité d’une zone akinétique et un bas débit ventriculaire peuvent créer les conditions pour la formation d’un thrombus mural, que l’on rencontre le plus fréquemment à l’apex du VG (Vidéos et Figure 27.32). Un thrombus peut être laminaire et ancré dans les trabéculations ou arrondi et mobile ; il est en général bien visible en vue mi-oesophagienne 2 cavités 90°, long axe 120° et transgastrique long axe 100-120° (on ne voit pas l'apex anatomique en vue mi-oesophagienne 4-cavités 0°). Le diagnostic différentiel avec des trabéculations ou un muscle papillaire est parfois difficile : le thrombus est inhomogène, ne se contracte pas et est séparé de la paroi par un plan de clivage. Son échogénicité est sensiblement différente de celle du muscle. Il est localisé sur une paroi hypo- ou akinétique. Il doit apparaître de manière identique dans au moins deux plans de coupe orthogonaux pour pouvoir poser le diagnostic. Ce dernier est facilité par l'utilisation de produit de contraste [8]. Le thrombus laminaire est bien ancré dans les trabéculations et ne présente pas de risque embolique ; un thrombus arrondi et sessile est plus dangereux. Il est habituel de réséquer ce dernier en cours de la revascularisation chirurgicale, mais pas le premier.
Vidéo: vue long-axe 110° du VG avec un gros thrombus dans la région apicale; le territoire antéro-apical est akinétique.
Vidéo: vue 2-cavités transgastrique du même cas que la vidéo précédente.
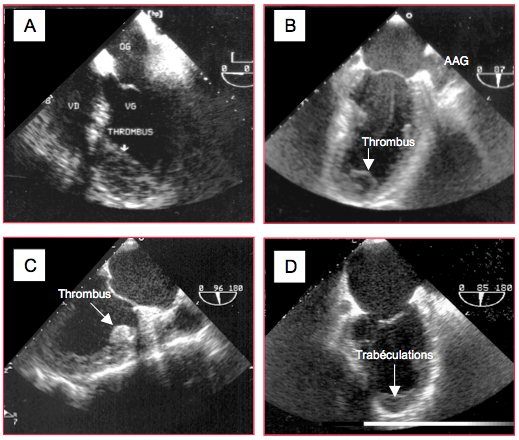
Figure 27.32 : Thrombus intraventriculaire gauche. A : thrombus antéro-apical laminaire en vue 4-cavités. B : thrombus apical mobile en vue 2-cavités (90°); on voit du contraste spontané dans le VG et l'appendice auriculaire gauche (AAG). C : thrombus localisé inhabituellement à la base de la paroi antérieure akinétique (vue 2-cavités 90°). D : image tronquée d’un apex normal en vue 2-cavités 90°, montrant simplement des trabéculations coupées tangentiellement. Pour poser le diagnostic de thrombus, il faut que la même image appa-raisse dans au moins 2 vues différentes, si possible orthogonales.
Hémopéricarde et tamponnade
Un épanchement péricardique plus ou moins compressif complique un infarctus dans 4-43% des cas de STEMI [1]. Il apparaît en général pendant la première semaine après l'accident aigu; c'est un signe de mauvais pronostic [4]. Il présente tous les signes échocardiographiques de l'hémopéricarde et/ou de la tamponnade (voir Tamponnade).
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
L’immobilité d’une zone akinétique et un bas débit ventriculaire peuvent créer les conditions pour la formation d’un thrombus mural, que l’on rencontre le plus fréquemment à l’apex du VG (Vidéos et Figure 27.32). Un thrombus peut être laminaire et ancré dans les trabéculations ou arrondi et mobile ; il est en général bien visible en vue mi-oesophagienne 2 cavités 90°, long axe 120° et transgastrique long axe 100-120° (on ne voit pas l'apex anatomique en vue mi-oesophagienne 4-cavités 0°). Le diagnostic différentiel avec des trabéculations ou un muscle papillaire est parfois difficile : le thrombus est inhomogène, ne se contracte pas et est séparé de la paroi par un plan de clivage. Son échogénicité est sensiblement différente de celle du muscle. Il est localisé sur une paroi hypo- ou akinétique. Il doit apparaître de manière identique dans au moins deux plans de coupe orthogonaux pour pouvoir poser le diagnostic. Ce dernier est facilité par l'utilisation de produit de contraste [8]. Le thrombus laminaire est bien ancré dans les trabéculations et ne présente pas de risque embolique ; un thrombus arrondi et sessile est plus dangereux. Il est habituel de réséquer ce dernier en cours de la revascularisation chirurgicale, mais pas le premier.
Vidéo: vue long-axe 110° du VG avec un gros thrombus dans la région apicale; le territoire antéro-apical est akinétique.
Vidéo: vue 2-cavités transgastrique du même cas que la vidéo précédente.

Figure 27.32 : Thrombus intraventriculaire gauche. A : thrombus antéro-apical laminaire en vue 4-cavités. B : thrombus apical mobile en vue 2-cavités (90°); on voit du contraste spontané dans le VG et l'appendice auriculaire gauche (AAG). C : thrombus localisé inhabituellement à la base de la paroi antérieure akinétique (vue 2-cavités 90°). D : image tronquée d’un apex normal en vue 2-cavités 90°, montrant simplement des trabéculations coupées tangentiellement. Pour poser le diagnostic de thrombus, il faut que la même image appa-raisse dans au moins 2 vues différentes, si possible orthogonales.
Hémopéricarde et tamponnade
Un épanchement péricardique plus ou moins compressif complique un infarctus dans 4-43% des cas de STEMI [1]. Il apparaît en général pendant la première semaine après l'accident aigu; c'est un signe de mauvais pronostic [4]. Il présente tous les signes échocardiographiques de l'hémopéricarde et/ou de la tamponnade (voir Tamponnade).
| Messages pour le chirurgien en cas de complications d’infarctus |
| Anévrysme, pseudo-anévrysme, rupture couverte: - Dimension (volume de la cavité), présence de thrombus, localisation de l’orifice, taille du collet, fonctionnement des muscles papillaires, présence d’IM - Epaisseur de la paroi, communication avec le péricarde - Epanchement et caillots péricardiques, tamponnade - Evaluation de la masse ventriculaire saine et de sa fonction - Evaluation du volume ventriculaire probable après résection - Risque de rupture: dissection seulement après clampage de l'aorte Communication interventriculaire: - Localisation, dimension, état du myocarde adjacent - Flux systolo-diastolique, gradient de pression VG – VD (PAPsyst = PAs – ΔP) - Fonction et taille VG et VD - Présence d’IT, d’IM Rupture de muscle papillaire: - Rupture partielle ou totale, pilier concerné, état de la commissure correspondante - Vmax de l’IM, flux veineux pulmonaire (reflux systolique) - Fonction VG et VD Thrombus: - Localisation, taille, degré d’ancrage dans les trabéculations |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- BIERE L, MATEUS V, CLERFOND G, et al. Predictive factors of pericardial effusion after a first acute myocardial infarction and successful reperfusion. Am J Cardiol 2015; 116:497-503
- DAVIS N, SISTINO JJ. Review of ventricular rupture: key concepts and diagnostic tools for success. Perfusion 2002; 17:63-7
- IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39:119-77
- JOBS A, EITEL C, POSS J, et al. Effect of pericardial effusion complicating ST-elevation myocardial infarction as predictor of extensive myocardial damage and prognosis. Am J Cardiol 2015; 116:1010-6
- JONES BM, KAPADIA SR, SMEDIRA NG, et al. Ventricular septal supture complicating acute myocardial infarction: a contemporary review. Eur Heart J 2014; 35:2060-8
- LANCELLOTTI P, PRICE S, EDVARDSEN T, et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and Acute Cardiovascular Care Association. Eur Heart J Cardiovasc Imaging 2015; 16:119-46
- MORILLON-LURUN S, MAUCORT-BOULCH D, MEWTON N, et al. Therapeutic management changes and mortality rates over 30 years in ventricular septal rupture complicating acute myocardial infarction. Am J Cardiol 2013; 112:1273-8
- VILLANUEVA C, MILDER D, MANGANAS C. Ruptured left ventricular false aneurysm following acute myocardial infarction: case report and review of the literature. Heart Lung Circ 2014; 23:e261-e263
