Parmi les inhibiteurs indirects de la thrombine, on compte l’héparine non-fractionnée (HNF), les héparines de bas poids moléculaire (HBPM), et des polysaccharides comme le fondaparinux et l’idraparinux. Ces agents sont mal absorbés par voie orale et doivent être administrés par voie parentérale (voir Tableaux 8.1, 8.2, 8.3, 8.11 et 8.12).
Héparine non-fractionnée (HNF)
L’héparine, primitivement extraite du foie et actuellement préparée à partir du tissu intestinal de porc, est un mélange hétérogène de polysaccharides (glycosaminoglycane) (poids moléculaire 8’000-30'000 Da) qui se lient à l’antithrombine III (AT III) et accélèrent la capacité de cette dernière à inhiber les facteurs IIa (thrombine) et Xa, accessoirement IXa, XIa et XIIa [1]. C’est donc un agent indirect dont l’action dépend de la présence d’AT III en quantité suffisante. Sans héparine, la thrombine et le Xa sont inhibés par l’AT III avec une demi-vie d’environ 1 minute. En présence d’héparine, cette réaction est potentialisée 700 à 4’000 fois [3]. L'AT III est également dotée de propriétés anti-inflammatoires indirectes en agissant sur la production de prostaglandines. La consommation importante d'AT III au cours d’une héparinisation complète peut donc activer les cellules de la lignée blanche et contribuer à la cascade inflammatoire après une CEC [12].
L’action de l’héparine sur l’AT III est double [16]. Premièrement, son fragment de haute affinité induit un changement de configuration de l'AT III qui augmente considérablement l’affinité de celle-ci pour les facteurs IIa et Xa. Deuxièmement, le fragment de faible affinité rapproche le facteur IIa du site d’action de l’AT III. Pour que l’AT III désactive la thrombine (IIa), les deux mécanismes, changement de conformation et rapprochement, sont aussi importants l’un que l’autre. Pour désactiver le facteur Xa, par contre, le rapprochement ne joue pas de rôle (Figure 8.10).
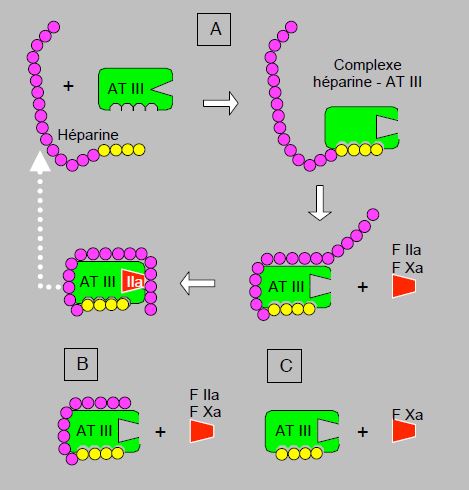
Figure 8.10 : Mécanisme d’action des inhibiteurs indirects de la thrombine (inhibiteurs de l’antithrombine III, ou AT III). A : héparine non fractionnée. Après la liaison avec son fragment de haute affinité pour l’AT III (fragment jaune), l’héparine induit un changement de conformation au niveau du site d’action de l’AT III, qui augmente sensiblement son affinité pour les facteurs IIa (thrombine) et Xa. Le fragment de basse affinité de la chaîne d’héparine (en violet) sert à rapprocher le facteur IIa du site d’action de l’AT III ; ce mécanisme n’est pas requis pour la fixation du facteur Xa. Une fois que l’AT III s’est fixée sur les facteurs IIa et Xa, un changement de conformation diminue l’affinité pour l’héparine, qui est libérée et peut se lier à une autre molécule d’AT III (flèche pointillée blanche). B : héparine de bas poids moléculaire. Le fragment de basse affinité est plus court, ce qui ne permet pas le rapprochement du facteur IIa. L’inhibition du facteur Xa est plus marquée que celle du facteur IIa. C : fundaparinux. La molécule ne possède que le fragment de haute affinité et ne peut donc induire que la fixation du facteur Xa par l’AT III.
Ces deux mécanismes différents expliquent les actions plus ou moins sélectives des différents dérivés de l’héparine. L’héparine non-fractionnée (HNF) a un rapport d’activité anti-Xa / anti-IIa de 1:1. Les héparines de bas poids moléculaire (HBPM), dont le fragment de faible affinité est plus court, ont un rapport anti-Xa / anti-IIa de 2-4:1 et le pentasaccharide fondaparinux, qui ne contient que le segment de haute affinité, inhibe sélectivement le facteur Xa. Une fois que l’AT III s’est fixée sur les facteurs, un changement de conformation diminue son affinité pour l’héparine, qui est libérée et peut se lier à une autre molécule d’AT III. Les héparines n’ont malheureusement aucune action sur la thrombine déjà fixée à la fibrine au sein d’un thrombus.
Par voie intraveineuse, l’HNF a une action immédiate, alors que les dérivés HBPM ont un delai d’action de 20 à 60 minutes. Les dosages recommandés par voie intraveineuse sont plus élevés en cas de thrombo-embolie qu’en cas de syndrome coronarien aigu (SCA) [4].
- Bolus initial : 80 UI/kg, ou 5'000 UI (SCA: 60-70 UI/kg) ;
- Entretien : 18 UI/kg/h, ou 32’000 UI/24 h (SCA : 12-15 UI/kg/h).
L’effet anticoagulant de l’HNF est très variable à cause d’une forte liaison à d’autres protéines, aux macrophages, aux plaquettes et à l’endothélium [8]. Les HBPM et le fondaparinux, au contraire, sont beaucoup moins liés et font preuve d’une action mieux prévisible. A cause de la variation interindividuelle de son effet, l’HNF requiert donc un monitorage constant. Son activité anticoagulante est bien corrélée à l’aPTT et à l’ACT (activated clotting time) (voir Monitorage). Les dérivés plus courts n’ont pas d’effet prévisible sur ces deux paramètres et sont donc plus difficiles à monitorer, mais leur surveillance n’est pas nécessaire parce que leur profil pharmacocinétique est plus stable.
L’HNF est résorbée et métabolisée par l’endothélium et le système réticulo-endothélial. Les métabolites sont inactifs et sont éliminés par voie rénale. La demi-vie biologique est fonction de la dose administrée : 30 minutes à la dose de 25 U/kg, 1 heure à la dose de 100 U/kg et 2.5 heures à la dose de 400 U/kg [3]. L’hypothermie ralentit considérablement la clairance de l’héparine. L’HNF est l’inhibiteur de thrombine le plus utilisé en CEC à cause de sa facilité d’administration, de sa réversibilité par la protamine, et de la possibilité de mesurer son activité avec des tests de coagulation comme l’ACT. Bien qu’il présente une relation quasi linéaire avec le taux d’héparine sérique, l’ACT, n’est pas spécifique pour cette dernière, et peut présenter une certaine variabilité [14]. Mais une des limitations majeures de l’HNF est son incapacité à inhiber la thrombine liée à la fibrine dans un thrombus. En effet, la thrombine située dans les microthrombi formés sur les surfaces artificielles est hors d'atteinte de l'héparine. Des inhibiteurs directs de la thrombine (lépirudine, bivalirudine, argatroban) ont été développés pour mieux inhiber la thrombine intégrée dans le thrombus, mais leur application de routine en clinique est limitée par leur absence d’antagoniste (voir Inhibiteurs directs de la thrombine). Les HBPM et le fondaparinux, qui ne peuvent pas non plus être antagonisés, n’ont pas suffisamment d’activité anti-IIa pour être utiles dans les systèmes circulatoires extracorporels.
L'héparine en forte concentration (≥ 300 UI/kg) induit une libération de lipoprotéine-lipase et de lipase hépatique, ce qui hydrolyse les triglycérides plasmatiques en acides gras non-estérifiés (FFA: free fatty acids), dont le taux s’élève de 15-20%. Ces acides gras libres se lient aux protéines plasmatiques et déplacent les substances qui y sont fixées, ce qui augmente la concentration libre de ces dermières, donc leur activité pharmacologique. Ce processus a lieu en quelques minutes [13].
Il arrive que certains patients présentent une résistance à l’héparine : malgré une dose adéquate, l’aPTT et l’ACT ne sont pas prolongés comme attendu. Plusieurs phénomènes expliquent cette réponse insuffisante (voir Coagulopathie peropératoire) [4].
- Insuffisance en AT III, particulièrement fréquente chez les malades depuis plusieurs jours sous des doses thérapeutiques d’héparine ;
- Haut degré de fixation de l’HNF aux protéines sériques ;
- Clairance accélérée de l’HNF ;
- Taux excessif de facteur VIII ;
- Taux excessif de fibrinogène.
Héparines de bas poids moléculaire (HBPM)
Développées dans les années 1980, les HBPM sont dérivées de l’héparine par dépolymérisation. Leur poids moléculaire varie de 2’000 à 9’000 Da. Avec leur segment de haute affinité, elles peuvent induire le changement de configuration nécessaire pour que l’AT III fixent les facteurs IIa et Xa, mais leur chaîne est trop courte pour bien affronter le IIa (thrombine), ce qui explique leur action plus faible contre celle-ci. Par contre, elles ont une activité anti-Xa supérieure [1]. Leur taille plus petite explique leur faible liaison plasmatique et endothéliale, ce qui rend leur action plus prédictible. Leur effet est mal évalué par l’ACT, mais peut être mesuré par le dosage de l’effet anti-Xa. Leur demi-vie varie de 4 à 7 heures, mais elle est prolongée jusqu’à 17 heures lorsque la clairance de la créatinine est < 30 mL/min. Leur élimination par les reins les rend inappropriées en cas d’insuffisance rénale et oblige à espacer ou à diminuer les doses de moitié lorsque la clairance de la créatinine est < 50 mL/min [11,15]. Les HBPM sont moins immunogéniques que l’HNF et induisent moins fréquemment des thrombocytopénies (voir HIT). Leur dosage varie selon l’indication (voir Tableau 8.3). Un mg d’enoxaparine correspond à environ 100 UI d’effet anti-Xa [4].
- Prophylaxie (sous-cutané):
- Enoxaparine (Clexane®, Lovenox®) 40 mg/j à 30 mg 2 x/j;
- Nadroparine (Fraxiparine®) 5700 U/j;
- Daltéparine (Fragmin®) 5’000 U/j.
- Thérapeutique (sous-cutané):
- Enoxaparine 1 mg/kg/12h;
- Nadroparine 95 U/kg/12h;
- Daltéparine 120 U/kg/12h.
Ces dosages sont réduits de moitié lors d’insuffisance rénale. En préopératoire, les délais entre la dernière injection sous-cutanée et la chirurgie sont de 12 heures lors de prophylaxie et de 24 heures lors de dose thérapeutique. La première injection postopératoire a lieu 6-12 heures après la fin de la chirurgie en cas de prophylaxie, pour autant que l’hémostase soit contrôlée. Elle est prolongée à 24-48 heures en cas de dosage thérapeutique ou d’hémorragie postopératoire.
Protamine
La protamine, originellement extraite du sperme de saumon, est aujourd’hui produite par technologie recombinante. C’est une molécule polycationique chargée positivement qui forme des complexes stables avec l'héparine, qui est chargée négativement. La protamine dissocie les complexes héparine-antithrombine. Sa demi-vie plasmatique est de 7 minutes, alors que celle de l’héparine est de 60-120 minutes [4]. Un mg de protamine (100 UI) neutralise 1 mg d'héparine (100 UI). Habituellement, on administre une dose de protamine correspondant aux 80% de la dose d'héparine; un ACT fait 5 minutes après la fin de l’administration de protamine doit être dans une limite de ± 10% par rapport à la valeur de départ avant CEC. Malheureusement, la relation entre le taux d'héparine et l'ACT post-CEC est non-linéaire et peu performante. Un dosage basé sur l’héparinémie réelle du patient (système Hepcon/HMS™), sur la thromboélastographie (HEPTEM) ou sur un algorithme pharmacocinétique conduit à donner des quantités moindres (rapport protamine/héparine 0.5-0.8:1) et réduit de ce fait l'hypocagulabilité, la fibrinolyse et la dysfonction plaquettaire engendrées par la protamine (voir ci-dessous) [2].
La neutralisation de l’effet des HBPM est possible à raison de 1 mg de protamine pour 100 UI d’effet anti-Xa (dose maximale : 50 mg), à la condition d’être à moins de 8 heures après l’administration d’HBPM ; cet antagonisme n’est que partiel (60%) et d'autant plus faible que la molécule d'HBPM est plus petite [4]. La protamine ne se lie pas aux pentasaccharides (fondaparinux), et ne peut donc pas les antagoniser.
La protamine présente plusieurs effets secondaires immédiats, dont l’incidence varie de 1 à 13% des cas (moyenne 2.6%) [2,6,7].
- Libération d'histamine, qui se caractérise par une vasodilatation importante avec baisse de précharge et de postcharge; elle est directement proportionnelle à la vitesse d'administration (réaction de type I), raison pour laquelle il est recommandé de perfuser la protamine diluée dans 100 mL NaCl 0.9% en 10 minutes. Il est très fréquemment nécessaire d'accélérer les perfusions et de donner un vasoconstricteur (néosynéphrine ou nor-adrénaline) pour contrecarrer cet effet.
- Hypertension pulmonaire ; le complexe héparine-protamine déclenche la libération de thromboxane A2, qui est un vasoconstricteur pulmonaire ; la PAP s’élève de 25-50%.
- Réaction antigène – anticorps (IgG et IgE) (réaction de type II); plus rare, celle-ci se rencontre chez les diabétiques traités par une insuline stabilisée avec de la protamine (protamine-Zn), chez les malades réopérés qui ont déjà reçu de la protamine, chez les patients allergiques aux poissons, et chez les hommes vasectomiés.
- Réaction anaphylactoïde déclenchée par le complexe héparine-protamine en activant directement la voie classique du complément (C4a) sans l'intermédiaire d'une réaction antigène-anticorps (réaction de type III, qui survient dans 1.5% des cas). Le tableau clinique est celui d'une réaction anaphylactique majeure avec hypotension sévère; la libération massive de thomboxane, déclenche une hypertension pulmonaire et une bronchoconstriction qui peuvent être foudroyantes. Le traitement comprend l'hydrocortisone, la prostaglandine E1 et des vasoconstricteurs (noradrénaline, vasopressine, bleu de méthylène).
- En l’absence d’héparine, ou en excès par rapport à l’héparine (rapport protamine/héparine > 1.3:1), la protamine a un effet anticoagulant par trois mécanismes différents. Elle provoque une thrombocytopénie et une diminution de l'agrégabilité paquettaire d'environ 50%; elle freine l'activation des des facteurs V et VII; elle induit une fibrinolyse [2]. Les pertes sanguines augmentent de 26% lorsque le rapport héparine:protamine est 1.3 au lieu de 0.8 [9].
Les patients sont sensibilisés à la protamine par une précédente opération cardiovasculaire ou par une insuline contenant de la protamine comme stabilisateur; les malades allergiques aux protéines de poisson sont susceptibles de développer une réaction violente. Les patients à risque peuvent être anticoagulés avec de la bivalirudine, dont l'effet n'est pas reneversé par la protamine, ou opérés avec des circuits de CEC pré-héparinés et une héparinisation systémique réduite (100 UI/kg), ce qui permet éventuellement d’éviter l’administration de protamine [10]. Une dose de stéroïde pendant la CEC (500 mg méthylprednisolone) et une injection très lente (perfusion sur 20 minutes) par une voie périphérique peuvent diminuer l’intensité de la réaction chez un malade allergique.
Pentasaccharides: fondaparinux (Arixtra®)
Les pentasaccharides sont des analogues synthétiques de la séquence de saccharides qui lie l’héparine à l’AT III (voir Figure 8.10). Ils correspondent au segment de haute affinité, qui est la longueur de chaîne minimale requise pour induire le changement de conformation, sans n'avoir aucune capacité de rapprochement. Donc, incapables d’inhiber le facteur IIa (thrombine), ils inhibent sélectivement le facteur Xa [15]. Ces agents ne se lient pas à d’autres protéines ni à des membranes cellulaires, et présentent de ce fait une pharmacocinétique linéaire et une courbe dose-réponse bien prédictible. Ils ne réclament pas de monitorage particulier, mais nécessitent une administration sous-cutanée.
Le fondaparinux (Arixtra®), dont la demi-vie est de 16-17 heures, n'est pas métabolisé mais entièrement excrété par les reins. Il doit être évité en cas d’insuffisance rénale (clairance de la créatinine < 20 mL/min), diminué à 1.5 mg/j si la clairance est de 20-30 mL/min et de moitié si elle est de 30-50 mL/min [4]. Il est indiqué dans la prévention des évènements thrombo-emboliques. La valeur-cible pour une concentration plasmatique à valeur prophylactique est 0.2-0.7 mcg/mL. L’effet est mesuré par l’activité anti-Xa calibrée pour la substance, mais n'est pas nécessaire de routine. Le dosage est 7.5 mg 1 fois par jour par voie sous-cutanée. Chez les obèses (> 100 kg), il est augmenté à 10 mg/j [5]. La protamine ne renverse pas l’effet du fondaparinux, qui n’a pas d’antagoniste spécifique (voir Antagonisme).
L’idraparinux est un analogue du fondaparinux avec une longue demi-vie (130 heures); il suffit d’une injection sous-cutanée par semaine. L’adjonction de biotine à la molécule (idrabiotaparinux) permet l’action d’un antagoniste, l’avidine, qui se lie à la biotine [15].
| Agents anti-thrombine indirects |
|
L’héparine se lie à l’antithrombine III (AT III) et accélère 2’000 fois la capacité de cette dernière à inhiber les facteurs IIa (thrombine) et Xa. Son action dépend d’une quantité suffisante d’AT III. L’héparine non fractionnée (HNF) a un rapport d’activité anti-Xa / anti-IIa de 1:1. Les héparines de bas poids moléculaire (HBPM) ont un rapport anti-Xa / anti-IIa de 2-4:1 ; le fondaparinux inhibe sélectivement le facteur Xa.
L’HNF se lie à d’autres protéines et son activité est très variable, d’où la nécessité d’un monitorage par l’aPTT et l’ACT. Par voie iv, son effet est immédiat, mais sa demi-vie biologique (1-2.5 heures) est fonction de la dose administrée. Elimination par le système réticulo-endothélial. L’HNF n’inhibe pas la thrombine liée à la fibrine dans un thrombus. Antagoniste: protamine; 1 mg de protamine (100 UI) neutralise 1 mg d'héparine (100 UI). Risque de thrombocytopénie (HIT): 1-5%. Délai d’interruption préopératoire de la perfusion: 4 heures. Dosages iv :
- Thrombo-embolie aiguë: bolus 80 UI/kg (5'000 UI), entretien 18 UI/kg/h (32’000 UI/24h)
- Syndrome coronarien aigu: bolus 60-70 UI/kg, entretien 12-15 UI/kg/h
- CEC: 300-400 UI/kg iv
Les HBPM (Clexane®, Lovenox®, Fraxiparine®, etc) ont plus d’effet anti-Xa que d’effet anti-thrombine. Leur demi-vie varie de 4 à 7 heures, mais elle est prolongée jusqu’à 17 heures lorsque la clairance de la créatinine est < 50 mL/min. En cas d’insuffisance rénale, diminution des doses de moitié ou abstention. La protamine est un antagonsite partiel. Dosages sous-cut :
- Prophylactique : 5'000-10’000 UI /j ; délai d’interruption préopératoire: 12 heures
- Traitement : 20'000 UI/j (250 UI/kg/j) ; délai d’interruption préopératoire: 24 heures
Le fondaparinux (Arixtra®) inhibe sélectivement le facteur Xa. Sa demi-vie est de 16-17 heures, il est excrété par les reins, En cas d’insuffisance rénale, diminution des doses de moitié ou abstention. Dosage sous-cut : 7.5 mg/jour. Pas d’antagoniste. Délai d’interruption préopératoire: 48-72 heures.
Protamine: renverse l'effet de l'HNF dans une proportion 1 mg pour 1 mg. Dose habituelle: 80% de la dose d'HNF en iv lent (10 minutes). Effets secondaires: hypotension, réaction AG-AC, choc anaphylactoïde avec hypertension pulmonaire et vasoplagie; en surdosage (rapport HNF/protamine > 1.3:1), effet anticoagulant.
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- ADAMS RLC, BIRD RJ. Review article: Coagulation cascade and therapeutic update: Relevance to nephrology. Part I: Overview of coagulation, thrombophilia and history of anticoagulants. Nephrol 2009; 14:462-70
- BOER C, MEESTERS MI, VEERHOEK, VONK ABA. Anticoagulant and side-effects of protamine in cardiac surgery: a narrative review. Br J Anaesth 2018; 120:914-27
- FINLEY A, GREENBERG C. Heparin sensitivity and resistance : management during cardiopulmonary bypass. Anesth Analg 2013 ; 116 :1210-22
- GARCIA DA, BAGLIN TP, WEITZ JI, et al. Parenteral anticoagulants: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e24S-e43S
- HOLBROOK A, SCHULMAN S, WITT DM, et al. Evidence-based management of anticoagulant therapy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e152S-e184S
- KIMMEL SE, SEKERES M, BERLIN JA, et al. Mortality and adverse events after protamine administration in patients undergoing cardiopulmonary bypass. Anesth Analg 2002; 94:1402-8
- LOWENSTEIN E, ZAPOL WM. Protamine reactions, explosive mediator release and pulmonary vasoconstriction. Anesthesiology 1990; 73:373-8
- MANSON L, WEITZ JI, PODOR TJ, et al. The variable anticoagulant response to unfractioned heparin in vivo reflects binding to plasma proteins rather than clearance. J Lab Clin Med 1997; 130:649-655
- MEESTERS MI, VEERHOEK D, DE LANGE F, et al. Effect of high or low protamine dosing on postoperative bleeding following heparin anticoagulation in cardiac surgery. Thromb Haemost 2016; 116:251-61
- MUKADAM ME, PRITCHARD D, RIDDINGTON D, et al. Case 7-2001. Management during cardiopulmonary bypass of patients with presumed fish allergy. J Cardiothorac Vasc Anesth 2001; 15:512-9
- NUTESCU EA, SPINLER SA, WITTKOWSKY A, et al. Low-molecular-weight heparins in renal impairment and obesity: available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother 2009; 43:1064-83
- RANUCCI M, CAZZANIGA A, SORO G, et al. The anti-thrombin III saving effect of reduced systemic heparinization and heparin-coated circuits. J Cardiothorac Vasc Anesth 2002; 16:316-20
- ROSEN D, ROSEN K. Elimination of drugs and toxins during cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1997; 11:337-40
- ROZENTAL T, SHORE-LESSERSON L. Pharmacologic management of coagulopathy in cardiac surgery: An update. J Cardiothorac Vasc Anesth 2012; 26:660-79
- SINAURIDZE EI, PANTELEEV MA, ATAULLAKHANOV FI. Anticoagulant therapy: basic principles, classic approaches and recent developments. Blood Coag Fibrinol 2012; 23:482-93
- WEITZ JI, HIRSH J. New anticoagulant drugs. Chest 2001; 119:95s-107s
