Dans le but de mieux moduler l'hémodynamique et de réduire la réponse inflammatoire, on a récemment créé le concept de "Mini-CEC" ou MiECC (Minimally invasive Extra-Corporeal Circulation) qui vise à réduire le volume d'amorçage du circuit et à supprimer la surface de contact air-sang. A cet effet, la longueur des tuyaux est diminuée (< 1 m) et le réservoir de cardiotomie est abandonné. La pompe est une pompe de type centrifuge qui est responsable à la fois du drainage veineux par aspiration et de la propulsion du sang dans l'artère; elle est sensible à la précharge et à la postcharge. Ce système fonctionne à volume constant. Il est complété par un oxygénateur à membrane, un échangeur de chaleur et un filtre à bulle du côté veineux (Figure 7.16).
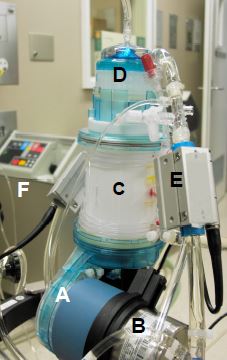
Figure 7.16 : Mini-CEC (appareil ECC.O™ de Dideco). A: pompe centrifuge non-occlusive. B: échangeur thermique. C: oxygénateur. D: filtre artériel. E: moniteur de bulles et de saturation artérielle sur le circuit artériel. F: système externe de refroidissement et de réchauffement de l'eau pour l'échangeur thermique.
Le flux artériel est directement couplé au retour veineux; c'est la capacitance centrale du patient qui constitue le réservoir veineux; la PVC doit donc rester entre 3-8 mmHg. Le sang aspiré dans le champ opératoire doit être traité par CellSaver™ avant d’être rendu au malade. Pour la chirurgie valvulaire ou les cas complexes, l'absence de réservoir est compensée par un système permettant l'aspiration du sang de cardiotomie dans un réservoir souple ou un bac rigide sous vide régulé, qui est externe au système et qui fait office de vase d'expansion placé en dérivation sur la ligne veineuse [7]. Plusieurs systèmes sont actuellement sur le marché: MECC™ de Jostra (amorçage 450 mL), ECC.O™ de Dideco (amorçage < 600 mL), IDEAL™ de Sorin Biomedica (amorçage 900 mL), etc. On peut encore diminuer le volume d'amorçage en procédant à un remplissage partiel rétrograde une fois le patient canulé: 150-200 mL de sang sont aspirés par la canule aortique dès la canulation de CEC.
La mini-CEC n'est pas seulement un circuit plus petit mais une stratégie particulière impliquant le chirurgien, l'anesthésiste et le perfusioniste. Elle est constituée d'un ensemble comprenant [5]:
- Circuit de CEC fermé de volume limité.
- Surface biocompatible (heparin-coated) des composants en contact avec le sang.
- Volume d'amorçage réduit (< 750 mL).
- Trappe à bulle sur le circuit veineux.
- Pompe centrifuge (assure à la fois le drainage veineux et la propulsion artérielle); différents modèles existent sur le marché: BioMedicus™, CentriMag™, RotaFlow™, Capiox™.
- Oxygénateur à membrane (micropore); la miniaturisation de l’oxygénateur en réduit la surface d’échange, ce qui contraint à maintenir une Hb ≥ 10% plus élevée que dans les circuits conventionnels.
- Echangeur de chaleur.
- Circuit de cardioplégie indépendant.
- Aspiration de cardiotomie avec lavage du sang, indépendante du circuit.
Le système comprend différents degrés de complexité (Figure 7.17) [1].
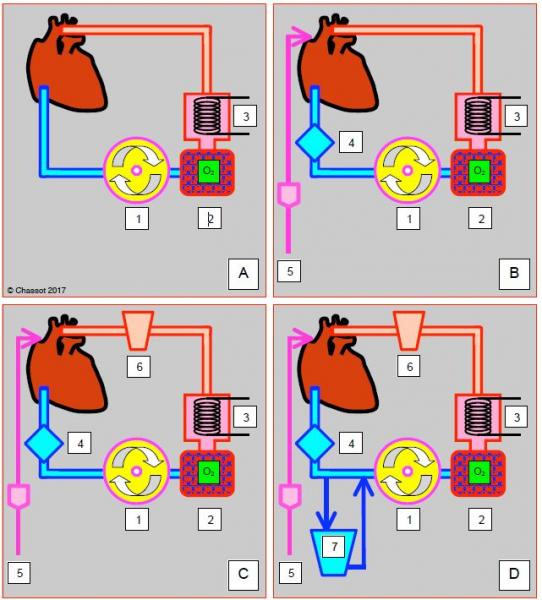
Figure 7.17: Représentation schématique des divers montages de mini-CEC. A: Système minimal (type I); drainage veineux de l'OD dans la pompe (1) qui propulse le sang dans l'oxygénateur (2) et l'échangeur thermique (3) puis dans l'aorte. B: Type II; ne trappe à bulle est ajoutée sur le ciruit veineux (4); l'aspiration de cardiotomie (5) est drainée, lavée et rendue dans un circuit indépendant. C: Type III; un réservoir collabable (6) permet de collecter le sang des aspirations. D: Type IV; l'addition d'un réservoir veineux rigide (7) en dérivation du retour de l'OD crée un circuit semi-ouvert voisin d'un circuit conventionnel [1].
- Type I: drainage veineux de l'OD → pompe → oxygénateur/échangeur thermique → canule artérielle avec filtre; c'est le système le plus simple, mais il n'est pas protégé contre le risque d'aspiration d'air par les canules veineuses.
- Type II: idem, avec addition d'une trappe à bulle sur le retour veineux, et possibilité d'aspirer et de récupérer le sang des drainages de cardiotomie (VG, veine pulmonaire, aorte); celui-ci est aspiré, lavé et rendu dans un circuit indépendant.
- Type III: identique au type II, avec adjonction d'un réservoir souple (sans contact sang – air) pour stocker et reperfuser le sang.
- Type IV: identique au type III, avec montage d'un réservoir rigide externe sur le retour veineux; dans ce cas, le système fermé devient un système semi-ouvert.
Bien que plus délicate à gérer qu'un circuit standard, la MiECC présente un certain nombre d'avantages biologiques et cliniques [5].
- Hémodilution réduite: Ht plus élevé de 25% en sortant de pompe; le taux de transfusions est réduit de 50-75%, ce qui en fait un système particulièrement indiqué chez les patients qui les refusent [4,15, 17,19].
- Héparinisation moindre (150 UI/kg): l'ACT recherché est 300-350 sec pour les pontages aorto-coronariens et 400-450 sec pour la chirurgie valvulaire [9].
- Diminution des altérations de la coagulation grâce aux circuits biocompatibles, à la faible hémodilution et à la pompe centrifuge non-occlusive; le taux de plaquettes post-CEC est 25% plus élevé [15,19].
- Atténuation de la réponse inflammatoire grâce aux circuits pré-héparinés et biocompatibles, à la réduction de la surface de contact plastic-sang, et à l'absence de contact sang-air. Les marqueurs du SIRS sont abaissés [6,10].
- Meilleure adaptation aux techniques anesthésiques de fast-track [3].
D'autres avantages sont évoqués par les partisans de la MiECC, bien qu'ils soient controversés et ne fassent pas l'unanimité dans la littérature.
- PAM en moyenne plus élevée, meilleure perfusion splanchnique [17].
- Réduction (douteuse) de l'incidence de FA de 50% [2,6].
- Préservation de la fonction rénale; l'augmentation postopératoire de la créatinine est inférieure de 20% [11,15].
- Amélioration de la protection myocardique; le taux de CK MB postopératoire est diminué et le besoin en catécholamine est diminué de moitié [12,15].
- Diminution des micro-embolies gazeuses: diminution des troubles neurocognitifs (OR 0.30-0.56) [8,14,19].
- Amélioration fonctionnelle des organes-cibles (poumon, foie, intestin), taux de lactate abaissé [18].
- Réduction de mortalité lors de pontages aorto-coronariens dans certaines études [2,16].
Avec ce type de circuit, il est bon que les malades soient relativement hypervolémiques au moment de la connexion, puisque c’est le malade qui est le réservoir veineux de la CEC. La capacitance veineuse du patient est donc critique pour la stabilité hémodynamique. Celle-ci est assurée par la position (élévation des jambes, Trendelenburg/anti-Trendelenburg) et par des agents vasoactifs (phényléphrine 100 mcg, nitroglycérine 25-50 mcg). Pour la canulation et la décanulation ou pour le clampage aortique, la PAM est abaissée en outre par un frein au retour veineux (compression chirurgicale) ou par un pacing rapide. Le système ne présente aucun problème de bilan postopératoire parce que l’apport hydrique est beaucoup plus faible qu'avec les circuits conventionnels. Lors du sevrage, le clampage veineux est progressif comme la réduction du débit de la pompe. Ces systèmes se prêtent particulièrement bien à l’assistance circulatoire à cœur battant, qui combine l’absence de cardioplégie au soutient hémodynamique par une machine cœur-poumon; on élimine ainsi les risques de l’arrêt cardiaque et du clampage aortique tout en conservant les avantages d’une pompe pour la confection des anastomoses coronariennes délicates.
Avec ces systèmes, l'adéquation est parfaite entre le sang drainé et le volume réinfusé par la pompe. Ainsi, en cas de faible retour veineux ou de prise accidentelle d'air (environ 50 mL), le système s'arrête. A l’inverse, une augmentation du retour veineux nécessite une accélération du débit de la pompe. La conduite de la CEC est donc plus délicate, le débit de pompe est ajusté en permanence. L'anesthésiste doit veiller à l'absence totale de bulles d'air introduites par les voies veineuses: robinets fermés, capuchons sur les sites d'injection, médicaments administrés de préférence en perfusion plutôt qu'en bolus, curarisation pour éviter les mouvements respiratoires, etc. Lorsque la technique est bien maîtrisée et la coordination satisfaisante entre le chirurgien, l'anesthésiste et le perfusioniste, l'hémodynamique est très stable et la pression de perfusion mieux maintenue qu'avec les systèmes traditionnels. Les cas à haut risque en sont les principaux bénéficiaires.
Pour l’anesthésiste, ce type de circuit a plusieurs implications pratiques.
- Ajustement constant de la pression et du débit au moyen d’agents vasopresseurs ou vasodilatateurs pour maintenir la précharge de la CEC; modifications de la position.
- Technique de type fast-track: dose totale d'opiacé réduite, dexmédétomidine en perfusion.
- Anesthésie intraveineuse (perfusion de propofol) ou par inhalation (vaporisateur d'halogéné sur l'arrivée des gaz frais).
- Maintien d’une précharge normale à élevée avant la CEC (perfusion de 500 mL cristalloïdes + 500 mL colloïde en pré-pompe).
- Gestion du retour des aspirations par le CellSaver™.
- Indications à la transfusion très restrictive.
Malgré les bénéfices décrits dans les publications qui lui sont le plus favorables, la MiECC ne s'est pas généralisée comme une technique de routine, car elle présente indéniablement une gestion plus tendue et une marge de manœuvre plus faible que la CEC conventionnelle. De plus, elle n'est pas adaptée à tous les types de chirurgie.
Système Port-access™ (HeartPort)
Ce système vise à pratiquer la chirurgie cardiaque de manière minimalement invasive en assurant toute la canulation de CEC par voie strictement percutanée. Il comprend plusieurs éléments (Figure 7.18) [13,18].
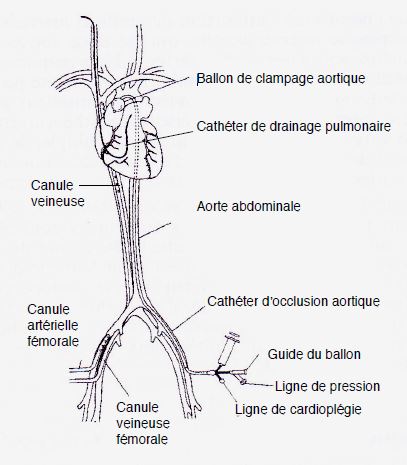
Figure 7.18 : Système de canulation Port-access™ (HeartPort, USA). Toutes les canules de CEC sont insérées par voie percutanée. La canule artérielle est en position fémorale. La canule veineuse est montée depuis la veine fémorale jusque dans l’OD. Le clampage aortique est réalisé par un ballon monté sur un cathéter et gonflé dans l’aorte ascendante ; ce cathéter sert également à administrer la cardioplégie. Le drainage du VG est assuré par un cathéter positionné dans le tronc de l’AP depuis la jugulaire interne droite. Le sinus coronaire est canulé par voie jugulaire interne droite.
- Canule artérielle de CEC dans l’artère fémorale;
- Canule veineuse de CEC dans la veine fémorale et remontée jusque dans l’OD;
- Cathéter introduit par voie artérielle fémorale et remonté jusque dans la racine de l’aorte; ce cathéter est muni d’un ballon occlusif qui est gonflé dans l’aorte ascendante (équivalent du clampage aortique); son extrémité distale permet d’administrer la cardioplégie par voie antérograde et de mesurer la pression dans la racine de l’aorte;
- Cathéter de drainage introduit par voie jugulaire interne droite jusque dans le tronc de l’AP;
- Cathéter de cardioplégie rétrograde (sinus coronaire) introduit par voie jugulaire interne droite.
Le positionnement des cathéters est réalisé sous contrôle ETO. La position du ballon de clampage aortique doit être surveillée en permanence, car celui-ci se déplace facilement: s’il avance, il va s’impacter dans la valve aortique et créer une insuffisance aiguë; s’il recule, il va bloquer les vaisseaux de la crosse aortique et occlure la perfusion cérébrale. Un cathéter artériel radial droit et les saturations cérébrales (ScO2) permettent de contrôler le flux dans le tronc brachio-céphalique.
Après un enthousiasme initial, cette technique peine à trouver sa place, hormis en chirurgie robotique. Il est vrai qu’elle est compliquée et coûteuse, qu’elle rallonge la durée de l’opération et qu’elle comporte ses propres risques. Son seul intérêt est de permettre une réelle non-invasivité dans le cadre d’une chirurgie par thoracoscopie ou par mini-incisions.
| Mini-CEC |
| La miniaturisation des circuits et la suppression du réservoir de cardiotomie minimise le contact du sang avec des surfaces étrangères et supprime le contact avec l’air, ce qui freine la libération des déclencheurs inflammatoires. Le faible volume du système (600-900 mL) et l’amorçage autologue réduisent l’hémodilution. Mais l’absence de réservoir de compliance entre le malade et la CEC rend la prise en charge plus délicate et non applicable à tous les types de chirurgie. |
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- ANASTASIADIS K, ANTONITSIS P, ARGIRIADOU H, et al. Modular minimally invasive extracorporeal circulation systems; can they become the standard practice for performing cardiac surgery ? Perfusion 2015; 30:195-200
- ANASTASIADIS K, ANTONITSIS P, HAIDICH AB, et al. Use of minimal extracorporeal circulation improves outcome after heart surgery ; a systematic review and meta-analysis of randomized control trials. Int J Cardiol 2013; 164:158-69
- ANASTASIADIS K, ASTERIOU C, ANTONITSIS P, et al. Enhanced recovery after elective coronary revascularisation surgery with minimal versus conventional extracorporeal circulation: a prospective randomized study. J Cardiothorac Vasc Anesth 2013; 27:859-64
- ANASTASIADIS K, ASTERIOU C, DELIOPOULOS A, et al. Haematological effects of minimal compared to conventional extracorporeal circulation after coronary revascularisation procedures. Perfusion 2010; 25:197-203
- ANASTASIADIS K, MURKIN J, ANTONITSIS P, et al. Use of minimal invasive extracorporeal circulation in cardiac surgery: principles, definitions and potential benefits. A position paper from the Minimal invasive Extra-Corporeal Technologies international Society (MiECTiS). Interact Cardiovasc Thorac Surg 2016; 22:647-62
- BIANCARI F, RIMPILAINEN R. Meta-analysis of randomised trials comparing the effectiveness of miniaturised versus conventional cardiopulmonary bypass in adult cardiac surgery. Heart 2009; 95:964-9
- CALDERON J, SIGONNEY P, JANVIER G. MECC: minimal extra-corporeal circulation. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris, Arnette Groupe Liaison SA, 2004, pp 541-7
- EL-ESSAWI A, HAJEK T, SKORPIL J, et al. Are minimized perfusion circuits the better heart-lung machines ? Final results of a prospective randomized multicentre study. Perfusion 2011; 26:470-8
- FROMES Y, DAGHIDJIAN K, CAUMARTIN L, et al. A comparison of low vs conventional dose heparin for minimal cardiopulmonary bypass in coronary artery bypass grafting surgery. Anaesthesia 2011; 66:488-92
- FROMES Y, GAILLARD D, PONZIO O, et al. Reduction of the inflammatory response following coronary bypass grafting with total minimal extracorporeal circulation. Eur J Cardiothorac Surg 2002; 22:527-33
- HUYBREGTS RA, MORARIU AM, RAKHORST G, et al. Attenuated renal and intestinal injury after use of a mini-cardiopulmonary bypass system Ann Thorac Surg 2007; 83:1760-6
- NGUYEN BA, SULEIMAN MS, ANDERSON JR, et al. Metabolic derangement and cardiac injury early after reperfusion following intermittent cross-clamp fibrillation in patients undergoing coronary artery bypass graft surgery using conventional or miniaturized cardiopulmonary bypass. Mol Cell Biochem 2014; 395:167-75
- PREISMAN S, KEIDAN I, PEREL A, et al. Anesthesia for port-access cardiac surgery in a pediatric population. J Cardiothorac Vasc Anesth 2005; 19:526-9
- REINEKE D, WINKLER B, KONIG T, et al. Minimized extracorporeal circulation does not impair cognitive brain function after coronary artery bypass grafting. Interact CardioVasc Thorac Surg 2015; 20:68-73
- REMADI JP, RAKOTOARIVELO Z, MARTICHO P, et al. Prospective randomized study comparing coronary artery bypass grafting with the new mini-extracoproreal circulation Jostra System or with standard cardiopulmonary bypass. Am Heart J 2006; 151:198.e1-198.e7
- RIED M, HANEYA A, KOLAT P, et al. Emergency coronary artery bypass grafting using minimized versus standard extracorporeal circulation – a propensity score analysis. J Cardiothorac Surg 2013; 8:59
- SAKWA MP, EMERY RW, SHANNON FL, et al. Coronary artery bypass grafting with a minimized cardiopulmonary bypass circuit: a prospective randomized trial. J Thorac Cardiovasc Surg 2009; 137:481
- VISTARINI N, AIELLO M; MATTIUCCI G, et al. Port-access minimally invasive surgery for atrial septal defects: a 10-year single-center experience in 166 patients. J Thorac Cardiovasc Surg 2010; 139:139-45
- ZANGRILLO A, GAROZZO FA, BIONDI-ZOCCAI G, et al. Miniaturized cardiopulmonary bypass improves short-term outcome in cardiac surgery: a meta-analysis of randomized controlled trials. J Thorac Cardiovasc Surg 2010; 139:1162-9
