L'anomalie d'Ebstein est caractérisée par un déplacement apical de l’implantation des feuillets septal et postérieur de la valve tricuspide de plus de 0.8 cm/m2 à l'intérieur du VD. Ces deux feuillets présentent une mobilité réduite à cause du raccourcissement et de la fibrose progressive des cordages, alors que le feuillet antérieur reste en général souple, mobile et normalement positionné, mais allongé et fenestré. L'orifice anormal de cette tricuspide dirige le flux diastolique vers la CCVD et non vers l'apex du VD. La cavité ventriculaire droite est petite; la chambre d'admission du VD se retrouve faire partie de l'oreillette droite; elle est dite "atrialisée". L'OD est très dilatée. Une CIA est présente dans > 50% des cas. Le VD est très restrictif malgré son aspect arrondi; il est fonctionnellement insuffisant (Vidéo) [2].
Vidéo: Dysfonction et dilatation de la cavité ventriculaire droite partiellement atrialisée dans une maladie d'Ebstein; le feuillet septal de la valve tricuspide est bas-inséré sur le septum; le feuillet antérieur, très long, est normalement inséré mais ne suffit pas à occlure la valve en systole; le feuillet postérieur est atrétique.
La valve tricuspide peut être insuffisante, sténotique, ou les deux (Figure 14.41).
Vidéo: Dysfonction et dilatation de la cavité ventriculaire droite partiellement atrialisée dans une maladie d'Ebstein; le feuillet septal de la valve tricuspide est bas-inséré sur le septum; le feuillet antérieur, très long, est normalement inséré mais ne suffit pas à occlure la valve en systole; le feuillet postérieur est atrétique.
La valve tricuspide peut être insuffisante, sténotique, ou les deux (Figure 14.41).
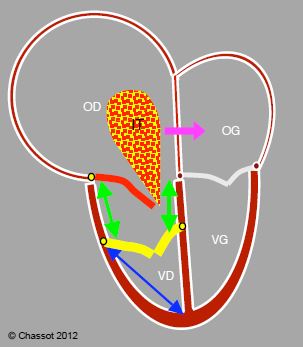
Figure 14.41 : Maladie d’Ebstein. Les feuillets septal et postérieur de la tricuspide (en jaune) sont bas insérés (> 1.5 cm en dessous de l’insertion de la valve mitrale), alors que le feuillet antérieur (en rouge) est en position normale ; la chambre d’admission du VD se retrouve dans l’OD (flèches vertes). L’OD est très dilatée, le VD est très restrictif. L’insuffisance tricuspidienne (IT) est en général importante. S’il existe un FOP ou une CIA, le shunt est fréquemment D-G et cyanogène (flèche violette) parce que l’OD est en surpression. Le rapport entre la longueur de l’atrialisation du VD (flèches vertes) et celle de la cavité fonctionnelle du VD (flèche bleue) doit être < 0.5 pour permettre une plastie valvulaire; celle-ci utilise le feuillet antérieur comme seul élément de fermeture de la valve.
Des faisceaux de conduction accessoires sont fréquents, d’où la forte incidence de Wolff-Parkinson-White et d’arythmies sus-jonctionnelles périopératoires (25% des cas). La maladie se manifeste cliniquement par une limitation du débit ventriculaire droit: stase systémique, hépatomégalie et insuffisance congestive droite. Une cyanose apparaît lorsque la POD devient élevée et induit un shunt D-G par une CIA ou un FOP associés. Le pronostic est lié au status fonctionnel, à l’importance de la défaillance droite, à la gravité des arythmies et, le cas échéant, à la cyanose [4].
La taille de la portion trabéculée du VD détermine la sévérité de la maladie et le type de correction chirurgicale possible. Si le VD est satisfaisant, l’opération consiste en une atrioplastie de réduction et en une plastie de la valve tricuspide avec transformation en une monovalve dont l’occlusion n’est assurée que par le feuilet antérieur, ou en une bicuspidie lorsqu’un seul feuillet est bas-implanté. Ceci n’est possible que si le feuillet antérieur est assez grand et assez mobile et si la cavité fonctionnelle du VD est au moins le tiers de sa cavité totale. Cette plastie transforme le tissu valvulaire en une forme de cône (cone procedure) orienté vers l'apex du VD; elle est souvent complétée par une plastie de l'anneau traicuspidien au moyen d'un anneau prothétique [3]. Si le VD est hypoplasique, il ne peut pas assurer le débit pulmonaire après la réparation tricuspidienne; l’adjonction d’une anasotomose cavopulmonaire de Glenn (VCS – APD) peut alors assurer un débit pulmonaire satisfaisant tout en court-circuitant le ventricule (one and a half repair) [1], mais dans les cas sévères une opération de Fontan est nécessaire pour court-circuiter complètement le VD.
Anesthésie
L'anesthésie est gérée en fonction de deux données essentielles: la limitation de volume du VD (insuffisance droite restrictive) et les arythmies. L’éjection du VD est facilitée par une vasodilatation pulmonaire (voir Tableau 14.7), une légère tachycardie et une faible pression endothoracique (ventilation mécanique à basse pression). Une baisse de la postcharge du VD (vasodilatation pulmonaire) diminue l'insuffisance tricuspidienne. La pose d'une voie centrale peut déclencher des arythmies très dangereuses parce qu'une partie de la paroi auriculaire droite est de la paroi ventriculaire. La technique d’induction dépend de l’état hémodynamique : kétamine, midazolam, etomidate sont adéquats. Le maintien est bien assuré par un halogéné (isoflurane, sevoflurane) ou par une perfusion de midazolam lors de reconstruction complexe.
En sortant de CEC, un soutien inotrope du VD est requis : dobutamine, milrinone, adrénaline, NO. Les arythmies sus- et sous-jonctionnelles répondent en général à l’amiodarone. Après correction chirurgicale, le flux tricuspidien ne doit pas être limitatif; le gradient moyen à travers la valve ne doit pas dépasser 5 mmHg; une fuite résiduelle 2/4 est acceptable. Les blocs AV complets ne sont pas rares après plastie tricuspidienne. La nécessité d’une assistance temporaire sous ECMO n’est pas exceptionnelle et doit être décidée précocement, avant une dilatation et une dysfonction réfractaire du VD.
| Maladie d’Ebstein |
|
Implantation apicale des feuillets postérieur et septal de la tricuspide avec rétrécissement de la cavité du VD, atrialisation de sa chambre d’admission, dilatation de l’OD et insuffisance tricuspidienne. Présence d'une CIA dans la moitié des cas.
Hémodynamique : insuffisance ventriculaire droite (VD restrictif), arythmies réfractaires
Anesthésie : - Abaisser la postcharge du VD (vasodilatation pulmonaire, IPPV à basse pression)
- Eviter la bradycardie
- Eviter l’insuffisance du VG
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- CORNO AF, CHASSOT PG, PAYOT M, et al. Ebstein's anomaly: one and a half ventricular repair. Swiss Med Wkly 2002; 132:485-8
- DAVLOUROS PA, NIWA K, WEBB G, GATZOULIS MA. The right ventricle in congenital heart disease. Heart 2006; 92(Suppl 1): i27-i38
- DEARANI JA, SAID SM, O'LEARY PW, et al. Anatomic repair of Ebstein's malformation: lessons learned with cone reconstruction. Ann Thorac Surg 2013; 95:220-6
- SILVERSIDES CK, KIESS M, BEAUCHESNE L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Outflow tract obstruction, coarctation of the aorta, tetralogy of Fallot, Ebstein anomaly and Marfan’s syndrome. Can J Cardiol 2010; 26:e80-e97
