La prévalence moyenne de l’insuffisance mitrale (IM) dans les pays industrialisés est d’environ 2%, s'élevant à près de 10% au-delà de 75 ans [2]. La réparation chirurgicale s’adresse essentiellement à deux types de pathologie mitrale : les lésions structurelles et les insuffisances fonctionnelles (voir Figure 10.31).
- Lésions structurelles : dégénérescence myxoïde (maladie de Barlow), dégénérescence fibro-élastique, prolapsus, calcification de l’anneau, lésions rhumatismales (RAA).
- Insuffisance fonctionnelle secondaire : dilatation ou ischémie ventriculaire entraînant une traction excessive sur les cordages et maintenant tout ou partie des feuillets en-dessous de leur point de coaptation en systole ; la dilatation peut également porter sur l’anneau mitral. Les feuillets eux-mêmes sont normaux. Cette pathologie est plus fréquente que les lésions structurelles, particulièrement à partir d’un certain âge.
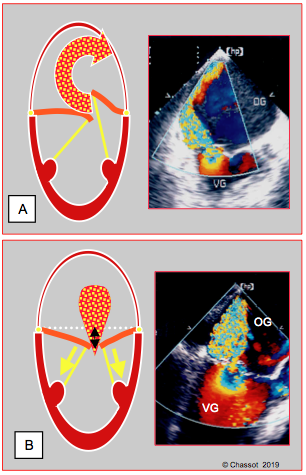
Figure 10.31: Lésion structurelle vs IM fonctionnnelle. A: Lésion organique, en l’occurrence prolapsus du feuillet postérieur; l’IM est excentrique; le jet est de section grossièrement circulaire car l’orifice de régurgitation est plus ou moins rond. B: IM fonctionnelle, secondaire à la traction sur les cordages due à une dilatation du VG; les deux feuillets ne peuvent plus coapter en systole, car ils sont retenus en-dessous de leur plan de coaptation. L’IM est centrale et s’étend en général sur toute l’étendue de la fente mitrale; sa section n’est pas circulaire, mais plutôt en croissant.
Chez les patients âgés souffrant de dysfonction ventriculaire et de comorbidités importantes, la chirurgie mitrale comporte des risques élevés et entraîne une mortalité opératoire ≥ 15%. Pour ne pas refuser tout traitement à ces patients, plusieurs techniques percutanées permettent de réaliser une plastie mitrale sans thoracotomie ni CEC, dont l'accrochage de l'extrémité des feuillets (MitraClip™) ou l'implantation valvulaire (Tendyne™, Tiara™) (voir Chapitre 10, Plastie mitrale percutanée) [13].
La plus couramment appliquée en clinique est une suture bout-à-bout de l'extrémité médiane des deux feuillets par un clip (MitraClip™); en diastole, l'ouverture est transformée en deux hémi-orifices de taille limitée (Vidéos et Figure 27.210) [6]. Cette technique est basée sur la plastie selon Alfieri. Le clip possède deux bras en alliage chrome-cobalt recouverts de tissu polyester ; il peut s’ouvrir et se fermer lorsqu’il est monté sur son guide, qui est introduit dans l’OG par voie trans-septale. Le taux de succès immédiat est de l'ordre de 90%, mais le taux de fuite résiduelle et de réintervention sur la valve est plus élevé qu'après correction chirurgicale (20% versus 2.2%) [6,7,14].
Vidéo: vue bicommissurale d'un MitraClip en place reliant A2 et P2.
Vidéo: vue 3D "en-face" depuis l'OG d'un MitraClip en place reliant la partie centrale de chaque feuillet.
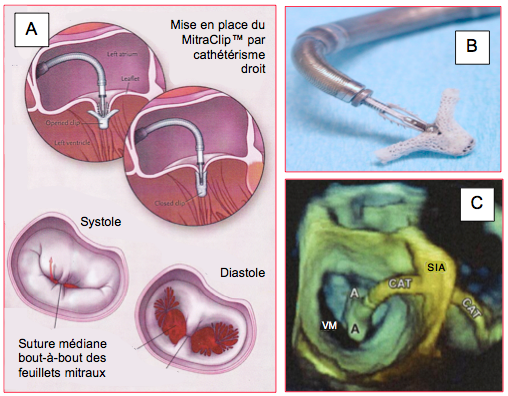
Figure 27.210 : Technique de plastie mitrale percutanée. A : Sytème MitraClip™. Suture de l'extrémité médiane des deux feuillets par un clip (MitraClip™); en diastole, l'ouverture est transformée en deux hémi-orifices de taille limitée [Feldman T, et al. N Engl J Med 2011; 364:1395-406]. B : Détail du clip, à l’extrémité de son système d’implantation. C : Imagerie ETO tridimensionnelle de l’OG avec le cathéter et le clip en place au-dessus de la valve mitrale. A : clip ouvert. CAT : cathéter d’implantation traversant le septum interauriculaire (SIA). VM : valve mitrale [Faletra FF, et al. J Am Coll Cardiol Cardiovasc Imag 2014; 7:292-308].
Le rapprochement de la partie médiane des deux feuillets permet de diminuer l’insuffisance mitrale en systole. La cicatrisation autour du clip forme un pont tissulaire résistant entre les deux feuillets [7]. Cette technique est réservée préférentiellement aux situations où la régurgitation est causée par un défaut de coaptation de la région médiane des feuillets (A2-P2) chez des patients symptomatiques à très haut risque opératoire.
- Prolapsus localisé de P2 ou de A2;
- IM fonctionnelle sur dilatation du VG (insuffisance ventriculaire) ou sur akinésie pariétale (ischémie);
- Patients âgés ou débilités dont la mortalité prévisible lors d’une PVM en CEC dépasse 15% et dont l’espérance de vie est raisonnable;
- IM lors d'obstruction dynamique de la chambre de chasse gauche par le déplacement antérieur de l'appareil mitral (SAM, systolic anterior motion), comme on la rencontre dans la cardiomyopathie obstructive ou après une plastie mitrale restrictive (voir Chapitre 13, Cardiomyopathie obstructive).
En gagnant de l’expérience, on a également étendu les indications à des lésions plus excentriques et à des malades souffrant de comorbidités plus sévères. Pour obtenir de bons résultats, certaines conditions doivent être remplies ; elles sont bien définissables à l’ETO (voir Figure 10.34) [3,10,17].
- IM centrale, d’origine non rhumatismale ni endocarditique;
- Localisation sur A2-P2;
- Surface d'ouverture de la valve d'au-moins 4 cm2;
- Gradient transvalvulaire ≤ 4 mmHg;
- Hauteur de coaptation > 2 mm;
- Distance entre le point de coaptation et le plan de l’anneau ≤ 11 mm (tenting height);
- En cas de prolapsus, l’écart entre les feuillets (flail gap) doit être < 10 mm et la largeur du prolapsus (flail width) < 15 mm;
- Longueur du feuillet postérieur > 10 mm;
- Zone d'accrochage > 10 mm;
- Bords libres des feuillets souples et non-calcifiés à l’endroit de pose du clip.
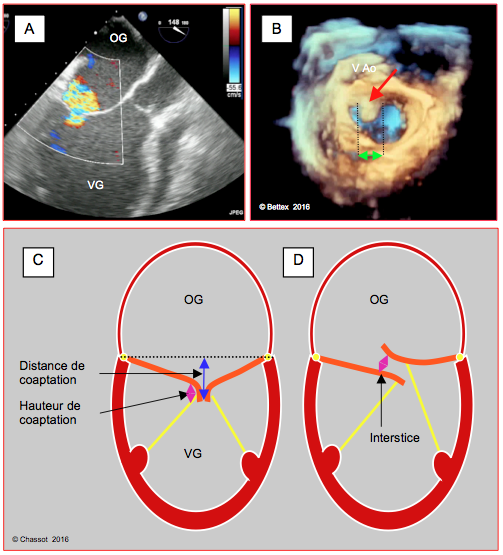
Figure 10.34 : Conditions de réussite pour l’implantation d’un clip mitral selon Alfieri (MitraClip™). A : IM fonctionnelle sévère centrale prédominant entre A2 et P2. B : la largeur du prolapsus (flèche verte) doit être < 15 mm, et le prolapsus situé sur A2 ou P2 (prolapsus de A2). C : la hauteur de coaptation (flèche violette) doit être > 2 mm et la distance entre le point de coaptation et le plan de l’anneau (tenting distance, flèche bleue) ≤ 11 mm. D : dans le prolapsus, l’écart entre les feuillets (interstice) doit être < 10 mm. Ces mesures sont réalisées dans les vues mi-oesophagiennes 4-cavités 0-20° et long-axe du VG 120°, sauf la largeur du prolapsus, qui est plus précise en reconstruction 3D full volume.
L’IM très décentrée, les lésions proches des commissures, l’écart de > 10 mm, la rupture de cordage, la fibrose étendue des feuillets et les calcifications de l’anneau mitral sont des situations dans lesquelles le MitraClip™ a peu de chance d’être efficace. Elles sont habituellement considérées comme des contre-indications à la technique. Toutefois, en gagnant de l’expérience et du savoir-faire, les opérateurs étendent les indications de la technique à des cas considérés auparavant comme hors de portée. Même si elle n'offre pas la même qualité de correction que la plastie à ciel ouvert, cette technique percutanée permet une réduction de l'IM de l'ordre de 2 à 3 degrés (sur 4) avec un faible risque opératoire, chez des malades lourdement compromis dont la mortalité chirurgicale serait > 15% [4,12,15,17].
| Plastie mitrale percutanée par MitraClip™ |
| La technique consiste à suturer bout-à-bout par un clip la partie centrale des feuillets antérieur et postérieur (A2 et P2) de la valve mitrale. Le clip est introduit par voie veineuse fémorale et trans-septale (technique percutanée). Ce système s’adresse aux patients dont la mortalité opératoire en CEC serait > 15%. Certaines conditions doivent être remplies pour garantir de bons résultats : - IM centrale non-rhumatismale ni endocarditique, feuillets souples - S mitrale > 4 cm2 - Prolapsus : largeur < 15 mm, écart entre feuillets < 10 mm, - IM fonctionnelle : coaptation sur ≥ 2 mm, distance coaptation – plan de l’anneau < 11 mm |
Implantation du MitraClip™
Une connaissance de la procédure est nécessaire pour interpréter les images ETO. L'intervention se déroule en plusieurs temps [16].
- L'accès à la valve mitrale se fait par voie trans-septale depuis une ponction veineuse fémorale avec un introducteur 24F ; celui-ci est introduit jusque dans l’OG, ce qui permet d’y mesurer la pression en cours d’intervention.
- Ponction trans-septale ; le point de ponction est réalisé dans la portion médiane postérieure du septum, supérieurement par rapport à la fosse ovale; il doit être situé 3.5 – 4.5 cm au-dessus du plan de l'anneau mitral en systole de manière à pouvoir bouger et orienter correctement le support du clip perpendiculairement au plan de la valve et à éviter de toucher les parois auriculaires (risque d’arythmies et de perforation). Une erreur de visée peut conduire à une perforation de la racine de l'aorte (fistule) ou de la paroi auriculaire (tamponnade).
- Avancement du guide de stabilisation de l'introducteur trans-septal : il est dirigé dans une veine pulmonaire gauche ou dans le VG; on évite soigneusement l’appendice auriculaire gauche à cause du risque de perforation. Toutes les manipulations du dispositif font courir un risque d'embolie gazeuse systémique, puisque le système relie l'extérieur du corps à l'OG.
- Avancement du clip et de son système de mise en place à travers l'introducteur et positionnement du système en face de la valve mitrale, à la verticale de son ouverture et du jet de la régurgitation; le clip est orienté perpendiculairement à sa commissure. Cette orientation est contrôlée à l'ETO 3D (Figure 27.210C).
- Franchissement de la valve mitrale à clip ouvert ; les deux bras du clip doivent rester perpendiculaires à la ligne de coaptation de la valve ; le clip est situé au milieu de la zone d’insuffisance. Les mouvements de la valve restent libres, preuve qu’aucun cordage n’est accroché par le système.
- Accrochage des feuillets : le cathéter est retiré en douceur pour que le clip accroche l’extrémité des feuillets. Le clip est fermé partiellement pour permettre un contrôle échocardiographique: mouvement restrictif des feuillets mitraux, immobilité du clip (s'il est mal accroché à un feuillet, il bouge avec l'autre), recherche d'une éventuelle lésion de l'appareil sous-valvulaire. A ce stade, il est possible de rouvrir le système et de recommencer la manœuvre.
- Fermeture complète des bras du clip et fixation définitive des feuillets.
- En cas de fuite résiduelle excessive, on peut ajouter un deuxième clip. Dans ce cas, le placement du premier clip sera effectué de manière à disposer l’insuffisance résiduelle d’un seul côté du clip.
- Retrait du dispositif si les images de contrôle sont satisfaisantes et l’hémodynamique stable. L'IM résiduelle doit être modeste et le gradient transmitral < 5 mmHg.
- Il arrive que la perforation septale laisse un orifice significatif, équivalant à une CIA ; s’il existe une composante droite-gauche importante (désaturation artérielle) ou un risque de surcharge de volume pour le VD, la CIA est fermée immédiatement avec un système d’occlusion (Amplatzer™).
- La durée de la procédure est en moyenne de 2-3.5 heures.
- Les complications sont essentiellement une perforation cardiaque (tamponnade), une rupture de cordage, une déchirure de feuillet aggravant la régurgitation mitrale, une embolisation du clip ou un échec de positionnement de celui-ci. Le traitement de ces complications est chirurgical.
L’ETO est utile tout au long de la procédure pour évaluer la valve, guider l’implantation et contrôler le résultat [5,9,16]. En salle d'intervention, des écrans répétiteurs offrent une vue permanente sur la fluoroscopie et l’échocardiographie. Ils permettent également d’afficher certaines vues de repérage prises en préopératoire (angio-IRM, angio-CT). De nouvelles techniques de fusion d’image (HeartNavigator™ Philips) offrent la posibilité de superposer et de synchroniser la reconstruction 3D de l’ETO, du CT-scan ou de l’IRM avec l’image radioscopique en temps réel fournie par l’arc-en-C [11].
Les vues bidimensionnelles (2D) et tridimensionnelles (3D) sont complémentaires et présentent chacune leur intérêt selon les phases de la procédure. Les vues 2D les plus utiles sont les vues rétrocardiaques 4 cavités 0-30°, bicavale 100°, long-axe 120° et court-axe de la base 40° (voir Figure 10.35). La représentation 3D zoom en temps réel est particulièrement adaptées à la vérification de l’orientation du clip par rapport à la commissure mitrale ; la représentation Live 3D est peu utilisée car elle ne permet la visualisation que d’une fine tranche de la valve. L’affichage simultané de deux plans bidimensionnels distincts (X-plane) permet d’éviter de changer l’orientation du capteur en cours de manœuvre et de profiter simultanément de la précision anatomique du 2D et de la reconstruction spatiale du 3D. Les prestations du 3D sont nettement supérieures à celles du 2D dans les phases suivantes : positionnement du clip dans les axes antéro-postérieur et médio-latéral au-dessus de la valve, ajustement du clip avec les bras perpendiculaires à la commissure mitrale, visualisation du clip fixé aux feuillets (voir Figures 10.36, 10.37 et 27.211) [1]. Le 3D permet de voir toute la longueur du cathéter dans l’OG et dans la mitrale, alors que le 2D ne réalise que des tomographies avec lesquelles on n’identifie le cathéter que lorsqu’il passe dans le plan de coupe. L’imagerie 3D Full volume est spécialement utile avec le Doppler couleur pour localiser de manière exacte l’origine du jet de l’IM, pour en déterminer la géométrie et pour évaluer les jets résiduels après l’intervention [8]. L’obtention de bonnes images 3D couleur est toutefois rendue difficile par la présence de troubles du rythme ou de fibrillation auriculaire. En effet, les images en Full-volume requièrent une reconstruction ne s’avèrant possible qu’en apnée et en présence d’un ryhme cardiaque parfaitement régulier. La reconstitution du jet dans l’espace est particulièrement pertinente pour les IM fonctionnelles dont la régurgitation reproduit la forme de la fente qui subsiste en systole entre les feuillets, alors que le jet des IM organiques est de géométrie approximativement circulaire. Par contre, le 2D offre une résolution spatiale bien supérieure. Il est plus performant que le 3D pour visualiser la déformation en tente (tenting) du septum interauriculaire lors de sa ponction, pour suivre l’accrochage des feuillets mitraux par le clip et pour identifier le point d’insertion de ce dernier sur les feuillets (Figure 10.35) [1,5].
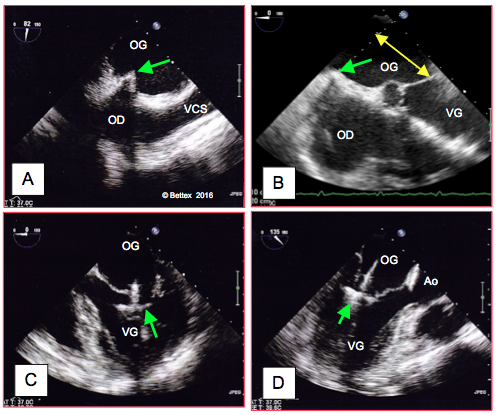
Figure 10.35 : Images ETO bidimensionnelles de la mise en place du Mitraclip™. A : effet de tente (tenting) lors de la perforation du septum interauriculaire (vue bicave 80°). B : mesure de la distance entre le point de ponction et le plan de l’anneau mitral (flèche jaune) en vue 4-cavités (0°). C : clip en position intraventriculaire, les deux bras ouverts en direction des feuillets mitraux. D : accrochage des feuillets.
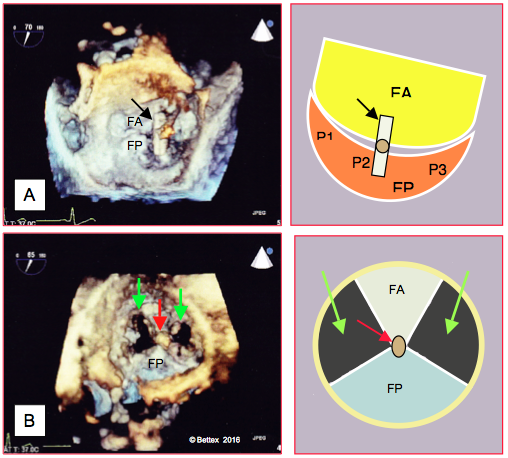
Figure 10.36 : Images ETO tridimensionnelles de la mise en place du Mitraclip™ (vues auriculaires) et leurs représentations schématiques. A : vue intra-auriculaire du clip surplombant la valve mitrale (flèche); les bras sont orientés perpendiculairement à la commissure mitrale. B : une fois le clip en place et le guide retiré, les feuillets mitraux sont fixés l’un à l’autre par leur extrémité distale (A2 et P2) (flèche rouge) ; en diastole, la valve mitrale présente une double ouverture (flèches vertes). FA : feuillet antérieur ; FP : feuillet postérieur.
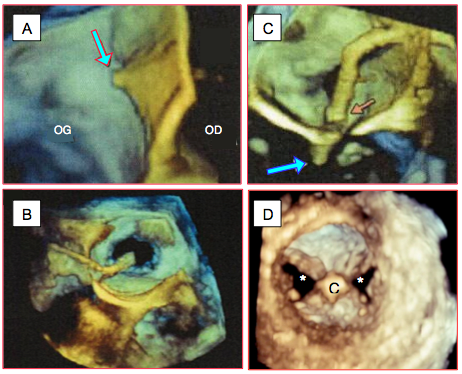
Figure 10.37 : Images ETO tridimensionnelles de la mise en place du Mitraclip™. A : effet de tente (tenting) au moment de la perforation du septum interauriculaire [Faletra FF, et al. J Am Coll Cardiol Cardiovasc Imag 2014; 7:292-308]. B : vue plongeante sur l’OG; le cathéter franchit le septum interauriculaire (SIA) et se dirige à angle droit vers la valve mitrale, visant le centre de l’ouverture diastolique [Altiok E, et al. Clin Res Cardiol 2011; 100:675-81]. C : libération du clip (flèche bleue) et retrait du cathéter (flèche rouge) [Faletra FF, et al. J Am Coll Cardiol Cardiovasc Imag 2014; 7:292-308]. D : vue depuis le VG du clip (C) en place sur la mitrale, laissant deux orifices (*) en diastole.
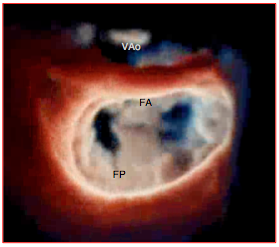
Figure 27.211 : Image ETO tridimensionnelle du résultat d'une plastie selon Alfiéri. Le feuillet antérieur (FA) et le feuillet postérieur (FP) sont suturés au niveau de A2 et P2. En diastole, ce procédé forme un pont entre les deux feuillets et laisse une double ouverture pour le remplissage du VG; en systole, cette suture empèche la bascule des feuillets dans l'OG et supprime la fuite mitrale. VAo: position de la valve aortique.
L’ETO surveille et oriente tout le déroulement de la procédure [5,9]. D'une manière générale, l'échocardiographie doit être en phase avec les besoins de l'opérateur, non avec ceux de l'anesthésiste. Il est important d'éviter les changements de plan inutiles et d'adapter l'imagerie aux nécessités spécifiques de l'intervention.
- Contrôle de la situation anatomique pour vérifier que les critères de succès soient remplis:
- IM centrale (A2-P2), d’origine non-rhumatismale;
- Surface d'ouverture de la valve d'au-moins 4 cm2;
- Hauteur de coaptation > 2 mm;
- Distance entre le point de coaptation et le plan de l’anneau ≤ 11 mm (tenting height);
- En cas de prolapsus, l’écart entre les feuillets (flail gap) doit être < 10 mm et la largeur du prolapsus (flail width) < 15 mm;
- Longueur du feuillet postérieur > 10 mm;
- Bords libres souples et non-calcifiés à l’endroit de pose du clip.
- Ponction trans-septale : l’ETO identifie le cathéter de ponction par le sommet de la déformation en tente du septum membraneux dans la portion médiane supéro-postérieure du septum, 3.5 – 4.5 cm au-dessus du plan de l'anneau mitral (Figure 10.35A et 10.37A) (Vidéo). Ce repérage est aisé dans les vues combinées 4-cavités 0-20° (position en hauteur), bi-cavale 80-100° (position dans l'axe cranio-caudal), et court-axe de la base 40° (position dans l'axe antéro-postérieur), ou en vues simultanées 60° et 100° en X-plane 3D.
- Avancement du guide de stabilisation de l'introducteur trans-septal : contrôle de son passage dans une veine pulmonaire gauche ou dans le VG, et non dans l’appendice auriculaire gauche.
- Avancement du clip et de son système de mise en place à travers l'introducteur : contrôle dans les plans orthogonaux de la valve mitrale, en vues bicommissurale (60°) ou long-axe (120°), et simultanément en vue basale court-axe (X-plane 3D) ; le cathéter surplombe la valve mitrale perpendiculaire à son plan (Figure 10.37B) (Vidéo).
- Positionnement du système en face de la valve mitrale, à la verticale de son ouverture; le clip est orienté perpendiculairement à la commissure mitrale (Figure 10.36A) (Vidéo).
- Franchissement de la valve mitrale : avancement du clip juste en amont de l’orifice de régurgitation, au centre du PISA, selon un trajet coaxial au flux mitral. Contrôle en vue 4-cavités (0°), bicommissurale (60°), long-axe (120°), 3D full volume, avec et sans Doppler couleur (Vidéo).
- Contrôle de position du clip avant accrochage : le clip est maintenant en dessous de la valve mitrale, sur son versant ventriculaire ; il est ouvert : ses deux bras doivent être perpendiculaires à la ligne de coaptation de la valve, visibles en plan long-axe mais non en plan bicommissural; il est situé au milieu de la valve, dont les mouvements restent libres (Vidéo). Seule l’image radiologique permet de visualiser correctement les 2 bras du clip et leur ouverture-fermeture.
- Accrochage des feuillets : le cathéter est retiré en douceur pour que le clip accroche l’extrémité des feuillets, ce qui exerce une tension sur les cordages ; les éléments de fixation sont abaissés sur les feuillets. Le clip est fermé partiellement pour permettre un contrôle échocardiographique, puis on procède à la fermeture complète des bras et à l’accrochage définitif des feuillets. Contrôle de la mise en place sur les deux feuillets en vues 4-cavités 0-20° et long-axe 120° (2D), ou en vues simultanées 40-60° et 120° (Vidéo). La précision de l’imagerie 2D est essentielle pendant cette phase parce que la résolution du 3D est insuffisante pour visualiser la finesse de l’extrémité des feuillets mitraux (voir ci-dessus vidéo Mitraclip 3D). Comme complément d’information, on utilise essentiellement le 3D Zoom ; le 3D Full volume est surtout utile pour le le Doppler couleur, car la résolution est trop basse en 3D Zoom. Si l’un des feuillets est mal accroché, le clip bouge avec l’autre feuillet. Le clip peut être ré-ouvert et repositionné si nécessaire.
- Contrôle immédiat : stabilité du clip, présence de fuite(s) résiduelle(s), mouvement des feuillets, planimétrie du double orifice en court-axe transgastrique ou en 3D full volume (addition des 2 surfaces d’ouverture ≥ 2.5 cm2), gradient diastolique (ΔPmax ≤ 5 mmHg) identique à travers chaque orifice) (Figure 10.36B) (Vidéo). L’importance de l’IM résiduelle doit être évaluée dans des conditions hémodynamiques normales ; il est souvent nécessaire d’administrer un vasopresseur (phényléphrine, noradrénaline) pour réaliser un test adéquat.
- Une fuite résiduelle de degré > 2/4 est considérée comme excessive (Vidéo); le cas échéant, on peut ajouter un deuxième clip à côté du premier. Il faut contrôler au préalable qu’il existe suffisamment de tissu mitral libre pour éviter que ce clip supplémentaire ne sténose l’orifice diastolique.
- Il arrive que la perforation septale laisse un orifice significatif, équivalant à une CIA, mis en évidence par le flux couleur à prédominance gauche-droite (Vidéo). S’il existe une composante droite-gauche importante (désaturation artérielle) ou un risque de surcharge de volume pour le VD, la CIA est fermée immédiatement avec un système d’occlusion.
Vidéo: Ponction du septum interauriculaire par le cathéter introduit depuis la veine fémorale pour pénétrer dans l'OG.
Vidéo: image tridimensionnelle du cathéter surplombant la valve mitrale dans l'OG; le feuillet antérieur, plus grand, est situé en haut, le feuillet postérieur est en bas.
Vidéo: Le dispositif est en place au-dessus de la valve mitrale; il est situé au milieu de la commissure, le système de clip est orienté perpendiculairement à celle-ci de manière à pouvoir accrocher les feuillets.
Vidéo: Vues perpendiculaires simultanées ("X-plane") de la valve mitrale avec le dispositif en place, ouvert en-dessous des feuillets.
Vidéo: Dispositif en place, prêt à accrocher les feuillets (vue long-axe); le feuillet antérieur, plus long, est sur la droite, le feuillet postérier est à gauche.
Vidéo: Accrochage des feuillets en vue tridimensionnelle.
Vidéo: vue tridimensionnelle finale de la fixation reliant A2 et P2.
Vidéo: Vues perpendiculaires simultanées du flux couleur à travers la valve mitrale et d'une fuite résiduelle tolérable après implantation de MitraClip.
Vidéo: Double fuite après implantation de MitraClip en reconstruction 3D; ces fuites sont excessives.
Vidéo: Communication interauriculaire créée par le passage trans-septal du cathéter; le flux passe de l'OG (en haut à droite) à l'OD (en bas à gauche); il correspond à un shunt gauche - droit.
| Technique du MitraClip™ |
| L’accès est une ponction percutanée de la veine fémorale. Le cathéter est introduit dans l’OG par perforation trans-septale depuis l’OD. Le clip est positionné perpendiculairement à la commissure mitrale en son milieu, puis il est descendu dans le VG. En le retirant, le clip ouvert accroche les 2 feuillets mitraux et les pince (fermeture) au niveau de A2-P2. En cas de fuite résiduelle, on peut réitérer la procédure avec un deuxième clip. L’ETO (2D et 3D) est nécessaire pour guider l’intervention dans ses différentes phases : - Vérification des critères anatomiques de faisabilité - Ponction trans-septale (vues 2D court-axe de la base 40° et bicave 100°, idem en X-plane) - Positionnement du clip en amont puis en aval de la valve mitrale (3D Zoom) - Accrochage des feuillets (vues 2D 4-cavités 20-40° et long-axe 120°), fermeture du clip - Contrôle immédiat de la position du clip (3D zoom ou couleur full volume), évaluation de l’IM résiduelle - Evaluation d’une éventuelle CIA secondaire à la ponction trans-septale avec shunt G-D |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- ALTIOK E, BECKER M, HAMADA S, et al. Optimized guidance of percutaneous edge-to-edge repair of the mitral valve using real-time 3D transesophageal echocardiography. Clin Res Cardiol 2011; 100:675-81
- ASGAR AW, MACK MJ, STONE GW. Secondary mitral regurgitation in heart failure. Pathophysiology, prognosis, and therapeutic considerations, J Am Coll Cardiol 2015; 65:1231-48
- BEIGEL R, WUNDERLICH NC, KAR S, SIEGEL RJ. The evolution of percutaneous mitral valve repair therapy. Lessons learned and implications for patient selection. J Am Coll Cardiol 2014; 64:2688-700
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- FALETRA FF, PEDRAZZINI G, PASOTTI E, et al. 3D TEE during catheter-based interventions. J Am Coll Cardiol Cardiovasc Imag 2014; 7:292-308
- FELDMAN T, FOSTER E, GLOWER DG, et al. Percutaneous repair or surgery for mitral regurgitation. N Engl J Med 2011; 364:1395-406
- FELDMAN T, YOUNG A. Percutaneous approaches to valve repair for mitral regurgitation. J Am Coll Cardiol 2014; 63:2057-68
- GAEMPERLI O, MOCCETTI M, SURDER D, et al. Acute hemodynamic changes after percutaneous mitral valve repair: relation to mid-term outcomes. Heart 2012; 98:126-32
- GUARRACINO F, BALDASSARRI R, FERRO B, et al. Transesophageal echocardiography during MitraClip™ procedure. Anesth Analg 2014; 118:1188-96
- HAHN RT. Transcatheter valve replacement and valve repair. Review of procedures and intraprocedural echocardiographix imaging. Circ Res 2016; 119:341-56
- KLIGER C, JELNIN V, SHARMA S, et al. CT angiography-fluoroscopy fusion imaging for percutaneous transapical access. J Am Coll Cardiol Imag 2014; 7:169-77
- O'GARA PT, GRAYBURN PA, BADHWAR V, et al. 2017 ACC Expert consensus décision pathway on the management of mitral regurgitation. J Am Coll Cardiol 2017; 70:2421-49
- SORAJJA P, LEON MB, ADAMS DH, et al. Transcatheter therapy for mitral régurgitation. Clinical challenges and potential solutions. Circulation 2017; 136:404-17
- SORAJJA P, MACK M, VEMULAPALLI S, et al. Initial experience with commercial transcatheter mitral valve repair in United States. J Am Coll Cardiol 2016; 67:1129-40
- TARAMASSO M, GAEMPERLI O, MAISANO F. Treatment of degenerative mitral regurgitation in elderly patients. Nature Rev Cardiol 2015; 12:177-83
- WU IY, BARAJAS MB, HAHN RT. The MitraClip procedure – A comprehensive review for the cardiac anesthesiologist. J Cardiothorac Vasc Anesth 2018; 32:2746-59
- ZAMORANO JL, BADANO LP, BRUCE C, et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. Eur J Echocardiogr 2011; 12:557-84
