Les tests de coagulation habituels font partie de l’évaluation du malade anticoagulé en préopératoire, mais ont une portée limitée dans la prédiction du risque hémorragique, parce qu’ils évaluent essentiellement la coagulation in vitro sans l’effet des cellules circulantes (plaquettes, leucocytes) ni celui de l’endothélium. Leur standardisation est difficile [9]. Leur sensibilité dépend du réactif utilisé [2,16].
- L’aPTT (activated partial thromboplastin time) est sensible aux facteurs I, II, V, X (voie commune) et VIII, IX, XI, XII (voie intrinsèque); le seuil pathologique est fixé empiriquement à ≥ 60 secondes (1.5-1.8 fois la valeur normale) ; la valeur normale (30-40 sec) est variable selon les laboratoires.
- Le TP (temps de prothrombine) est sensible aux facteurs I, II, V, VII, X (voie extrinsèque) ; il mesure les facteurs dépendant de la vitamine K. Le seuil pathologique est fixé empiriquement à ≥ 40 secondes. Le rapport normalisé INR (International normalized ratio) est un mode d’expression du TP qui tient compte de la sensibilité du réactif utilisé pour le test (thromboplastine) et qui réduit les variations entre laboratoires ; il est spécifique aux agents anti-vitamine K et ne s'applique pas aux autres substances. L’INR normal est < 1.5.
- Le TT (temps de thrombine) mesure la conversion du fibrinogène en fibrine; il est prolongé par les inhibiteurs de la thrombine comme l'héparine, la bivalirudine ou le dabigatran.
- Le fibrinogène doit rester > 2 gm/L pour permettre une polymérisation adéquate de la fibrine et éviter des saignements excessifs. La méthode de Clauss habituellement utilisée pour sa mesure est sensible à la présence de colloïdes, ce qui conduit à une surestimation de son taux en leur présence. Ni la technique de Clauss ni le FIBTEM de la thromboélastographie ne sont standardisés.
- Le taux de thrombocytes ne prédit rien de leur fonction, mais doit être > 70’000/mcL pour assurer un thrombus efficace.
Suivi des anticoagulants
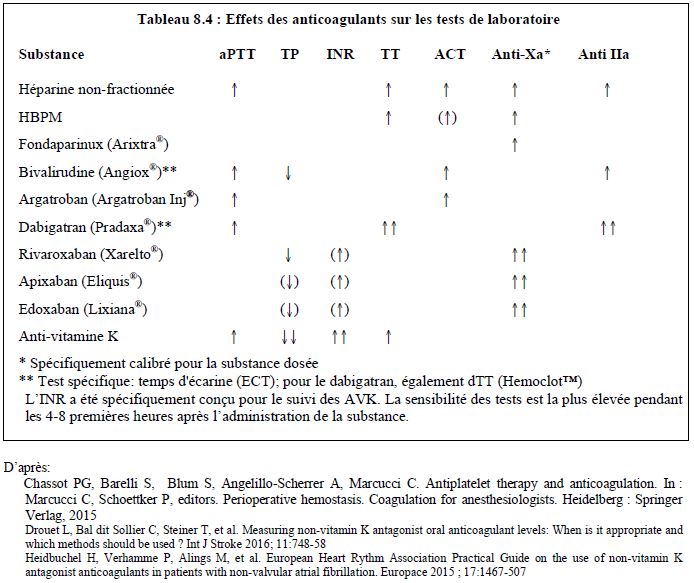
Les tests de laboratoire sont essentiels pour le suivi des malades sous héparine ou antivitamine K (AVK), parce que la réponse à ces médicaments est très variable selon les individus et selon les circonstances (diète, comédication, etc). Il n’en est pas de même pour les nouveaux anticoagulants oraux (NACO), qui ont précisément été mis au point dans le but d’offrir une réponse linéaire entre la dose et l’effet, et d’éviter le recours à de fréquents dosages de laboratoire. De ce fait, on ne dispose pas de monitorage fiable pour ces substances, qui tendent à modifier les tests de manière non spécifiques. Pour les NACO, il est difficile d’évaluer avec certitude quel est le degré réel d’anticoagulation d’un malade et quel est le seuil hémostatique à partir duquel la coagulation peut être considérée comme satisfaisante. Les tests de laboratoire sont diversement influencés par ces différents anticoagulants (Tableau 8.4), et les seuils de sécurité d’INR ou d’aPTT validés pour les AVK ne s’appliquent pas aux nouvelles substances [3,14].
Il est d’usage d’évaluer l’effet de l’héparine non-fractionnée (HNF) par deux tests de laboratoire, vu que la substance présente une pharmacocinétique non-linéaire [7].
- Le temps de thromboplastine (aPTT, activated partial thromboplastin time) est performant aux dosages habituels; valeur recherchée: 2 à 3 fois la valeur de contrôle.
- L’ACT (ACT, activated clotting time) est préférable aux dosages élevés comme lors de CEC; valeur recherchée: ≥ 450 secondes pour un circuit de CEC stan
- dard, 250-300 secondes pour un circuit pré-hépariné.
La mesure de l’activité des HBPM, qui affectent peu l'aPTT, du fondaparinux et des substances anti-Xa (fondaparinux, xabans) se fait par le dosage de l’effet anti-Xa calibré pour la substance, dont le pic est atteint 3 à 5 heures après l’administration. La valeur cible est 0.5-1.0 ou de 1.0-2.0 UI/mL en administration prophylactique ou thérapeutique, respectivement [11]. Ce dosage n’est pas requis pour le suivi des malades, excepté en cas d’obésité, de grossesse, d’insuffisance rénale, de surdosage, d'hémorragie ou de décision préopératoire urgente [4].
La variabilité de la réponse individuelle et les effets de la diète ou des co-médications imposent de suivre l’effet des anti-viatmine K par le temps de thromboplastine (TP ou temps de Quick) ou par l’INR. Le niveau thérapeutique recherché est ≤ 30% pour le TP et 2.5 - 3.0 pour l’INR [1].
Les tests de coagulation sont affectés de manière variable par les NACO, d'autant plus que les différents réactifs utilisés pour chacun des tests divergent considérablement dans leur sensibilité à ces anticoagulants (voir Tableau 8.4) [4,5,6,8,10,13,17].
- Le TT (temps de thrombine) est hypersensible au dabigatran; un TT normal exclut la présence de dabigatran. Cet excès de sensibilité est corrigé par le TT dilué (dTT) et calibré pour le dabigatran (Hemoclot™), qui permet une détermination quantitative avec une excellente corrélation au taux plasmatique (r2 = 0.92-0.99) [4]. Le TT est insensible aux xabans.
- L’aPTT est sensible au dabigatran mais de manière non-linéaire; il permet de déterminer la probable présence ou absence d’effet anticoagulatoire, mais non une quantification. Un effet résiduel de la substance est possible même si l'aPTT est normal. L'aPTT n'est pas corrélé aux xabans.
- Le TP est sensible aux agents anti-Xa directs (rivaroxaban, apixaban, edoxaban), mais insensible aux agents anti-IIa directs (dabigatran). Il est partiellement corrélé au taux plasmatique de rivaroxaban, mais de manière très dépendante du réactif utilisé. Il est moins bien corrélé au taux d'edoxaban et très peu corrélé au taux d'apixaban. Il n’est fiable pour le rivaroxaban que s’il est réalisé avec une thromboplastine sensible aux xabans (Neoplastin Plus™, sensible à des taux ≥ 50 ng/mL). En l’absence de normalisation entre les différents réactifs, le TP ne peut pas être envisagé pour prédire l’intensité de l’anticoagulation. Un TP normal ne permet pas d’exclure une activité anti-Xa résiduelle [10,13].
- Les tests chromatographiques mesurant l’activité anti-Xa calibrée pour chaque substance permettent de quantifier l’effet des anti-Xa directs (rivoraxaban, apixaban, edoxaban) et indirects (HBPM, fondaparinux) en UI/mL; leurs résultats sont étroitement corrélés au taux sérique de ces substances mesuré par spectrographie de masse (r2 = 0.95-1.0) [4], bien que la corrélation s'effrite un peu < 50 ng/ml et > 200 ng/mL [15]. Ce sont les tests préférentiels pour les xabans. Toutefois, on ne dispose d’aucune donnée pharmacologique sur la relation entre les résultats de laboratoire et le risque hémorragique du malade [13].
- Le temps d’écarine (ECT, ecarin clotting time) mesure le temps de thrombine avec un dérivé du venin de vipère comme activateur de la prothrombine ; il est approprié pour l’évaluation quantitative du dabigatran et de la bivaluridine (r2 = 0.92-1.0) [4].
Un TP ou un aPTT normaux signalent que l’activité résiduelle du rivaroxaban ou du dabigatran, respectivement, est probablement faible, mais ne permettent pas en eux-mêmes d'autoriser la chirurgie [12]. Chez un patient qui saigne spontanément ou de manière excessive par rapport à sa lésion, un TP de 40-50% et/ou un TT allongé doivent faire suspecter un traitement par NACO; un dTT et un test anti-Xa le confirmeront ou l'infirmeront. Les valeurs obtenues par les différents tests dépendent du délai entre l’examen et la dernière prise du médicament ; elles sont les plus élevées pendant les premières heures (pic de concentration sérique), période où les tests ont leur sensibilité maximale [13]. Il est donc recommandé d’effectuer une mesure élective dans la période du taux résiduel, soit entre 12 et 18 heures après la dernière prise pour avoir une idée de la concentration minimale de la substance à laquelle le patient est toujours exposé [10,13]. L’identification et la mesure exacte de la concentration de ces substances sont possibles par chromatographie liquide haute performance ou par spectrographie de masse, mais ces examens ne sont pas disponibles partout et ne sont en général pas remboursés. Vu la dépendance des NACO à l'égard de l'excrétion rénale, il est conseillé de contrôler régulièrement la clairance de la créatinine chez les patients sous dabigatran ou xabans.
| Monitorage des anticoagulants |
|
Suivi des patients sous héparine non-fractionnée (HNF) en perfusion :
- Temps de thromboplastine (aPTT, activated partial thromboplastin time) ; valeur
recherchée: 1.5 – 2.5 fois la valeur de contrôle
- ACT (activated clotting time) ; préférable aux dosages élevés ; ≥ 450 secondes en CEC
Suivi des patients sous HBPM, fondaparinux et anti-Xa : dosage de l’effet anti-Xa calibré pour la substance. Valeur cible : 0.5-1.0 UI/mL (prophylactique) ou 1.0-2.0 UI/mL (thérapeutique).
Suivi des patients sous agents anti-vitamine K (AVK) :
- TP (temps de Quick), valeur-cible : ≤ 30%
- INR (International normalized ratio), valeur-cible : 2.5 - 3.0
Suivi des patients sous nouveaux anticoagulants oraux (NACO) :
- TT, aPTT et ECT prolongés par le dabigatran ; Hemoclot™ (quantitatif)
- TP prolongé par le rivaroxaban et l'edoxaban (non fiable pour l’apixaban)
- Activité anti-Xa calibrée pour la substance comme mesure quantitative pour les xabans
- TP et aPTT sont prolongés de manière non-quantitative; leur normalité ne permet pas
d’éliminer une activité anticoagulatoire des xabans ou du dabigatran, respectivement
- Les taux sériques obtenus avec le même dosage sont très variables selon les patients et ne
paraissent pas corrélés au risque hémoragique, qui est multifactoriel
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- AGENO WA, GALLUS AS, WITTKOWSKY A, et al. Oral anticoagulant therapy: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e44S-e88S
- BONHOMME F, FONTANA P. Laboratory testing of hemostasis. In : MARCUCCI C, SCHOETTKER P, editors. Perioperative hemostasis. Coagulation for anesthesiologists. Heidelberg : Springer Verlag, 2015
- CHASSOT PG, BARELLI S, BLUM S, et al. Antiplatelet therapy and anticoagulation. In : MARCUCCI C, SCHOETTKER P, editors. Perioperative hemostasis. Coagulation for anesthesiologists. Heidelberg : Springer Verlag, 2015
- CUKER A, SIEGAL DM, CROWTHER MA, et al. Laboratory measurement of the anticoagulant activity of the non-vitamin K oral anticoagulants. J Am Coll Cardiol 2014; 64:1128-39
- DROUET L, BAL DIT SOLLIER C, STEINER T, et al. Measuring non-vitamin K antagonist oral anticoagulant levels: When is it appropriate and which methods should be used ? Int J Stroke 2016; 11:748-58
- GALANIS T, THOMSON L, PALLADINO M, et al. New oral anticoagulants. J Thromb Thrombolysis 2011; 31:310-20
- GARCIA DA, BAGLIN TP, WEITZ JI, et al. Parenteral anticoagulants: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e24S-e43S
- HANKEY GJ, EIKELBOOM JW. Dabigatran etexilate: a new oral thrombin inhibitor. Circulation 2011; 123: 1436-50
- KOZEK-LANGENECKER SA. Perioperative coagulation monitoring. Best Pract Res Clin Anaesthesiol 2010 ; 24 : 27-40
- MUECK W, SCHWERS S, STAMPFUSS J. Rivaroxaban and other novel oral anticoagulants : pharmacokinetics in healthy subject, specific patient populations and relevance of coagulation monitoring. Thrombosis Journal 2013 ; 11 : 10
- NUTESCU EA, SPINLER SA, WITTKOWSKY A, et al. Low-molecular-weight heparins in renal impairment and obesity: available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother 2009; 43:1064-83
- PERNOD G, ALBALADEJO P, GODIER A, et al. Management of major bleeding complications and emergency surgery in patients on long-term treatment with direct oral anticoagulants, thrombin or factor Xa inhibitors : proposals of the Working Group on Perioperative Haemostasis (GIHP) – March 2013. Arch Cardiovasc Dis 2013 ; 106 :382-93
- SAMAMA MM, CONTANT G, SPIRO TE, et al. Laboratory assessment of rivaroxaban : a review. Thrombosis Journal 2013; 11:11
- SIÉ P, SAMAMA CM, GODIER A, et al. Chirurgies et actes invasifs chez les patients traités au long cours par un anticoagulant oral anti-IIa ou anti-Xa direct. Propositions du Groupe d’intérêt en hémostase périopératoire (GIHP) et du Groupe d’études sur l’hémostase et la thrombose (GEHT). Ann Fr Anesth Réanim 2011 ; 30 : 645-50
- STUDT JD, ALBERIO L, ANGELILO-SCHERRER A, et al. Accuracy and consistency of anti-Xa activity measurements for détermination of rivaroxaban plasma levels. J Thromb Haemost 2017; 15:1576-83
- VAN VEEN JJ, MAKRIS M. Management of perioperative anti-thrombotic therapy. Anaesthesia 2015 ; 70 (Suppl.1) : 58-67
- WEITZ JI, QUINLAN DJ, EIKELBOOM JW. Periprocedural management and approach to bleeding in patients taking dabigatran. Circulation 2012; 126:2428-32
