La symptomatologie des syndromes aortiques aigus est très voisine. De plus, elle peut mimer une embolie pulmonaire, un infarctus, une péricardite ou une oesophagite. Les moyens diagnostiques pour mettre en évidence les pathologies aortiques sont comparés dans le Tableau 18.3 [5,6,11]; ce sont essentiellement l'ETO, le CT-scan et l’IRM, auxquels il faut ajouter la radiographie du thorax et l'aortographie.
Radiographie du thorax
L'élargissement du médiastin est souvent présent, mais il est peu sensible et non spécifique. Lorsqu’elle est en place, la sonde gastrique est déplacée par un hématome péri-aortique. On peut voir un épanchement pleural (le plus souvent gauche) ou une disparition du bouton aortique. Des calcifications peuvent traduire la forme d'un anévrysme chronique. Dans 17% des cas, la radiographie thoracique est normale [2]. Son apport diagnostic est occasionnel [8].
CT-scan (Computed Tomography)
Le CT-scan permet de visualiser la totalité de l’aorte thoracique et abdominale, sa lumière, sa paroi et les tissus qui l’entourent. L'examen détermine la taille, la localisation et l'étendue de la lésion; il montre le départ des vaisseaux de la gerbe, le péricarde et l'espace pleural. Il met en évidence l’anévrysme, la dissection (flap), la plaque ulcérée pénétrant la paroi, l’hématome intrapariétal et les calcifications [3,5]. Toutefois, il reste une imagerie statique qui ne permet pas d'estimer la fonction ventriculaire ni la présence d'une insuffisance aortique. Son inconvénient est l'utilisation de produit de contraste. Il nécessite le déplacement du malade dans le scanner, mais il est rapide. Les nouvelles techniques multibarrettes et la reconstruction 3D lui donnent une sensibilité et une spécificité de 98 à 100% [1,8].
Echocardiographie transoesophagienne (ETO)
L'examen ETO est le moyen d'investigation le plus rapide dans les syndromes aortiques aigus; il prend 15-20 minutes et se fait au lit du malade. Il permet d’évaluer la fonction ventriculaire, la volémie, l’état des valves et une éventuelle tamponnade. Il est le premier choix chez les patients en état de choc, mais nécessite une sédation ou une intubation préalable. Sa sensibilité et sa valeur prédictive positive sont supérieures à 95%; sa spécificité est d'environ 95% [9]. Il est recommandé pour le suivi peropératoire et pour l'aide au placement des guides et des endoprothèses. Malheureusement, il présente deux inconvénients majeurs :
- La zone distale de l'aorte ascendante et la zone proximale de la crosse échappent à la visualisation depuis l'oesophage à cause de l'interposition de la trachée et de la bronche souche droite.
- La proximité et l’échogénicité de l’aorte induisent de nombreux artéfacts qui peuvent ressembler à s’y méprendre à une dissection ou à une rupture intimale; l’expérience de l’observateur est primordiale.
L'ETO met en évidence différents éléments (Figure 18.16 et Figure 18.17) (voir Chapitre 27 Aorte thoracique) [14].
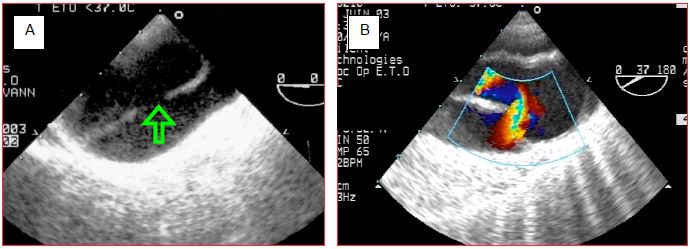
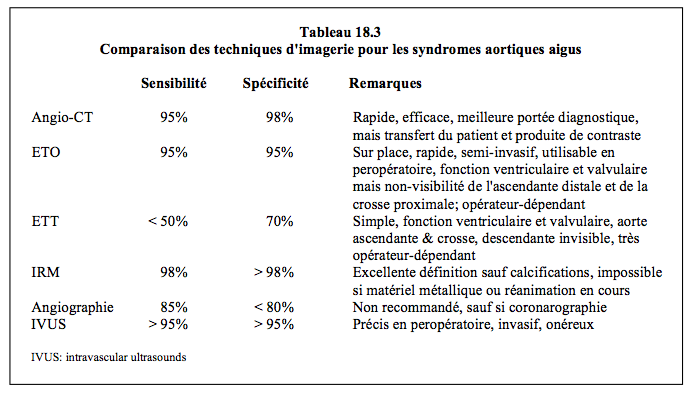
Figure 18.16 : Images ETO d’une dissection dans la crosse aortique avec la présence d’une déchirure dans la membrane (A). Au flux Doppler couleur, on voit le passage de sang de la vraie vers la fausse lumière (tourbillons colorés) (B).
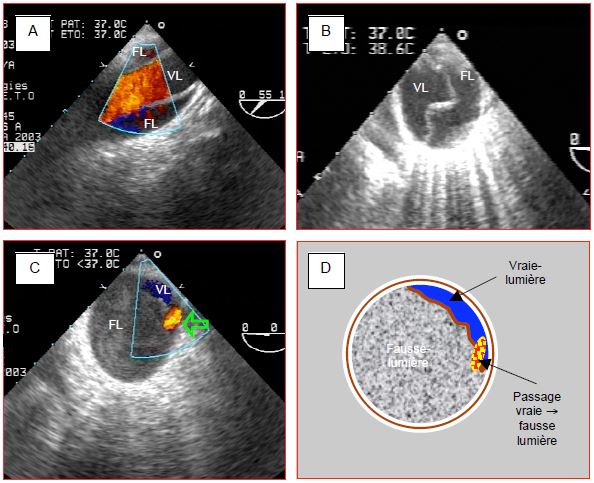
Figure 18.17 : Distinction entre la vraie (VL) et la fausse lumière (FL) dans une dissection A. A : crosse de l’aorte ; la Vmax du flux est plus élevée dans la vraie lumière (turbulences orange) que dans la fausse (flux laminaire bleu foncé). B : aorte descendante ; la FL tend à être plus grande que la VL ; la VL est pulsatile, elle s’expand en systole. C : aorte descendante ; la VL est un mince croissant situé entre 12 et 3 heures ; il existe un fort contraste spontané dans la fausse lumière, traduisant un bas débit sanguin ; l’orifice de réentrée est marqué par un flux tourbillonnaire . D : schéma de C.
- Taille et diamètre interne de l’aorte, délimitation d’un anévrysme.
- Membrane pulsatile à l'intérieur de la lumière aortique (flap) (Diss A Flap).
Visualisation de la vraie et de la fausse lumière; le flux est plus rapide dans la vraie lumière que dans la fausse (contraste spontané); la vraie lumière se dilate en systole; elle est en général plus petite que la fausse (Diss Ao desc Flap).
- Extension de la dissection, notamment dans les troncs coronariens; l'écho 3D est particulièrement performant pour évaluer l'état des ostia coronariens et des valvules aortiques [15].
- Contraste spontané ou flux ralenti dans la fausse lumière ou dans l’anévrysme, parfois présence de thrombus (DissA Chronique) (An A Desc 1).
- Les déchirures sont souvent localisables par les flux Doppler couleur: le flux passe de la vraie vers la fausse lumière en systole (Diss Vr Fa lum).
- Déchirure intimale traumatique (essentiellement au niveau de l’isthme) (Tr Ao isthm 1).
- Etat de l'anneau valvulaire aortique et des sinus de Valsalva (dilatation) ; examen de la valve aortique: degré d'insuffisance, possibilité de plastie ou nécessité de remplacement (Dissect A 2 IA).
- Mesure des diamètres de l'anneau aortique, des sinus de Valsalva, de la jonction sino-tubulaire et de l'aorte ascendante au niveau de son croisement avec l’artère pulmonaire droite (Figure 18.18).
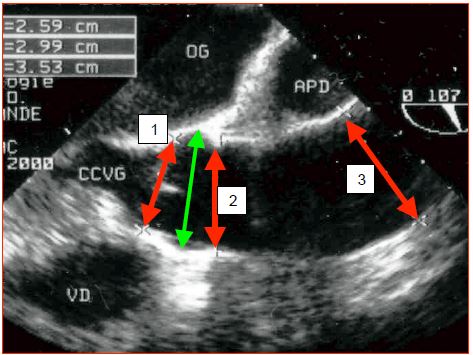
Figure 18.18 : Illustration échocardiographique transoesophagienne des différents diamètres de l'aorte ascendante. 1: anneau de la valve. 2: jonction sino-tubulaire. 3: aorte ascendante au niveau du croisement avec l'art pulmonaire droite (APD). Flèche verte : diamètre au niveau des sinus de Valsalva. CCVG: chambre de chasse du VG. APD: artère pulmonaire droite.
- L’excellente vue de l’aorte descendante permet d’y diagnostiquer et d’y quantifier facilement l’importance de l’athéromatose (Figures 27.67 et 27.68) ; l’ETO est moins performant pour l’aorte ascendante (Figure 27.69). Toutefois, l’athéromatose de l’aorte descendante est très clairement associée à celle de l’ascendante. De ce fait, le degré d’athéromatose observé dans la descendante est directement lié au taux d’AVC postopératoire [7].
Dans les cas d'extrême urgence, l'indication opératoire est fréquemment posée sur la seule foi de l'échocardiographie. Toutefois, la précision de cette dernière est insufisante pour fournir tous les détails nécessaires à la mise en place d’une endoprothèse. D'autre part, l'ETO est essentielle en peropératoire pour vérifier la position des guides dans la vraie lumière ou des canules de CEC dans les oreillettes et l'aorte.
Echocardiographie transthoracique (ETT)
L'échocardiographie transthoracique ne permet pas de visulasité la totalité de l'aorte, mais seulement la racine aortique avec l'aorte ascendante proximale (vue parasternale long-axe) et la crosse avec le départ des vaisseaux de la gerbe (vue sus-sternale) [4]. Contrairement à l'ETO, elle n'est pas praticable en peropératoire.
Echographie intravasculaire
L'échographie intravasculaire (intravascular ultrasounds, IVUS) génère des images transversales circonférentielles de haute définition et fournit une lecture en temps réel des dimensions vasculaires, y compris la visualisation des branches vasculaires (voir Figure 18.50 B). Elle est utilisée comme une alternative à l'angiographie dans le traitement de réparation de l'anévrisme thoracique endovasculaire [16]. Ce système évite l'irradiation liée au contrôle fluoroscopique, mais il est onéreux et impose une canulation artérielle supplémentaire.
Imagerie par Résonance Magnétique (IRM)
L’IRM offre certainement les images de la meilleure qualité et ne nécessite pas l'utilisation de produit de contraste, sauf si l’on pratique une angiographie au gadolinium. Elle met superbement en évidence les anévrysmes, les dissections avec les points d'entrée et les éventuels thrombus, les lésions traumatiques et les hématomes intrapariétaux (Figure 18.19) [5,9].
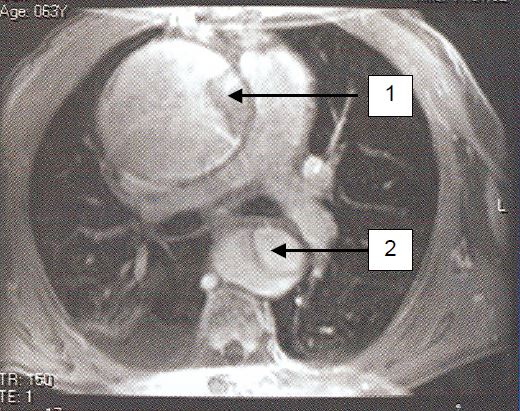
Figure 18.19 : Examen RMN d’une dissection A; 1: dissection dans l'aorte ascendante, qui est dilatée; 2: dissection dans l'aorte descendante.
On peut évaluer la fonction ventriculaire, la présence d'une insuffisance aortique et les flux dans la vraie et la fausse lumière (ciné-IRM) [12]. Toutefois, l'examen est long, il nécessite le déplacement du malade dans un endroit confiné et isolé, et ne permet pas d'examiner les patients dépendant d'un ventilateur et d'un monitorage complexe, car on ne peut pas introduire ce matériel dans la salle d'examen. Sa sensibilité et sa spécificité sont analogues ou supérieures à celles du CT-scan [8].
A noter que l’IRM et le CT-scan mesurent le diamètre externe de l’aorte, alors que l’ETO en mesure le diamètre interne ; ceci peut entraîner des divergences dans les résultats. La résolution spatiale du CT-scan est légèrement supérieure à celle de l’IRM [10].
Angiographie
L'aortographie est mal adaptée aux cas d'urgence. Son intérêt est de visualiser les différentes branches de l'aorte, y compris les coronaires, mais l'examen est invasif, long (moyenne 71 minutes) et compliqué; il réclame le transport du malade et l'injection de grandes quantités de produits de contraste (risque d'insuffisance rénale). Sa sensibilité et sa spécificité ne dépassent pas 85% [13]. La dissection s'apprécie par la densitométrie et le délai de perfusion par rapport au flux dans la vraie lumière; si les flux sont identiques ou si la fausse lumière est thrombosée, la lecture devient très difficile. On n'effectue une aortographie que lorsqu’une angiographie des vaisseaux est requise ou lorsqu'une coronarographie est indiquée [3].
| Moyens diagnostiques |
|
Radiographie thoracique : élargissement médiastinal, épanchement pleural (généralement gauche); peu sensible et peu spécifique.
CT-scan : la meilleure résolution spatiale; sensibilité et spécificité ≥ 98%. Pas de diagnostic fonctionnel, pas de visualisation de l’IA.
ETO : rapide, au lit du malade, diagnostic fonctionnel et valvulaire (IA); sensibilité 95%, spécificité > 90%. Inconvénients : artéfacts, pas de vision de l’aorte ascendante distale ni de la crosse proximale.
IRM : excellente résolution spatio-temporelle, diagnostic fonctionnel (IA). Inconvénient : examen long, peu disponible, dans une zone confinée où la réanimation est impossible.
Angiographie : indiquée seulement pour visualiser les vaisseaux et les coronaires.
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Décembre 2019
Références
- AGARWAL PP, CHUGHTAI A, MATZINGER FR, et al. Multidetector CT of thoracic aortic aneurysms. Radiographics 2009; 29:537-52
- EARNEST F IV, MUHM JR, SHEEDY PF II. Roentgenographic findings in thoracic aortic dissection. Mayo Clin Proc 1979; 54:43-50
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- EVANGELISTA A, FLACHSKAMPF FA, ERBEL R, et al. Echocardiography in aortic diseaases: EAE recommendations for clinical practice. Eur J Echocardiogr 2010; 11:645-58
- GOLDSTEIN SA, EVANGELISTA A, ABBARA S, et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American Society of Echocardiography and the European Association of CardioVascular Imaging. J Am Soc Echocardiogr 2015; 28:119-82
- GOLDSTEIN SA, MINTZ GS, LINDSAY J. Aorta: Comprehensive evaluation by echocardiography and transesophageal echocardiography. J Am Soc Echocardiogr 1993; 6:634-59
- HARTMAN GS, YAO FS, BRUEFACH M, et al. Severity of aortic atheromatous disease diagnosed by transesophageal echocardiography predicts stroke and other outcomes associated with coronary artery surgery: a prospective study. Anesth Analg 1996; 83:701-8
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- LAISSY JP, BLANC F, SOYER P, et al. Thoracic aortic dissection: diagnosis with transesophageal echocardiography versus MR imaging. Radiology 1995; 194:331-6
- LITMANOVICH D, BANKIER AA, CANTIN L, et al. CT and MRI in diseases of the aorta. AJR Am Roentgenol 2009; 193:928-40
- MOSKOWITZ DM, KAHN RA, REICH DL. Anesthesia for the surgical management of thoracic aortic disease. In: THYS DM, HILLEL Z, SCHWARTZ AJ. Textbook of cardiothoracic anesthesiology. New York, McGraw-Hill Co, 2001, 680-710
- NIENABER CA. The role of imaging in acute aortic syndromes. Eur Heart J Cardiovasc Imag 2013; 14:15-23
- NIENABER CA, VON KODOLITSCH Y, BROCKHOFF CJ, et al. Comparison of conventional and transesophageal echocardiography with magnetic resonance imaging for anatomical mapping of thoracic aortic dissection: a dual noninvasive imaging study with anatomical and/or angiographic validation. Int J Card Imaging 1994; 10:1-14
- NOWAK-MACHEN M. The role of transesophageal echocardiography in aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:317-29
- RODRIGUEZ-DIAZ CA, TRINH MA, WANG CJ. Use of real-time three-dimensional transesophageal echocardiography in type A aortic dissection: advantages of 3D TEE illustrated in three cases. Ann Card Anaesth 2015; 18:83-6
- TOZZI P, MARTY B, RUCHAT P, et al. Endovascular thoracic aneurysm repair without angiography. Innovations (Phila) 2009; 4:32-5
