Chez les malades ventilés en pression positive (IPPV, Intermittent positive pressure ventilation), on observe couramment que le degré de respiro-dépendance de la courbe de pression artérielle reflète le déficit présumé du volume circulant. Les indices dynamiques comprennent une série de données physiologiques mesurables qui oscillent au cours du cycle respiratoire en ventilation contrôlée: pression artérielle, volume systolique, flux aortique, retour veineux central, ou oscillations du septum interauriculaire. L'amplitude de leurs fluctuations est inversement proportionnelle au volume circulant et à la précharge ventriculaire. Les variations de ces indices en relation avec l’IPPV sont tributaires de deux phénomènes (voir Figure 6.33).
- Au moment de l'inspirium en IPPV, le sang contenu dans le lit pulmonaire est chassé vers l'OG, ce qui augmente la précharge du VG; de plus, celui-ci est comprimé de l’extérieur par l’augmentation de la pression intrathoracique (Pit), ce qui facilite son éjection. Son volume systolique s'accroît et la pression systolique mesurée en périphérie est plus élevée (Δup).
- Simultanément, l'élévation de la Pit freine le retour veineux vers l'OD, diminue la précharge du VD et augmente sa postcharge ; le volume systolique droit baisse. Le temps de transit pulmonaire entre le coeur droit et le coeur gauche étant de 2-4 cycles cardiaques, la précharge du VG est diminuée dès que le faible volume systolique droit atteint l’OG; la pression systolique baisse (Δdown).
Les variations hémodynamiques apparaissent au niveau du remplissage (volume des veines caves et des oreillettes, mouvements du septum interauriculaire) et de l’éjection (volume systolique, vélocité du flux aortique, pression artérielle). Leur origine est liée à la position du ventricule sur la courbe de Frank-Starling (Figure 6.46).
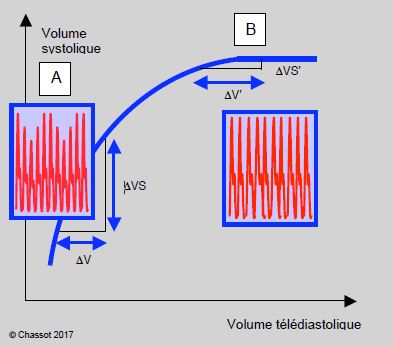
Figure 6.46 : Courbe de Frank-Starling. En hypovolémie (A), le VG est sur la partie verticale de la courbe (phase de recrutement) : de petites variations de remplissage (ΔV) se traduisent par de grandes variations de volume systolique (ΔVS). Les variations de remplissage dues aux oscillations de la Pit en IPPV donnent naissance à d’amples variations de pression artérielle. Lorsqu’il est au plateau de la courbe (B), au contraire, les variations ventilatoires disparaissent parce que les variations de remplissage (ΔV’) ne modifient plus le volume systolique (ΔVS’) ; seule la pression de remplissage augmente.
En hypovolémie, sur la partie verticale de la courbe (phase de recrutement), de petites variations de remplissage se traduisent par de grandes variations de volume systolique ; les variations de Pit en IPPV donnent naissance à d’amples variations de volume systolique, donc de pression artérielle. Lorsqu’il est au plateau de la courbe, au contraire, les variations ventilatoires disparaissent parce que les variations de remplissage ne modifient plus le volume systolique ; seule la pression de remplissage augmente [13]. Deux situations modifient la pente de la courbe de Starling (Figure 6.47).
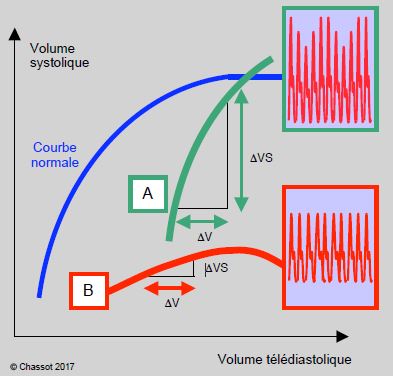
Figure 6.47 : Courbes de Frank-Starling en cas d’insuffisance diastolique (en vert) et d’insuffisance systolique (en rouge) comparées à une courbe normale (en bleu). Dans l’insuffisance diastolique (A), la pente de recrutement est très raide, le genou conduisant au plateau a disparu. Une variation de volume de remplissage se traduit par une très grande variation de volume systolique. Ceci conduit à une plus grande dépendance vis-à-vis de la précharge et à une accentuation des variations ventilatoires de la pression artérielle par rapport à la normale. Dans l’insuffisance systolique (B), la pente de recrutement est très plate, le genou conduit à une redescente de la courbe (baisse du VS par dilatation ventriculaire sur surcharge liquidienne). Une variation de volume de remplissage se traduit par une minime variation de volume systolique. La dépendance par rapport à la précharge est faible ; les variations ventilatoires de la pression artérielle disparaissent.
- L’insuffisance systolique est caractérisée par une courbe aplatie dont la pente est faible ; elle redescend même au-delà du genou ; les modifications de la précharge changent peu le volume systolique : les variations ventilatoires de la pression artérielle sont absentes. Les indices dynamiques ne sont pas pertinents.
- L’insuffisance diastolique présente une courbe très redressée : toute modification de précharge a un retentissement marqué sur le volume éjecté ; l’augmentation de Pit (IPPV, PEEP) et la perte de la pompe diaphragmatique (curarisation) ont un vaste impact sur le volume systolique et la pression artérielle. Les indices dynamiques sont très appropriés.
Les indices dynamiques sous ventilation mécanique n'ont de valeur pour évaluer l'hypovolémie que si certaines conditions sont remplies [4,29].
- Fonction systolique et diastolique normale des deux ventricules (FE VG > 0.4), absence de remodelage ventriculaire et de valvulopathie susceptibles d'altérer les conditions de charge.
- Absence d’arythmie. Les mesures doivent se concentrer sur une période sans arythmies; en cas de FA, elles sont inconsistantes [19].
- Les variations de pression intrathoracique d’origine ventilatoire doivent être importantes. Ceci implique deux conditions: 1) les poumons sont normalement compliants et 2) le volume courant (VC) est élevé (8-12 mL/kg). La transmission de la Pit est altérée en cas de SDRA et de compliance pulmonaire < 30 mL/cm H2O [9,26]. En ventilation protectrice à bas volume courant (5-8 mL/kg), la valeur prédictive des indices dynamiques pour l'hypovolémie est diminuée: elle passe de 95% lorsque le VC est élevé (10-12 mL/kg) à 51% lorsque le VC est bas (< 8 mL/kg) [19]. Pour tester la respiro-dépendance du volume circulant lors de ventilation protectrice, il faut augmenter le VC à 10-12 mL/kg pendant 2 minutes [25,34].
- La PEEP est peu élevée (≤ 5 cm H2O), car une surpression intrathoracique tend à exagérer les variations de VS ou de PA et à faire apparaître hypovolémique un patient qui ne l'est pas.
- La ventilation est réalisée en pression ou en volume contrôlé [22,41] ; les indices dynamiques habituels ne sont pas significatifs en respiration spontanée ou assistée [15].
- La fréquence cardiaque (FC) est ≥ 60 batt/min et la fréquence respiratoire (FR) est ≤ 15 cycles/min (rapport FC/FR > 4.0). Lorsque ce rapport est < 3.5, le rythme respiratoire interfère avec le remplissage de l'OG, car le réseau vasculaire pulmonaire n'a pas le temps de se remplir correctement [40].
- Le thorax est fermé et étanche ; les variations de la pression artérielle et du VS ne sont plus corrélées à la volémie lorsque le thorax et le péricarde sont ouverts [31,32,33]. Par contre, les indices statiques bidimensionnels ou volumétriques conservent leur capacité à représenter la précharge lorsque le thorax est ouvert. D'autre part, la PVC et la PAPO ne sont plus influencées par la Pit à thorax ouvert et traduisent plus fidèlement les pressions auriculaires.
- La pression abdominale est normale ; une surpression intra-abdominale atténue la réponse artérielle à la ventilation mécanique [10].
- La compliance artérielle est normale. Lorsque les artères sont calcifiées et rigides (compliance basse), on observe de fortes fluctuations respiratoires de la pression artérielle même en l'absence de modification significative du volume circulant [22].
- Les résistances artérielles (RAS) sont supposées rester normales et stables pendant la période de mesure. Des RAS élevées ou effondrées amputent les indices de leur valeur discriminative ; de plus, l’enregistrement non-invasif de la pulsatilité artérielle n’est souvent plus possible sous vasoconstricteurs.
- Le résultat est plus fiable si la période de mesure est synchronisée avec la durée d'un seul cycle ventilatoire [6,19].
Ces données sont liées à la ventilation mécanique. En respiration spontanée, l'élastance artérielle dynamique définie comme le rapport entre les variations de la pression pulsée et celles du volume systolique (VPP/VVS) est un prédicteur valable (r = 0.92) d'une réponse positive à l'administration liquidienne lorsqu’il est ≥ 1.4 (voir Chapitre 5, Déterminants de la fonction systolique, La postcharge) [7].
Variations respiratoires de la pression artérielle et du volume systolique
Les variations de la pression pulsée (PP = PAs – PAd) et du VS liées à la ventilation mécanique sont normalement inférieures à 10%. Ces variations sont calculées selon la formule : ΔPP = 100 x ([PPmax - PPmin] / [PPmax + PPmin]/2) = 100 x (PPmax - PPmin) / PPmoy [34]. La plupart des moniteurs récents de pression artérielle et de débit cardiaque continu affiche automatiquement les variations de la PAs, de la PP et/ou du VS (Intellivue™, PiCCO™, FloTrack™, etc) (voir Figure 6.33) [2].
L’hypovolémie place le malade sur la partie ascendante de la courbe de Starling (voir ci-dessus Figure 6.46), là où le débit systolique du VG est très dépendant de son degré de remplissage. Les variations alternées de la pression intrathoracique en IPPV induisent une oscillation respiratoire du volume de remplissage, qui se traduit par une variation conjointe du volume systolique et de la pression artérielle dont l’ampleur est proportionnelle au manque de volume circulant. Une variation ventilatoire du volume systolique, de la pression systolique, de la pléthysmographie ou de la pression pulsée supérieure à 15% signe en général une hypovolémie ; le coefficient de corrélation avec une augmentation du débit cardiaque après administration liquidienne est respectivement de 0.84, 0.86, 0.89 et 0.94, avec une valeur prédictive positive de 90-95%, une sensibilité de 85-90% et une spécificité de > 90% [14,21,22,27,41]. En général, les mesures les plus performantes sont celles de la pression pulsée (PP) et du volume systolique (VS) [23,27,30,40]. Le VS est plus sensible et plus spécifique que le débit cardiaque, car il est indépendant de la fréquence; la tachycardie a tendance à amortir l’effet de l’hypovolémie sur le DC [35]. Le rapport entre les variations (Δ) de la pression pulsée (ΔPP) et celles du volume systolique (ΔVS) peut indiquer l’état des RAS parce que la vasoplégie augmente les ΔVS davantage que les ΔPP (rapport ΔPP/ΔVS bas), alors que la vasoconstriction augmente les ΔPP plus que les ΔVS (rapport ΔPP/ΔVS > 1) [16]. La situation est en général claire lorsque la variation de la pression pulsée est > 15% (hypovolémie) ou < 9% (normovolémie). Dans la "zone grise" comprise entre ces deux valeurs, par contre, la situation est indécidable; c'est le cas dans environ 25% des patients [4]. Une augmentation momentanée du volume courant à 12 mL/kg peut diminuer l'étendue de cette zone grise [25].
Comme elle est fonction de la Pit, la variation de la pression artérielle est proportionnelle au volume courant (Figure 6.48). Une fois la normovolémie atteinte, les ΔPAs disparaissent (Figure 6.49) [8,28].
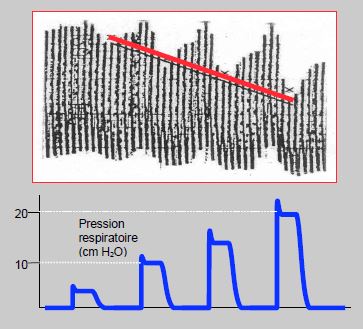
Figure 6.48: Test de réactivité potentielle au remplissage chez un patient ventilé en pression positive. On programme 4 inspirations du ventilateur à volume courant croissant et l’on observe la pente des variations engendrées sur la pression artérielle systolique [28]. Une valeur de > 0.24 mmHg/cm H2O prédit une réponse positive au remplissage (augmentation > 15% du débit cardiaque) avec une sensibilité de 87% et une spécificité de 83%.
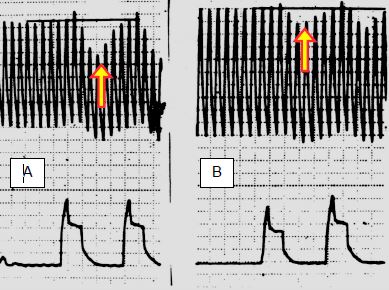
Figure 6.49 : Variabilité de la pression artérielle systolique en ventilation en pression positive lors d'hypovolémie. A : avant remplissage. B : après 500 ml de colloïde. Une variabilité supérieure à 12 mmHg a une valeur prédictive de 80% pour une réponse favorable au remplissage [8].
Pour les cas de chirurgie noncardiaque à risque faible ou intermédiaire et pour les cas d’endoscopie ou de radiologie interventionnelle où l’on hésite à poser un cathéter artériel, la variation respiratoire de la pulsation artérielle peut être évaluée avec efficacité par des techniques non-invasives comme la photopléthysmographie (CNAP™, ClearSight™, esCCO™, T-Line™, Masimo Set™); le coefficient de corrélation avec une réponse positive au remplissage est de 0.7-0.8 [3]. Ces appareils permettent d’afficher sur le moniteur un index de variabilité de la SpO2 et/ou de la PA (PVI, Pleth Variability Index) qui est bien corrélé aux variations de la pression pulsée [3]. Lorsque cet index est > 15%, la probabilité d’hypovolémie est élevée (0.71-0.79) [14,38,40,42]. Ces systèmes ne fonctionnent correctement que lorsque la pulsatilité est captée sur un doigt bien perfusé, chez un patient sous anesthésie générale profonde et en l'absence de vasoconstriction périphérique [36,42]. L'efficacité est douteuse lorsque le capteur est placé au lobe de l’oreille.
La vélocité maximale du flux aortique (VmaxAo) à l’ETO varie au cours du cycle respiratoire en pression positive proportionnellement au degré de remplissage vasculaire. Une variation respiratoire du flux de ≥ 15% indique une hypovolémie et a une excellente valeur prédictive positive sur la réponse au remplissage (r = 0.93), alors qu'une variation ≤ 10% prédit une non-réponse au volume (sensibilité de 90% et spécificité de 89%) (Figure 6.50A) [12].
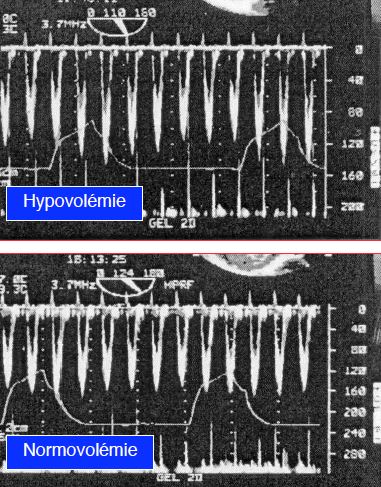
Figure 6.50 A : Indices dynamiques de remplissage à l’ETO. Variation ventilatoire de la Vmax du flux aortique en vue transgastrique profonde: en cas d'hypovolémie, cette variation est > 15%; elle est < 10% en normovolémie [12].
Cette mesure peut être remplacée par celle de la variation de l'intégrale des vélocités (ITV) ou celle du raccourcissement de surface en court-axe du VG, qui sont toutes deux proportionnelles au volume éjecté et qui affichent une excellente corrélation avec une réponse positive à l'administration liquidienne (r = 0.91) [5]. Toutes ces mesures présupposent toutefois que la fonction du VG est normale et qu'elle ne se modifie pas au cours du suivi.
Variations ventilatoires du retour veineux (ETO)
Le diamètre et la surface de la veine cave supérieure intrathoracique (VCS), faciles à mesurer à l’ETO, varient avec le cycle du respirateur en fonction du degré de remplissage de la veine. Lorsqu’elle est peu remplie, la VCS collabe pendant l’inspirium de l’IPPV ; c’est l’équivalent d’une zone II de West. Au contraire, elle maintient son diamètre en normovolémie parce qu’elle en zone III. Si la surface de la VCS se modifie de plus de 40% au cours du cycle respiratoire, la POD est inférieure à 10 mmHg (Figure 6.50B) [39].
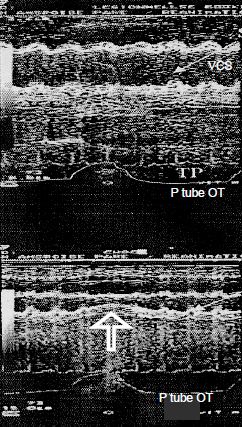
Figure 6.50 B : Variation du diamètre de la veine cave supérieure (VCS) (vue rétrocardiaque bicave haute à 100° en mode TM) ; la VCS diminue de diamètre par compression lorsque la Pit augmente (flèche verticale). L’image du haut est en normovolémie, l’image du bas en hypovolémie; la diminution de diamètre est proportionnelle au degré d'hypovolémie [39]. P tube OT : pression dans le tube oro-trachéal.
La même observation peut être réalisée sur la veine cave inférieure (VCI) dans son trajet intrahépatique. Pendant l’inspirium du respirateur, celle-ci augmente de volume à cause de la stase imposée par l'élévation de la pression intrathoracique. En hypovolémie, la pression dans la VCI est basse, et les variations de la Pit sont plus importantes que la valeur de la POD. A l'ETO en ventilation mécanique, la variation du diamètre de la VCI est > 16% en cas d'hypovolémie (voie transgastrique) (Figure 6.50C) [11].
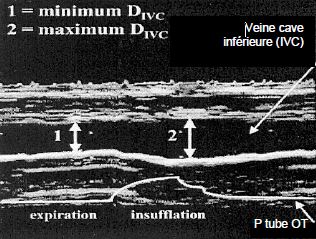
Figure 6.50 C : Variation du diamètre de la VCI rétrohépatique (vue ETO transgastrique 90° en mode TM) ; le diamètre maximum correspond au pic de pression intrathoracique (Pit) à cause de la stase veineuse due à l'élévation de la Pit. La corrélation d'une variation > 16% avec une réponse positive au remplissage est de 0.82 [11]. P tube OT : pression dans le tube oro-trachéal.
Ces données sur la VCI concernent l'échocardiographie transoesophagienne chez des malades en ventilation mécanique. Les valeurs sont différentes à l'échocardiographie transthoracique (voie sous-xyphoïdienne) en respiration spontanée: le seuil pour le diagnostic d'hypovolémie est alors une variation respiratoire du diamètre de la VCI ≥ 50% [17]. En hypervolémie, les pressions de remplissage sont plus élevées que la Pit moyenne et la VCI distendue modifie très peu son diamètre avec le cycle ventilatoire, en ventilation mécanique comme en respiration spontanée.
Variations ventilatoires des oscillations septales (ETO)
Lors de l'inspirium en pression positive, le retour veineux à l'OG est augmenté parce que les poumons sont comprimés comme une éponge ; le volume de l'OG augmente, alors que celui de l'OD diminue à cause du faible retour veineux extrathoracique. Le septum interauriculaire (SIA) va donc bomber de la gauche vers la droite. Au cours de l'expirium, la situation s'inverse, et le septum retrouve sa place. En normovolémie, l’apport de volume à l’OG est suffisant pour que ce bombement tende le septum et efface les oscillations cardiogéniques (Vidéo).
Vidéo: oscillations cardiogéniques normales du septum interauriculaire chez un patient normovolémique; lors de l'inspirium du respirateur (ventilation mécanique), le septum est repoussé dans l'OD à cause du sur-remplissage momentané de l'OG; comme le septum est mis sous tension, les oscillations sont diminuées ou disparaissent à ce moment.
En hypovolémie, cet apport est insuffisant pour tendre le septum, et les oscillations persistent aux deux temps de la ventilation (voir Chapitre 27, Evaluation de la volémie). La présence ou l'absence des oscillations cardiogéniques du SIA pendant les deux temps du cycle respiratoire permet d'évaluer la valeur de la POG (voir Figure 6.41) [18].
Vidéo: oscillations cardiogéniques normales du septum interauriculaire chez un patient normovolémique; lors de l'inspirium du respirateur (ventilation mécanique), le septum est repoussé dans l'OD à cause du sur-remplissage momentané de l'OG; comme le septum est mis sous tension, les oscillations sont diminuées ou disparaissent à ce moment.
En hypovolémie, cet apport est insuffisant pour tendre le septum, et les oscillations persistent aux deux temps de la ventilation (voir Chapitre 27, Evaluation de la volémie). La présence ou l'absence des oscillations cardiogéniques du SIA pendant les deux temps du cycle respiratoire permet d'évaluer la valeur de la POG (voir Figure 6.41) [18].
- Septum tendu aux deux temps du ventilateur : POG > 16 mmHg ;
- Présence d’oscillations cardiogéniques à l’expirium mais disparition à l’inspirium du ventilateur : normovolémie (POG = 12 mmHg) ;
- Persistance des oscillations cardiogéniques aux deux temps respiratoires : hypovolémie (POG ≤ 10 mmHg) (Figure 6.51).
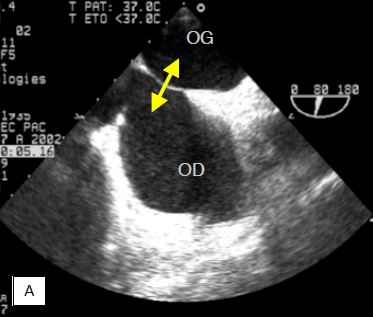
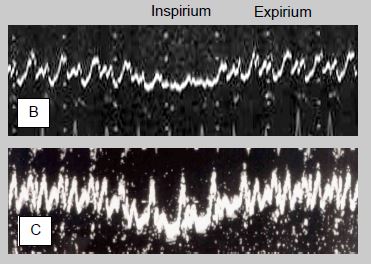
Figure 6.51 : Modification des oscillations cardiogéniques du septum interauriculaire lors de la ventilation en pression positive (image ETO des mouvements du septum déroulés dans le temps). En normovolémie (A), l’apport de volume à l’OG lors de l’inspirium du respirateur est suffisant pour effacer les oscillations du septum, qui bombe dans l’OD. En hypovolémie (B), cet apport est insuffisant, et les oscillations cardiogéniques persistent aux deux temps de la ventilation.
En l’absence de dysfonction ventriculaire et de valvulopathie mitrale ou tricuspidienne, la valeur prédictive positive pour une hypovolémie est de 97%, la sensibilité de 89% et la spécificité de 95% [18].
Pertinence des différents indices
Une comparaison des différentes méthodes d’évaluation de l’hypovolémie par la réponse probable au remplissage montre que leur valeur prédictive (en pourcent et en surface proportionnelle sous la courbe ROC) est par ordre croissant (Figure 6.52) [1,4,20,21,22,24]:
- Pressions de remplissage (PVC-PAPO) : < 50%, ROC 0.55 ;
- Surface télédiastolique du VG : < 68%, ROC 0.64 ;
- Variations ventilatoires de la PAs : > 70%, ROC 0.72 ;
- Variations ventilatoires de la PAdiff : > 75%, ROC 0.0.78-0.89 ;
- Variations ventilatoires du diamètre de la VCI: > 90%, ROC 0.90;
- Variations ventilatoires du raccourcissement de surface du VG: > 90%, ROC 0.91 ;
- Variations ventilatoires du VS : > 90%, ROC 0.92 ;
- Variations ventilatoires du flux aortique : > 90%, ROC 0.93 ;
- Variations ventilatoires des oscillations septales auriculaires : > 90%.
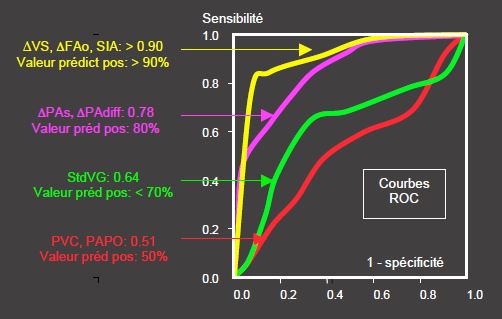
Figure 6.52 : Courbes ROC (Receiving operator curve) traduisant le degré de spécificité et de sensibilité des diverses méthodes pour évaluer l’hypovolémie [21,22,24]. La valeur prédictive positive est indiquée en pourcent ; le degré de corrélation avec l’importance de l’hypovolémie est mesuré par la surface sous la courbe ROC en proportionnalité avec la surface du quadrilatère dans lequel elle est incluse (AUC: Area under the curve). La technique la moins performante est la mesure des pressions de remplissage (PVC, PAPO); leur valeur prédictive d'environ 50% signifie qu'il y a autant de chance qu'une mesure donnée signifie une hypovolémie qu'une normovolmie. La mesure de la surface télédiastolique du VG (StdVG) est meilleure, mais surtout adéquate pour le suivi du même patient. Les indices dynamiques (Δ) sont certainement supérieurs, particulièrement les variations ventilatoires du volume systolique (ΔVS), du flux aortique (ΔFAo) et des oscillations du septum interauriculaire (SIA).
En clinique, l'hypovolémie se définit par un faisceau d'indices recueillis par différents instruments de mesure (Tableau 6.7).
Lorsqu’on met en relation la courbe de Frank-Starling et la courbe de compliance sur un même graphique dont l’abscisse représente la précharge, on voit apparaître deux zones de configurations différentes selon que l’individu est en hypovolémie ou en hypervolémie (Figure 6.53) [37].
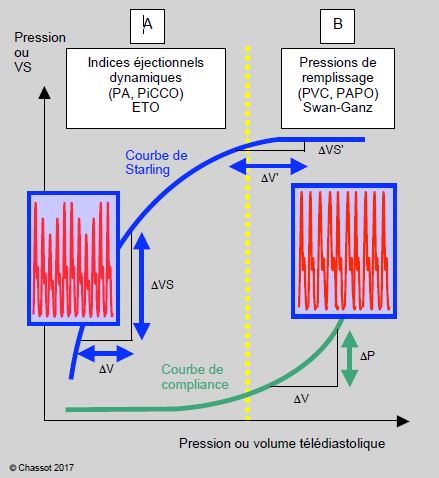
Figure 6.53 : Les deux phases de la courbe de Frank-Starling et de la courbe de compliance déterminent les meilleures techniques de monitorage. Ces deux phases sont séparées par un pointillé jaune vertical. A : A gauche, en hypovolémie, ce sont les indices éjectionnels dynamiques (variations ventilatoire de la pression artérielle et du volume systolique VS) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO, oscillations du septum interauriculaire) qui sont les plus pertinentes. B : A droite, en hypervolémie, ce sont les pressions de remplissage fournies par la Swan-Ganz (PVC, PAPO) qui deviennent utiles. En effet, la relation précharge - volume systolique (effet Frank-Starling) est bien marquée pendant la phase de recrutement de la courbe de Starling (hypovolémie), alors que la relation pression - volume de remplissage (compliance) n’est significative que pendant la phase de redressement de la courbe de compliance (hypervolémie).
En hypovolémie, la courbe de Starling est très redressée et les variations de précharge se traduisent par de fortes variations du volume systolique (phase de recrutement). La courbe de compliance est au contraire très plate et la pression de remplissage varie peu avec le volume télédiastolique. Ce sont donc les indices éjectionnels dynamiques (variations ventilatoire de la pression artérielle et du volume systolique) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO oscillations du septum interauriculaire) qui sont les plus pertinentes.
En hypervolémie (insuffisance cardiaque congestive, valvulopathie mitrale, surcharge liquidienne), la courbe de Starling s’est aplatie, alors que la courbe de compliance s’est redressée: le volume systolique ne varie plus avec le volume de la précharge, alors que la pression de remplissage est significativement corrélée au volume de remplissage. Ce sont donc les pressions de remplissage (PVC, PAPO) fournies par la voie centrale ou le cathéter pulmonaire de Swan-Ganz qui deviennent les plus utiles. D’autant plus qu’elles permettent de gérer l’administration liquidienne en fonction de la pression qui règne là où le risque d’oedème tissulaire est le plus important. Les malades en dysfonction ventriculaire ou souffrant d’un syndrome de fuite capillaire se trouvent dans la situation de l’hypervolémie.
| Indices dynamiques |
|
Les indices dynamiques comprennent une série de données physiologiques mesurables qui oscillent au cours du cycle respiratoire en ventilation contrôlée: pression artérielle, volume systolique, flux aortique, retour veineux central, positions du septum interauriculaire. L'amplitude de leurs fluctuations est inversement proportionnelle au volume circulant et à la précharge ventriculaire, sous certaines conditions:
- Ventilation mécanique à volume courant > 8 mL/kg et PEEP ≤ 5 cm H2O
- Compliance pulmonaire normale
- Fonction ventriculaire normale, absence d'arythmie et de valvulopathie
- Thorax et péricarde fermés
- Compliance et résistance artérielle normales
- Pression abdominale normale
Une variation ventilatoire de > 15% du VS, de la PAs ou de la PP signe en général une hypovolémie. Cette variation est < 9% en normovolémie.
La technique la plus appropriée pour évaluer la volémie varie en fonction de celle-ci. En hypovolémie, les indices éjectionnels dynamiques (variations ventilatoire de la pression artérielle et du volume systolique) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO, oscillations du septum interauriculaire) sont les plus pertinentes. En hypervolémie, les pressions de remplissage (PVC, PAPO) fournies par la voie centrale ou le cathéter pulmonaire de Swan-Ganz deviennent les plus utiles. Pression artérielle, PiCCO, échocardiographie et cathéter pulmonaire sont complémentaires et offrent des performances différentes selon que l’on est en hyper- ou en hypovolémie.
|
© CHASSOT PG Août 2010, dernière mise à jour Août 2017
Références
- ANSARI BM, ZOCHIOS V, FALTER F, KLEIN AA. Physiological controversies and methods used to determine fluid responsiveness: a qualitative systematic review. Anaesthesia 2016; 71:94-105
- CANNESSON M. Arterial pressure variation and goal-directed fluid therapy. J Cardiothorac Vasc Anesth 2010; 24:487-97
- CANNESSON M, ATTOF Y, ROSAMEL P, et al. Respiratory variations in pulse oxymetry plethysmographic waveform amplitude to predict fluid responsiveness in the operating room. Anesthesiology 2007; 106:1105-11
- CANNESSON M, LE MANACH Y, HOFER CK, et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness. A “grey zone” approach. Anesthesiology 2011; 115:231-41
- CANNESSON M, SLIEKER J, DESEBBE O, et al. Prediction of fluid responsiveness using respiratory variations in left ventricular stroke area by transesophageal echocardiography automated border detection in mechanically ventilated patients. Crit Care 2006; 10:R171
- CANNESSON M, SLIEKER J, DESEBBE O, et al. The ability of a novel algorithm for automatic estimation of the respiratory variations in arterial pulse pressure to monitor fluid responsiveness in the operating room. Anesth Analg 2008; 106:1195-200
- CECCONI M, MONGE GARCIA MI, GRACIA ROMERO M; et al. The use of pulse pressure variation and stroke volume variation in spontaneous breathing patients to assess dynamic arterial elastance and to predict arterial pressure response to fluid adminstration. Anesth Analg 2015; 120:76-84
- CORIAT P, VRILLON M, PEREL A, et al. A comparison of systolic blood pressure variations and echocardiographic estimates of end-diastolic left ventricular size in patients after aortic surgery. Anesth Analg 1994; 78:46-53
- DE BACKER D, HEENEN S, PIAGNERELLI M, et al. Pulse pressure variations to predict fluid responsiveness: influence of tidal volume. Intensive Care Med 2005; 31:517-23
- DUPERRET S, LHUILLIER F, PIRIOU V, et al. Increased intra-abdominal pressure affects respiratory variations in arterial pressure in normovolaemic and hypovolaemic mechanically ventilated healthy pigs. Intens Care Med 2007; 33:163-71
- FEISSEL M, MICHARD F, FALLER JP, TEBOUL JL. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med 2004; 30:1834-7
- FEISSEL M, MICHARD F, MANGIN I, et al. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock. Chest 2001; 119:867-73
- FUJITA Y, YAMAMOTO T, SANO I, et al. A comparison of changes in cardiac preload variables during graded hypovolemia and hypervolemia in mechanically ventilated dogs. Anesth Analg 2004; 99:1780-6
- GUERIN L, MONNET X, TEBOUL JL. Monitoring volume and fluid responsiveness: from static to dynamic indicators. Best Practice Res Clin Anaesthesol 2013; 27:177-85
- HEENEN S, DE BAKER D, VINCENT JL. How can the response to volume expansion in patients with spontaneous movements be predicted ? Critical Care 2006; 10:R102
- HOLDER AL, PINSKY MR. Applied physiology at the bedside to drive resuscitation algorithms. J Cardiothorac Vasc Anesth 2014; 28:1642-59
- KIM YH, KIM S, KIM JS, et al. Inferior vena cava collapsibility index, renal function, and adverse outcomes in patients with broad spectrum cardiovascular disease. Echocardiography 2017; 34:20-8
- KUSOMOTO FM, MUHIUDEEN IA, KUECHERER HF, et al. Response of the interatrial septum to transatrial pressure gradients and its potential for predicting pulmonary capillary wedge pressure: an intraoperative study using transesophageal echocardiography in patients during mechanical ventilation. J Am Coll Cardiol 1993; 21:721-8
- LANSDORP B, LEMSON J, VAN PUTTEN JAM, et al. Dynamic indices do not predict volume responsiveness in routine clinical practice. Br J Anaesth 2012; 108:395-401
- MARIK PE, CAVALLAZZI R. Does the central venous pressure predict fluid responsiveness ? An update meta-analysis and a plea for some common sense. Crit Care Med 2013; 41:1774-81
- MARIK PE, CAVALLAZZI R, VASU T, et al. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: A systematic review of the literature. Crit Care Med 2009; 37:2642-7
- MICHARD F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103:419-28
- MICHARD F, BOUSSAT S, CHEMLA D, et al. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory failure. Am J Respir Crit Care Med 2000; 162:134-8
- MICHARD F, TEBOUL JL. Predicting fluid responsiveness in ICU patients. A critical analysis of evidence. Chest 2002; 121:2000-8
- MIN JJ, GIL NS, LEE JH, et al. Predictor of fluid responsiveness in the "grey zone": augmented pulse pressure variation through a temporary increase in tidal volume. Br J Anaesth 2017; 119:50-6
- MONNET X, BLEIBTREU A, FERRÉ A, et al. Passive leg-raising and end-expiratory occlusion tests perform better than pulse pressure variation in patients with low respiratory system compliance. Crit Care Med 2012; 40:152-7
- MONNET X, DRES M, FERRE A, et al. Prediction of fluid responsiveness by a continuous non-invasive assessment of arterial pressure in critically ill patients: comparison with four other dynamic indices. Br J Anaesth 2012; 109:330-8
- PEREL A, MINKOVICH L, PREISMAN S, et al. Assessing fluid responsiveness by a standardized ventilatory maneuver: the respiratory systolic variation test. Anesth Analg 2005; 100:942-5
- RENNER J, SCHOLZ J, BEIN B. Monitoring fluid therapy. Best Pract Res Clin Anaesthesiol 2009; 23:159-71
- REUTER DA, FELBINGER TW, KILGER E, et al. Optimizing fluid therapy in mechanically ventilated patients after cardiac surgery by on-line monitoring of left ventricular stroke volume variations. Brit J Anaesth 2002; 88:124-6
- REUTER DA, GORESH T, GOEPFERT MSG, et al. Effects of mid-line thoracotomy on the interaction between mechanical ventilation and cardiac filling during cardiac surgery. Br J Anaesth 2004; 92:808-13
- REX S, BROSE S, METZELDER S, et al. Prediction of fluid responsiveness in patients during cardiac surgery. Br J Anaesth 2004; 93:782-8
- REX S, SCHÄLTE G, SCHROTH S, et al. Limitations of arterial pulse pressure variation and left ventricular stroke volume variation in estimating cardiac pre-load during open-heart surgery. Acta Anaesthesiol Scand 2007; 51:1258-67
- ROBERSON RS. Respiratory variation and cardiopulmonary interactions. Best Practice Res Clin Anaesthesiol 2014; 28:407-18
- ROOKE GA, SCHWID HA, SHAPIRA Y. The effect of graded hemorrage and intravascular volume replacement on systolic pressure variation in humans during mechanical and spontaneous ventilation. Anesthesiology 1995; 80:925-32
- SAUGEL B, CECCONI M, REUTER DA. Noninvasive continuous cardiac output monitoring in perioperative and intensive care medicine. Br J Anaesth 2015; 114:562-75
- SPAHN DR, CHASSOT PG. Con. Fluid restriction for cardiac patients during major noncardiac surgery should be replaced by goal-directed intravascular fluid administration. Anesth Analg 2006; 102:344-6
- TSUCHIYA M, YAMADA T, ASADA A. Pleth variability index predicts hypotension during anesthesia induction. Acta Annaesthesiol Scand 2010; 54:596-602
- VIEILLARD-BARON A, AUGARDE R, PRIN S, et al. Influence of superior vena caval zone condition on cyclic changes in right ventricular outflow during respiratory support. Anesthesiology 2001; 95:1083-8
- VISTISEN ST, ENEVOLDSEN JN, GREISEN J, JUHL-OLSEN P. What the amaesthesiologist needs to know about heart-lung interactions. Best Pract Res Clin Anaesthesiol 2019; 33:165-77
- WIESENACK C, PRASSER C, RÖDIG G, KEYL C. Stroke volume variation as an indicator of fluid responsiveness using pulse contour analysis in mechanically ventilated patients. Anesth Analg 2003; 96:1254-7
- ZIMMERMANN M, FEIBICKE T, KEYL C, et al. Accuracy of stroke volume variation compared with pleth variability index to predict fluid responsiveness in mechanically ventilated patients undergoing major surgery. Eur J Anaesthesiol 2010; 27:555-61
