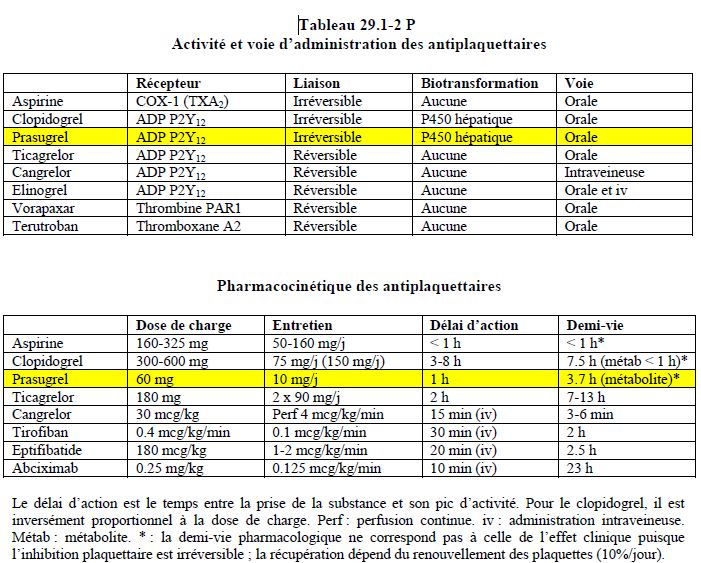
Le prasugrel est une nouvelle thiénopyridine sur le marché depuis 2010 ; c’est un bloqueur irréversible du récepteur ADP P2Y12 (pont disulfure), mais il présente des différences pharmacologiques avec le clopidogrel (Tableau 29.1-2 P) [17].
- Les estérases transforment le prasugrel en un métabolite intermédiaire actif et non en une substance inactive.
- Le métabolisme hépatique ne présente qu’une seule étape via les cytochromes CYP3A et CYP2B6 ; il est beaucoup plus constant que celui du clopidogrel car il ne dépend pas du phénotype des cytochromes [7]. Il n’y a pas d’interférence avec le métabolisme des statines ni des bloqueurs de la pompe à proton, mais les inhibiteurs puissants du CYP3A comme le ritonavir peuvent réduire l’action du prasugrel [3].
- La demi-vie du métabolite actif est de 3.7 heures.
Le prasugrel est environ 10 fois plus puissant que le clopidogrel. Après une dose de charge de 60 mg, le temps nécessaire à atteindre le pic d’effet est d’une heure (pic de concentration plasmatique à 0.5 heure). Le degré d’inhibition plaquettaire obtenu est de 80% à 6 heures. Le taux de non-répondeurs n’est que de 3% (25% avec le clopidogrel) [19]. La dose d’entretien est de 10 mg/jour.
L’étude TRITON-TIMI 38 a comparé le prasugrel au clopidogrel chez 13'608 patients sous bithérapie (aspirine + prasugrel ou clopidogrel) après SCA. Le prasugrel diminue davantage le risque d’accident cardiovasculaire (OR 0.81), particulièrement chez les diabétiques (OR 0.60) et après infarctus de type STEMI (OR 0.68 - 0.74) [9,15,18,19]. Après PCI, le prasugrel est deux fois plus efficace que le clopidogrel dans la prévention de la thrombose de stent (OR 0.48), particulièrement pendant le premier mois (OR 0.41) [19]. Par contre, il fait jeu égal avec le clopidogrel lorsque les malades ne sont pas revascularisés [11], bien qu’il diminue significativement la réactivité plaquettaire [5]. Ceci démontre une fois de plus le manque de corrélation entre l’agrégabilité plaquettaire in vitro et le devenir clinique des patients. Plus récemment, la comparaison entre ticagrelor et prasugrel dans le syndrome coronarien aigu avec PCI et pose de stent a donné l'avantage au prasugrel: le taux de mortalité, d'infarctus et d'ictus à 1 an est de 9.3% avec le premier et de 6.9% avec le second (HR 1.36); le taux de thrombose de stent est respectivement de 1.3% et 1.0% (HR 1.3). Le risque hémorragique n'est pas significativement différent (HR 1.12) [12].
Malheureusement, le prasugrel présente un risque d’hémorragies majeures très augmenté par rapport au clopidogrel (2.4% au lieu de 1.8%, OR 1.51). Les personnes âgées (> 75 ans), les malades de petite taille (< 60 kg) et les patients souffrant d’ictus (risque d’hémorragie intra-crânienne) sont particulièrement exposés au risque de saignement spontané; de plus, l'efficacité du prasugrel est limitée dans ces catégories de malades (OR 0.94 par rapport au clopidogrel) [20]. Au cours d’opérations cardiaques, les pertes sanguines sont augmentées plus de quatre fois (OR 4.73) par rapport au clopidogrel. Le bénéfice du prasugrel apparaît pendant le premier mois après SCA ou PCI, après quoi les courbes de survie sous chacun des deux médicaments deviennent parallèles (Figure 29.9) [19]. Pour cette raison, certains auteurs ont proposé de passer du prasugrel au clopidogrel après 4-6 semaines chez les malades à risque hémorragique élevé [13]. Vu le haut degré de blocage opéré par le prasugrel, une dose de charge est inutile au début du traitement par le clopidogrel, alors qu’elle est nécessaire après un traitement de ticagrelor à cause de la rapidité de disparition de l’effet de ce dernier [1].
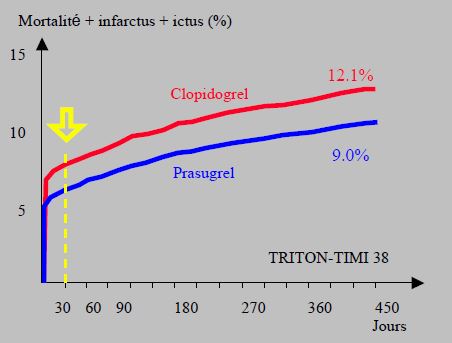
Figure 29.9 : Courbes de survie à 1 an des patients de l’étude TRITON-TIMI 38. Le taux combiné de mortalité, d’infarctus et d’ictus est 25% plus bas sous prasugrel que sous clopidogrel. Toutefois, le bénéfice du prasugrel apparaît pendant le premier mois après SCA ou PCI (flèche jaune), après quoi les courbes de survie sous chacun des deux médicaments deviennent parallèles [19]. Pour cette raison, il est possible de passer du prasugrel au clopidogrel après 4-6 semaines chez les malades à risque hémorragique élevé afin de minimiser les saignements à long terme [13].
D’une manière générale, le prasugrel est contre-indiqué en cas d’anamnèse d’accident vasculaire cérébral, d’âge avancé et de risque hémorragique élevé. De ce fait, il n'est pas recommandé si une intervention chirurgicale est envisagée dans un futur proche, notamment en cas de SCA pouvant conduire à une revascularisation coronarienne chirurgicale. Il est contre-indiqué chez les malades dont l’anatomie coronarienne n’est pas encore connue, d'autant plus que le prétraitement au prasugrel avant PCI ne réduit pas le risque ischémique mais augmente le risque hémorragique [8,16].
Les indications propres du prasugrel sont les situations où il donne des résultats très supérieurs à ceux du clopidogrel [4,14,16,17] :
- Infarctus de type STEMI (effet clinique en < 1 heure) ;
- SCA / infarctus non-STEMI si PCI certaine (anatomie coronarienne connue, pas de chirurgie) ;
- SCA / infarctus et PCI chez les diabétiques ;
- Stents à haut risque ou anamnèse de thrombose de stent sous clopidogrel ;
- Résistance au clopidogrel selon le génotypage ou les tests d’activité plaquettaire ;
- Le prasugrel n'est pas recommandé en cas de risque hémorragique élevé, de coronaropathie stable ou de traitement médical sans PCI;
- Le prasugrel est actuellement en perte de vitesse face au ticagrelor.
Compte tenu de son haut degré d'inhibition plaquettaire, il est recommandé d’arrêter le prasugrel 7 jours avant une opération, bien que la coagulation soit théoriquement normale lorsque > 50% des plaquettes ont été renouvelées (5 jours). Cette recommandation, proposée pour des raisons de sécurité [2,6], est confirmée par une étude montrant que l’agrégabilité plaquettaire est récupérée à 78% après 7 jours d’arrêt du prasugrel (test VerifyNow™) [10].
Le métabolisme variable du clopidogrel, les risques hémorragiques du prasugrel et la longue durée d’action des deux médicaments ont incité à rechercher de nouvelles substances antiplaquettaires dont les caractéristiques devraient être une activité rapide, puissante, réversible et constante dans la population.
| Antiplaquettaires nouvellement introduits sur le marché (I) : Prasugrel |
|
Thiénopyridine 10 fois plus puissante que le clopidogrel, bloquant irréversiblement le récepteur ADP (P2Y12) et réduisant l’agrégation plaquettaire de 80%. Métabolisme particulier :
- Transformation en un métabolite intermédiaire actif par les estérases;
- Oxydation en un métabolite actif (demi-vie 3.7 heures) par des cytochromes hépatiques ;
- Métabolisme hépatique stable, indépendant du phénotype ;
- Taux de non-répondeurs faible : 3% ;
- Effet pour la durée de vie de la plaquette, disparition de l’effet clinique en ≥ 5-7 jours ;
- Durée d’interruption recommandée avant chirurgie : 7 jours.
Dose de charge : 60 mg (pic d’activité après 1 heure), entretien : 10 mg/j. Par rapport au clopidogrel, le prasugrel diminue davantage le taux d’infarctus et de thrombose de stent après SCA, STEMI et/ou PCI ; il est particulièrement efficace chez les diabétiques et chez les non-répondeurs au clopidogrel. Le risque hémorragique est plus élevé qu’avec le clopidogrel : hémorragies spontanées 1.5 fois, hémorragie en chirurgie cardiaque 4-5 fois. Particulièrement indiqué en cas de :
- Infarctus de type STEMI et PCI ;
- SCA / infarctus non-STEMI si PCI certaine et anatomie coronarienne connue ;
- PCI en cas de diabète ;
- Stents à haut risque, anamnèse de thrombose de stent, résistance au clopidogrel.
Contre-indications : malades âgés (> 75 ans) ou de petite taille (< 60 kg), anamnèse d’AVC, risque hémorragique élevé, anatomie coronarienne inconnue, éventualité de revascularisation chirurgicale, association à un anticoagulant, traitement médical sans PCI.
|
© CHASSOT PG, DELABAYS A, SPAHN D Mars 2010, dernière mise à jour Novembre 2019
Références
- ANGIOLILLO DJ, ROLLINI F, STOREY RF, et al. International expert consensus on switching platelet P2Y12 receptor-inhibiting therapies. Circulation 2017 ; 136 :1955-75
- BARASH P, AKHTAR S. Coronary stents : factors contributing to perioperative major adverse cardiovascular events. Br J Anaesth 2010 ; 105 (S1) : i3-i15
- BONHOMME F, FONTANA P, RENY JL. How to manage prasugrel and ticagrelor in daily practice. Eur J Intern Med 2014; 25:213-20
- DESAI NR, BHATT DL. The state of periprocedural antiplatelet therapy after recent trials. J Am Coll Cardiol Intv 2010 ; 3 :571-83
- GURBEL PA, ERLINGE D, OHMAN EM, et al. Platelet function during extended prasugrel and clopidogrel therapy for patients with ACS treated without revascularization. JAMA 2012; 308:1785-94
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105:743-9
- MEGA JL, CLOSE SL, WIVIOTT SD, et al. Genetic variants in ABCB1, CYP2C19, and cardiovascular outcomes following treatment with clopidogrel and prasugrel. Lancet 2010; 376:1312-9
- MONTALESCOT G, BOLOGNESE L, DUDEK D, et al. Pretreatment with prasugrel in non-ST segment elevation acute coronary syndromes. N Engl J Med 2013; 369:999-1010
- MURPHY SA, ANTMAN EM, WIWIOTT SD, et al. Reduction in recurrent cardiovascular events with prasugrel compared with clopidogrel in patients with acute coronary syndromes from the TRITON-TIMI 38 trial. Eur Heart J 2008; 29:2473-9
- PRICE MJ, WALDER JS, BAKER BA, et al. Recovery of platelet function after discontinuation of prasugrel or clopidogrel maintenance dosing in aspirin-treated patients with stable coronary disease. J Am Coll Cardiol 2012; 59:2338-43
- ROE MR, ARMSTRONG PW, FOX KA, et al. Prasugrel versus clopidogrel for ACS patients managed without revascularization. N Engl J Med 2012; 367: 1297-309
- SCHÜPKE S, NEUMANN FJ, MENICHELLI M, et al. Ticagrelor or prasugrel in acute coronary syndrome. N Engl J Med 2019; 381:1524-34
- SHARMA AK. Oral antiplatelet therapy in PCI patients. Catheter Cardiovasc Interv 2010; 75:S7-14
- TESTA L, BHINDI R, VAN GAAL WJ, et al. What is the risk of intensifying platelet inhibition beyond clopidogrel ? A systematic review and a critical appraisal of the role of prasugrel. Q J Med 2010; 103:367-77
- UDELL JA, BRAUNWALD E, ANTMAN EM, et al. Prasugrel versus clopidogrel in patients with ST-segment elevation myocardial infarction according to timing of percutaneous coronary intervention: a TRITON-TIMI 38 subgroup analysis. JACC Cardiovasc Interv 2014; 7:604-12
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Hesrt J 2018; 39:213-54
- WIVIOTT SD, ANTMAN EM, BRAUNWALD E. Prasugrel. Circulation 2010; 122:394-403
- WIVIOTT SD, BRAUNWALD E, ANGIOLILLO DJ, et al. Greater clinical benefit of more intensive oral antiplatelet therapy with prasugrel in patients with diabetes mellitus in the trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel – thrombolysis in myocardial infarction 38. Circulation 2008; 118: 1626-36
- WIVIOTT SD, BRAUNWALD E, MCCABE CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357:2001-15
- WIVIOTT SD, NESAI N, MURPHY SA, et al. Efficacy and safety of intensive antiplatelet therapy with prasugrel from TRITON-TIMI 38 in a core clinical cohort defined by worldwide regulatory agencies. Am J Cardiol 2011; 108:905-11
