Sténose sous-valvulaire aortique
Une obstruction de la chambre de chasse est une composante fréquente des cardiopathies congénitales complexes. La sténose de la CCVG peut être de trois types.
- Sténose mécanique par une membrane fibro-musculaire plus ou moins circulaire qui obstrue la CCVG entre le septum interventriculaire et la base du feuillet antérieur de la valve mitrale (voir Figure 26.104) (Vidéo).
- Hypoplasie de la CCVG qui est longue, tunnélisée et accompagnée d’une hypertrophie septale.
- Sténose dynamique, analogue à celle de la cardiomyopathie obstructive (CMO) ; la chambre de chasse est hypertrophie et rétrécie, la Vmax y est > 2.5 m/s, le pic de vélocité est télésystolique.
Vidéo: sténose sous-valvulaire aortique se présentant comme un bourrelet protubérant dans la CCVG depuis le septum.
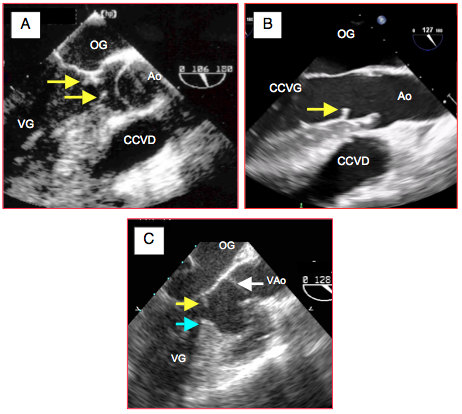
Figure 26.104 : Sténose membranaire sous-aortique. A: une membrane (flèches) circulaire rétrécit la chambre de chasse en amont de la valve aortique ; elle est fixée au septum interventriculaire, au feuillet antérieur de la mitrale et à la paroi postérieure du VG. L'orifice au centre de la membrane correspond à une sténose serrée. La valve aortique est bicuspide, avec un prolapsus dans la chambre de chasse. B: membrane partielle n'obstruant pas la CCVG; la valve aortique est normale. CCVD : chambre de chasse droite. C: sténose mixte membraneuse au niveau mitral (flèche jaune) et musculaire au niveau septal (flèche bleue).
Dans les deux premiers cas, la sténose est mécanique et le pic de vélocité protosystolique. Dans ces sténoses mécaniques, le gradient moyen est bien corrélé au degré d’obstruction, alors que dans les sténoses dynamiques c’est le gradient maximal qui a la meilleur corrélation avec le degré de sténose [18]. Le gradient de pression est artificiellement diminué en cas de bas débit cardiaque, d’hypovolémie ou de canal artériel ; il sous-estime la sténose dans ces contextes. Le flux tourbillonnaire systolique est situé en dessous la valve aortique (Vidéo); située distalement à la membrane, celle-ci est hypoplasique et incompétente dans > 50% des cas, car la sténose réduit le flux dès la naissance et le jet post-sténotique traumatise les cuspides [20]. A noter que la présence de turbulences dans la CCVG peut avoir 3 origines : une insuffisance aortique (jet diastolique), une CMO ou une membrane sous-aortique (turbulences systoliques).
Vidéo: flux Doppler couleur dans un cas de sténose sous-aortique; en systole, le flux tourbillonnaire accéléré est présent en amont de la valve aortique.
Vidéo: flux Doppler couleur dans un cas de sténose sous-aortique; en systole, le flux tourbillonnaire accéléré est présent en amont de la valve aortique.
Après correction chirurgicale de la CCVG (résection de la membrane et/ou myectomie), l’examen ETO différencie 4 complications différentes.
- La CIV iatrogène due à une résection excessive dans le corps du septum interventriculaire;
- L’insuffisance mitrale ou aortique par rétraction ou lésion directe d’un feuillet;
- La sténose résiduelle due à une résection insuffisance;
- La sténose dynamique liée à la combinaison de baisse de postcharge, d’hypovolémie et de stimulation β.
L’ETO a un impact thérapeutique élevé dans ces circonstances : dans 12 – 20% des cas, une révision chirurgicale immédiate s’impose sur la foi de l’écho post-CEC [12,19]. La précision du gradient de pression dans la CCVG est supérieure à celle de la même mesure faite dans la CCVD (surestimation dans 13% des cas) [12].
Sténose sus-valvulaire aortique
Une sténose peut survenir au-delà de la valve, le plus souvent au niveau de la jonction sino-tubulaire, sous la forme d’un diaphragme fibreux, d’un rétrécissement en sablier ou d’une sténose tubulaire diffuse de l’aorte ascendante. Dans les sténoses étagées ou très longues, l’écho Doppler tend à surestimer le gradient réel, parce que la simplification de l'équation de Bernoulli utilisée en clinique néglige plusieurs facteurs, dont celui lié à l’accélération locale qui est significatif pour les longues sténoses. Une insuffisance aortique est présente dans 25% des cas [2].
| Sténose aortique non-valvulaire |
|
Sténose sous-aortique dynamique (effet cardiomyopathie obstructive), Vmax CCVG > 2.5 m/s
- Péjorée par hypovolémie, stimulation β, vasoplégie
Sténose sous-aortique statique:
- Membrane sous-aortique (± hypoplasie de la valve aortique)
- Tunnélisation de la CCVG
Flux tourbillonnaire sous-aortique
- Systole: sténose dynamique ou membrane
- Diastole: insuffisance aortique
Sténose sus-aortique
- Membrane ou rétrécissement allongé
|
Bicuspidie aortique
La bicuspidie aortique est la malformation congénitale la plus fréquente de l'adulte (prévalence 1-2%), mais elle est rarement symptomatique chez l’enfant [23]. Dans 20% des cas, elle est associée à la coarctation, à l'anévrysme de l’aorte et plus rarement à la CIV périmembraneuse (voir Chapitre 26, Bicuspidie aortique) [9]. Au sens anatomo-pathologique du terme, il existe plusieurs variations anatomiques de la bicuspidie. L'ancienne répartition consistait en deux catégories: bicuspidie vraie (2 commissures et 2 cuspides, absence de raphé) et bicuspidie acquise (3 commissures, 3 cuspides dont 2 fusionnées par un raphé). Depuis une dizaine d'années, on recourt de préférence à la classification de Sievers qui est basée sur le nombre et la position des raphés (fusion entre deux cuspides) (voir Figure 26.119) [11,16].
- Type 0: présence de 2 commissures et de 2 cuspides grossièrement égales, absence de raphé; ce type correspond à l'ancienne bicuspidie "vraie". Il représente 7% des cas. Les deux feuillets sont dans une orientation droite – gauche (2/3 des cas) ou antéro-postérieure (1/3 des cas). En systole, l'ouverture est ovale, mais les feuillets ne rejoignent pas la paroi du sinus de Valsalva. En diastole, le prolapsus d'un feuillet est fréquent.
- Type 1: présence de 3 commissures mais de 2 cuspides fonctionnelles, car deux d'entre elles sont fusionnées par un raphé (88% des cas). Le bord libre du double feuillet fusionné excède celui du feuillet unique et tend à prolaber. Il existe trois variantes de ce type, aussi appelé bicuspidie "acquise" parce qu'il existe embryologiquement 3 commissures.
- Fusion des cuspides droite et gauche; l'ouverture a lieu entre la cuspide non-coronaire et le bloc des deux cuspides coronariennes fusionnées par un raphé. C'est le cas le plus fréquent (71% des bicuspidies). L'arrangement des commissures fait que le feuillet fusionné occupe 210-240° de la circonférence et le feuillet non-coronaire 120-150°.
- Fusion entre la cuspide droite et la cuspide non-coronaire (15% des cas).
- Fusion entre la cuspide gauche et la cuspide non-coronaire (3% des cas).
- Type 2: fusion entre la cuspide gauche et la cuspide droite, avec fusion entre celle-ci et la cuspide non-coronaire; il existe 2 raphés. C'est le type le plus rare (5% des cas). L'ouverture n'est possible qu'entre les cupsides gauche et non-coronaire par un orifice très restrictif qui occasionne une symptomatologie de sténose très précocément.
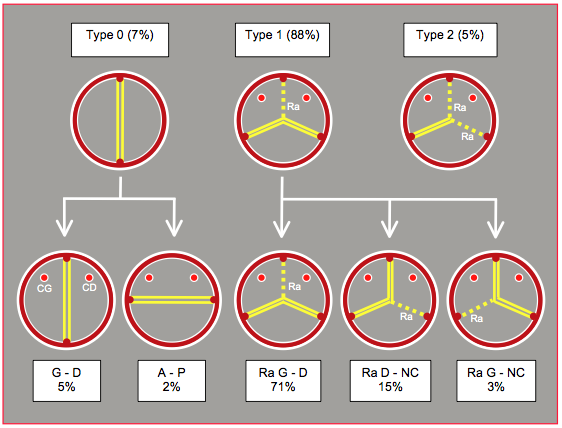
Figure 26.119 : Classification de Sievers des bicuspidies avec leur prévalence. Cette classification est basée sur le nombre de raphés (en traitillé). Ra : raphé. CG : coronaire gauche. CD : coronaire droite [6].
En vue court-axe 40°, l'ouverture est en forme de fente, d'ellipse ou de banane selon la configuration (voir Figure 26.120). Dans le type 0, on ne compte que deux commissures, approximativement à 180° l'une de l'autre (Vidéo). Selon leur position, on parle de cuspide antérieure, postérieure, droite ou gauche. Comme le diamètre n’est pas égal à la moitié de la circonférence, le bord libre des deux cuspides ne peut pas rejoindre sa position normale en systole et reste tendu à mi-chemin entre la position fermée et la paroi des sinus de Valsalva. En long axe, ce phénomène donne un aspect typique en dôme (doming), avec une distance entre l’extrémité des feuillets < 1.5 cm (voir Figure 26.122). Dans le type I par contre, on aperçoit clairement trois commissures; la fusion de deux cuspides laisse une ouverture déformée entre la cuspide libre et les deux cuspides fusionnées (Vidéos). En systole, le bord libre des cuspides vibre dans le flux, ce qui génère un souffle systolique. Ce stress est à l’origine de la dégénérescence de la valve qui évolue vers la sténose ou l’insuffisance, en général à partir de 30-40 ans. En diastole, le corps d’un feuillet est typiquement plus ballonné que celui de l’autre.
Vidéo: bicuspidie de type 0, avec deux commissures et deux valvules orientées antéro-postérieurement.
Vidéo: bicuspidie de type 1 avec trois commissures et deux valvules par fusion des valvules coronaires droite et gauche.
Vidéo: recontruction 3 D vue depuis l'aorte d'une bicuspidie de type 1.
Vidéo: bicuspidie de type 1 calcifiée.
Vidéo: bicuspidie de type 0, avec deux commissures et deux valvules orientées antéro-postérieurement.
Vidéo: bicuspidie de type 1 avec trois commissures et deux valvules par fusion des valvules coronaires droite et gauche.
Vidéo: recontruction 3 D vue depuis l'aorte d'une bicuspidie de type 1.
Vidéo: bicuspidie de type 1 calcifiée.
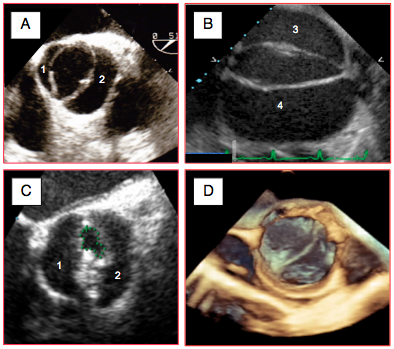
Figure 26.120 : Bicuspidie aortique en vue court axe. A : bicuspidie de type 0 avec une cuspide droite (1) et une cuspide gauche (2). B: bicuspidie de type 0 avec une cuspide postérieure (3) et une cuspide antérieure (4); la valve est grande et l'anneau dilaté (dilatation de la racine aortique dans un syndrome de Marfan). C : planimétrie d’une bicuspidie sténosée ; la surface d’ouverture est 0.5 cm2. D: bicuspidie en mode 3D.
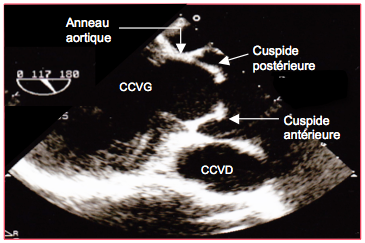
Figure 26.122 : Bicuspidie aortique en vue long axe. Le bord libre des cuspides est trop court pour leur permettre de rejoindre leur position physiologique en systole ; elles sont retenues en position intermédiaire, ce qui donne un aspect en dôme (doming).
Il est possible de rencontrer des cas d’unicuspidie; l’orifice est en général décentré et la valve en forme d’entonnoir (Vidéo); elle souffre de sténose et d’insuffisance. Dans la quadricuspidie, la présence de quatre cuspides donne une image de commissure en croix (voir Figure 26.123).
Vidéo: monocuspidie aortique en vue court-axe transthoracique.
Vidéo: monocuspidie aortique en vue court-axe transthoracique.
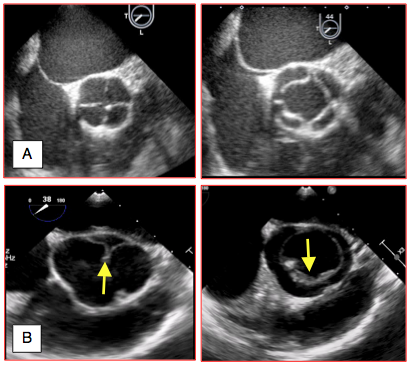
Figure 26.123 : Quadricuspidie et monocuspidie. A: quadricuspidie; la valve, vue en court-axe, présente quatre cuspides, bien visibles en diastole et en systole. B: monocuspidie; un seul feuillet assure la fermeture en diastole (à gauche) et l'ouverture en systole (à droite). L'anneau aortique est ovale.
| Bicuspidie aortique |
|
La bicuspidie est fréquente. Elle peut évoluer vers la sténose (75% des cas) ou l'insuffisance (25% des cas). Elle présente 3 types anatomiques:
- Type 0: 2 cuspides et 2 commissures, approximativement égales, de symétrie D-G ou A-P
- Type 1: présence d'un raphé fusionnant 2 cuspides et laissant la 3ème libre; la fusion entre les
cuspides coronaire droite et coronairre gauche est le cas le plus fréquent
- Type 2: présence de 2 raphés, une seule cuspide assure l'ouverture et la fermeture de la valve
Association avec coarctation, anévrysme de l’aorte et CIV membraneuse
Vue court-axe 40°: 2 feuillets, ouverture oblique
Vue long-axe 120°: ouverture partielle en dôme (doming)
Evolution vers sténose ou insuffisance
|
Remplacer la valve aortique par une prothèse ne pose aucun problème chez l’adulte, mais les lésions congénitales sont souvent symptomatiques chez l’enfant. Afin d’éviter de réintervenir pour changer de prothèse au fur et à mesure de la croissance, on procède à une plastie (voir Figure 11.60) ou à une opération de Ross (voir Figure 26.93), qui consiste à substituer la valve aortique du patient par sa propre valve pulmonaire; cette dernière suit la croissance physiologique jusqu’à une taille adulte. La voie droite est remplacée par une hétérogreffe ou une homogreffe que l’on peut surdimensionner et dilater ultérieurement par voie endovasculaire. Plusieurs mesures ETO sont capitales pour la réussite de l’opération [8].
- Congruence des anneaux aortique (vue long-axe 120°) et pulmonaire (vue admission – chasse VD 60° et long-axe 90°) ; la différence ne doit pas excéder 15%.
- Tricuspidie pulmonaire (vue court-axe 140°); une bicuspidie pulmonaire, qui accompagne parfois la bicuspidie aortique, peut donner des résultats désastreux lors de la transposition en position aortique.
- Bonne coaptation des cuspides pulmonaires (vue long-axe 90°); absence d’insuffisance pulmonaire.
- Gradient de la valve pulmonaire (< 5 mmHg) en vue long-axe de l’AP (0° court-axe de l’aorte ascendante, 90° court-axe de la crosse aortique) ou de la CCVD (30-60° transgastrique).
- Epaisseur du septum interventriculaire au niveau de la CCVD (vue long-axe 90°), indiquant à l’opérateur la profondeur à laquelle il peut exciser le manchon de chambre de chasse qu’il doit prélever avec l’anneau pulmonaire.
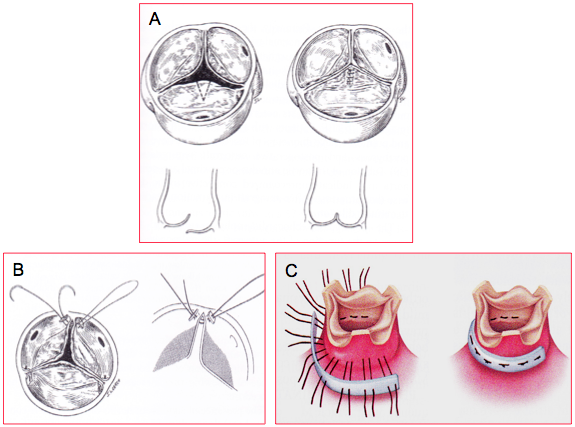
Figure 11.60 : Plastie aortique. A : résection triangulaire d’un prolapsus uni-cuspidien et suture de la cuspide. B : resuspension d’une commissure. C : annuloplastie aortique [Braunwald’s Heart Disease, 7th ed, Philadelphia:Elsevier 2005, 1601].
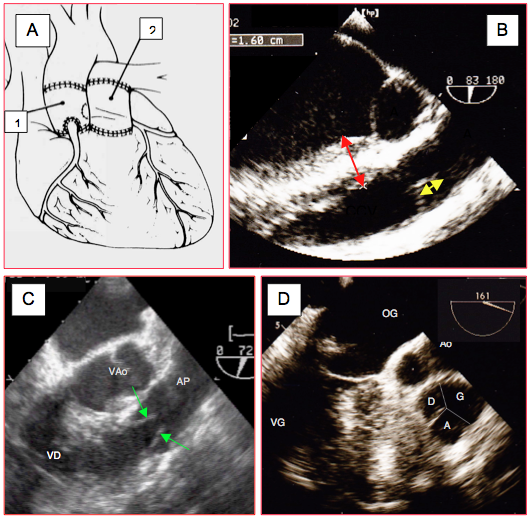
Figure 26.93 : Opération de Ross. Après excision de la valve aortique, la valve pulmonaire du patient est prélevée avec un manchon de chambre de chasse droite ; elle est transplantée en position aortique (autogreffe) et les coronaires y sont réimplantées. La valve pulmonaire est remplacée par une homogreffe ou une hétérogreffe. A : illustration de l’opération. 1 : autogreffe et néovalve aortique. 2 : homogreffe pulmonaire. B : hauteur de coaptation satisfaisante de la valve pulmonaire (flèche jaune). Le prélèvement du manchon de chambre de chasse droite implique de disséquer longitudinalement le septum interventriculaire ; l’examen pré-CEC doit en mesurer l’épaisseur en dessous de la valve pulmonaire (flèche rouge, 1.6 cm). C: examen de la mobilité des cuspides pulmonaires en long axe (70°). D: examen de la valve pulmonaire en court-axe (160°); en l'occurrence, la valve est tricuspide (l'apparente inégalité des cuspides est un effet de coupe).
Il est prudent de répéter toutes ces mesures sur plusieurs cycles cardiaques pour en augmenter la précision. Après une opération de Ross, plusieurs éléments sont à contrôler.
- Coaptation de la néovalve aortique (valve pulmonaire) en aval du plan de l’anneau aortique; un basculement ou un prolapsus dans la CCVG en diastole oblique à une reprise immédiate.
- Hauteur de coaptation des cuspides > 5 mm.
- Etanchéité de la néovalve aortique ; seule une IA minime (< degré I) est acceptable.
- Gradient de pression dans l’homo- ou l’hétérogreffe pulmonaire < 20 mmHg.
- Bonne contractilité de la partie basale du septum interventriculaire; absence de CIV au niveau des chambres de chasse.
- Cinétique segmentaire normale de toute la masse ventriculaire (réimplantation des coronaires).
| Contrôle après plastie aortique |
|
Critères de réussite d'une plastie en sortant de CEC:
- Absence de prolapsus résiduel en diastole
- Coaptation en aval (au-dessus) du plan de l’anneau aortique
- IA résiduelle < mineure
- Hauteur de coaptation > 5 mm
- Hauteur des cuspides > 8 mm
Sténose pulmonaire |
Un certain degré de sténose pulmonaire est associé à de nombreuses formes de cardiopathies congénitales; il est présent dans environ 10% d'entre elles, mais peut aussi exister de manière isolée et se manifester à l’âge adulte par une hypertrophie ventriculaire droite, puis une défaillance du VD. Une sténose valvulaire pulmonaire mineure présente un gradient de < 30 mmHg, une sténose modérée un ΔP de 30-60 mmHg (Vmax 2.5 – 3.8 m/s) et une sténose serrée (S ≤ 0.5 cm2) un ΔP > 64 mmHg (Vmax ≥ 4 m/s) [2]. La valve apparaît épaissie, peu mobile, parfois calcifiée en vue admission-chasse du VD (60°) et en vue long-axe de la valve aortique (120-140°) ; elle peut être tri-, bi- ou mono-cuspide. Elle a une déformation en dôme (doming) en systole et peut prolaber en diastole avec la même image de dôme, mais inversée. Un certain degré d’insuffisance valvulaire et de dilatation de l'AP est en général présent [14]. La surcharge de pression occasionne une hypertrophie concentrique du VD, avec un septum interventriculaire rectiligne ou basculé dans le VG en systol (Figure 27.188). L’indication opératoire est posée lorsque le gradient maximal est ≥ 50 mmHg et le gradient moyen ≥ 30 mmHg [3,17].
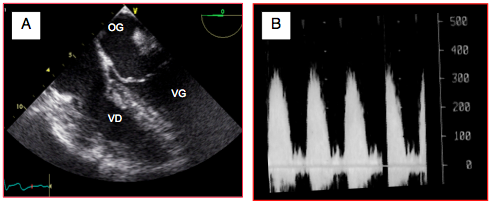
Figure 27.188 : Sténose pulmonaire. A : hypertrophie concentrique majeure du VD. B : flux Doppler spectral; la Vmax est de 3,75 m/s et le gradient de pression de 55 mmHg, ce qui représente une sténose modérée-à-sévère.
La fonction droite reste adéquate tant que la pression intraventriculaire est < 50% de la pression gauche; les patients deviennent symptomatiques lorsque la pression du VD dépasse la moitié de la pression systémique ou lorsqu’une surcharge volémique est associée (IT, shunt) [20]. Bien qu'hypertrophié (épaisseur de la paroi libre > 6 mm), le VD ne jouit pas forcément d'une fonction normale (Vidéo). La fraction d'éjection est un repère peu fiable vu la forme complexe et le remaniement structurel du ventricule. D'autres indices sont plus pertinents, comme l'indice de Tei, la vélocité S' du déplacement de l'anneau tricuspidien, la déformation longitudinale globale (strain) ou l'accélération de la phase isovolumétrique [13,15].
Vidéo: hypertrophie concentrique du VD due à la surcharge de pression dans une sténose pulmonaire.
Vidéo: hypertrophie concentrique du VD due à la surcharge de pression dans une sténose pulmonaire.
La sténose peut également se localiser au niveau de la chambre de chasse (CCVD), où elle est essentiellement musculaire et dynamique, ou au niveau de l’artère pulmonaire, où le vaisseau est hypoplasique sur une longueur variable. L’écho Doppler tend à surestimer le gradient en cas de sténoses étagées ou lorsque la sténose est tubulaire. La mesure de la pression systolique du VD (Psyst) par la Vmax de l’IT permet de calculer la pression artérielle pulmonaire en systole (PAPs) par soustraction du gradient transpulmonaire (ΔP) : PAPs = PsystVD - ΔP.
Transposition des gros vaisseaux (TGV)
La TGV est une discordance complète de la jonction ventriculo-artérielle: l'aorte sort du ventricule anatomiquement droit, qui fonctionne donc comme ventricule systémique; l'artère pulmonaire est issue du ventricule morphologiquement gauche. Dans une dextro-TGV (D-TGV) les deux vaisseaux sont parallèles, l’aorte est antérieure et l’artère pulmonaire est postérieure. La lévo-TGV (ou L-TGV) est accompagnée d'une discordance des ventricules; l'aorte et l'AP sont parallèles mais côte-à-côte sur le plan frontal (voir TGV naturellement corrigée) [10]. L'artère pulmonaire est issue de la chambre de chasse morphologiquement gauche ; il existe une continuité fibreuse entre le feuillet mitral antérieur et la valve pulmonaire. Le canal artériel ou une CIA assure un mélange des sangs veineux et artérialisés; une CIV, en général de type supracristal, est présente dans 30-40% des cas. Les anomalies coronariennes sont fréquentes et compliquent la reconstruction chirurgicale. A l’ETO, l’aorte et l’AP apparaissent parallèles en vues longitudinales (90-120°) ; les valves aortiques et pulmonaires sont sur le même plan en vues transverses (0-40°), alors que normalement le long-axe de l’une est associé au court-axe de l’autre ; la valve aortique est antérieure et à droite de la valve pulmonaire (D-transposition) (Figure 27.189). L'ETO doit déterminer la présence, la taille et le type de CIA ou de CIV, ainsi que d'éventuels rétrécissement de la chambre de chasse droite ou gauche.
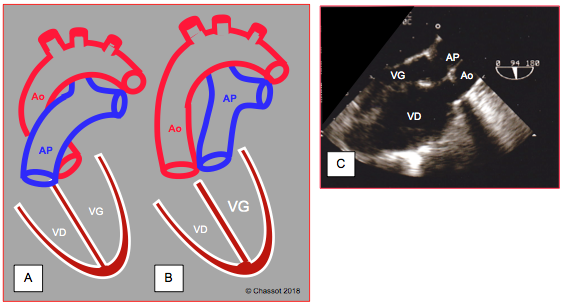
Figure 27.189 : Illustration schématique d'une transposition des gros vaisseaux (TGV). A : position normale de l'aorte et de l'artère pulmonaire. B : position des vaisseaux dans une D-TGV. C : vue long-axe de l’aorte et de l’AP qui apparaissent parallèles au lieu de se croiser à 45°. Le ventricule anatomiquement droit est hypertrophié puisqu’il fonctionne comme ventricule systémique (sous-aortique). L’aorte est antérieure par rapport à l’AP.
Les enfants porteurs d'une TGV ne survivent pas sans une intervention précoce, dont on retrouvera la morphologie et les séquelles à l’âge adulte.
- Opération de Rashkind: par cathétérisme, on déchire le septum interauriculaire pour créer ou agrandir la CIA; on procède à cette intervention dans les premières heures après la naissance.
- Opération de Mustard ou de Senning: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire et le sang artérialisé vers le ventricule sous-aortique (Figure 27.190). Malheureusement, le ventricule systémique reste le ventricule anatomiquement droit, ce qui ne permet pas une survie normale; il dysfonctionne vers 20-25 ans [7].
- Opération de Jatene (switch artériel): avant que le remodelage des ventricules ne soit significatif (< 2-3 semaines de vie), on croise les gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG; l’AP est positionnée antérieurement à l’aorte (manœuvre de Lecompte) ; les coronaires sont réimplantées dans la néo-aorte (ancienne AP) (Figure 27.191) ; cette reconstrucion présente un risque d’ischémie myocardique. Passée la mortalité périopératoire (3%), l'espérance de vie est quasi normale (97% à 20 ans) [24].
- Opération de Rastelli : lorsque la TGV est associée à une CIV et une obstruction de la CCVG, on peut fermer la CIV avec un patch orienté de manière à ce que le sang du VG soit dirigé vers l’aorte ; un conduit valvé est construit entre la VD et l’AP (Figure 27.192).
- Opération de Damus-Kaye-Stansel : l’AP proximale est anastomosée termino-latéralement à l’aorte ascendante, et sa partie distale est suturée ; un conduit valvé est placé entre le VD et l’AP distale ; la pression qui règne dans l’aorte maintient la valve aortique fermée (elle doit être compétente) (Figure 27.193).
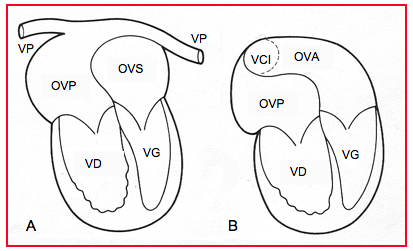
Figure 27.190 : Opération de Mustard pour TGV: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire (VG) et le sang artérialisé vers le ventricule sous-aortique (VD). Le ventricule systémique est le ventricule droit. A : les veines pulmonaires (VP) se drainent dans une oreillette veineuse postérieure (OVP) connectée au VD sous-aortique. B : la veine cave inférieure (VCI) se draine dans la partie basse d’une oreillette veineuse antérieure (OVA) connectée au VG sous-pulmonaire. La veine cave supérieure se draine de la même manière dans la partie haute de l’OVA [21].
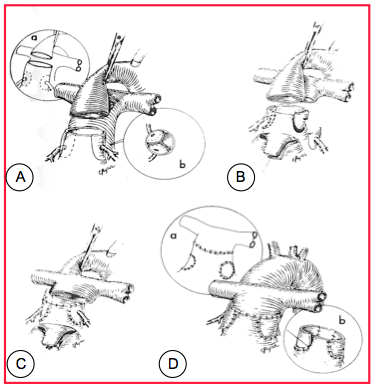
Figure 27.191 : Opération de Jatene (switch artériel): croisement des gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG. A : transsection de l’aorte et excision des coronaires. B : l’AP est excisée et les coronaires sont réimplantées dans la partie proximale de l’AP connectée au VG. C : l’AP est positionnée antérieurement à l’aorte (manœuvre de Lecompte) ; l’AP proximale est anastomosée à l’aorte distale. D : les sites de prélèvement des coronaires sont patchés et l’aorte proximale, connectée au VD, est anastomosée à l’AP distale. Cette reconstrucion présente un risque d’ischémie myocardique.
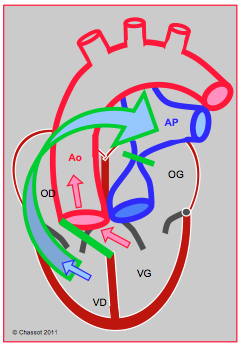
Figure 27.192 : Opération de Rastelli : lorsque la TGV est associée à une CIV et une obstruction de la CCVG, on peut fermer la CIV avec un patch (barre verte) orienté de manière à ce que le sang du VG soit dirigé vers l’aorte. L’AP proximale est ligaturée et un conduit valvé (flèche vert-bleu) est construit entre la VD et l’AP. Le sang veineux (flèche bleue) et le sang artériel (flèches rouges) sont séparés et dirigées respectivement vers le conduit-AP et l’aorte.
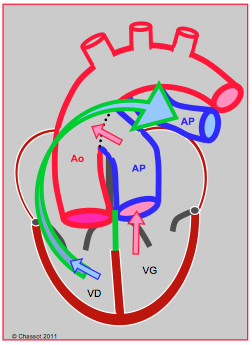
Figure 27.193 : Opération de Damus-Kaye-Stansel : l’AP proximale est anastomosée termino-latéralement à l’aorte ascendante, et la partie distale est suturée ; un conduit valvé est placé entre le VD et l’AP distale. Le sang veineux (flèche bleue) est séparé du sang artériel (flèches rouges). La pression qui règne dans l’aorte maintient la valve aortique fermée (elle doit être compétente).
Après les opérations de Mustard ou de Senning, l’image est complexe. En vue 4-cavités 0°, le patch interauriculaire sépare obliquement deux cavités, l’une antérieure (retour veineux systémique détourné vers la valve mitrale) et l’autre postérieure (retour veineux pulmonaire dirigé vers la valve tricuspide). L’injection de microbulles par voie veineuse permet de se repérer facilement. De plus, si le contraste injecté dans un bras entre dans le cœur par la VCI, on peut en conclure que la partie supérieure du patch est obstruée et que le flux en est détourné vers la VCI par des collatérales; à l’inverse, le contraste injecté dans une jambe apparaît par la VCS si la partie inférieure du patch est sténosante. Le flux veineux central est normalement biphasique et suit l’évolution de la pression auriculaire. En cas de sténose ou d’obstruction, l’allure biphasique est perdue, le flux devient constant et la Vmax augmente (> 1.0 m/s) ; il apparaît des turbulences au Doppler couleur. Une fuite dans le patch se traduit par un passage entre les deux cavités au Doppler couleur. Chez l’adulte, la dilatation et la dysfonction du ventricule anatomiquement droit sont habituelles ; elles s’accompagnent d’une insuffisance tricuspidienne. Le VG est alors comprimé par le VD. Une obstruction dynamique de la CCVG est fréquente, parce que le VG, naturellement musclé, est connecté à un réseau à basse pression.
Après les opérations de Rastelli et de Damus-Kaye, le conduit valvé est observable à l'ETO: son implantation proximale dans le VD est visible en vue admission-chasse du VD 60°, et son anastomose distale à l'AP est en général repérable en vue long axe 120° ou court axe 0° de l'aorte ascendante; sa Vmax devrait voisiner 1-1.5 m/s. Les chambres de chasse droite et gauche doivent être évaluées à la recherche de sténose en vues mi-œsophage et transgastriques.
Le switch artériel est actuellement l’intervention de premier choix. La reconstruction étant anatomique, le cœur a une silhouette et une fonction normales, pour autant que l’opération ait eu lieu assez tôt pour empêcher une involution irréversible du VG connecté au système à basse pression de l’AP. A l’échocardiographie, la morphologie cardiaque est voisine de la norme mais les ostia coronariens sont en général plus distaux et situés à 2 heures et à 10 heures dans une vue à 0° [10]. Les séquelles possibles sont une obstruction de la CCVD (problème le plus fréquent) ou de la CCVG, un shunt résiduel, une fuite de la valve néo-aortique, et une dysfonction du VG.
| Transposition des gros vaisseaux (TGV) |
|
Discordance ventriculo-artérielle
- VD connecté à l’aorte (antérieure)
- VG connecté à l’artère pulmonaire
CIA, canal artériel ou CIV pour le mélange des circulations
Vue long-axe 90-120°: aorte et AP parallèles, aorte antérieure
Vue court-axe 0-40°: valves aortique et pulmonaire sur le même plan
|
Transposition naturellement corrigée
Si une discordance auriculo-ventriculaire se rajoute à la discordance ventriculo-artérielle, la survie devient possible, car les circulations systémique et pulmonaire sont de nouveau en continuité. C'est le cas de la transposition naturellement corrigée des gros vaisseaux. Dans cette anomalie, l'AP et l'aorte sont transposées comme dans la TGV, mais les ventricules sont également inversés (Vidéos et Figure 27.194). L’aorte se trouve à la gauche de l’AP (L-TGV), le ventricule anatomiquement droit est à gauche et le VG est à droite. La valve mitrale et la valve pulmonaire sont reliées par une continuité fibreuse. Le système coronarien est inversé, la CD se trouvant à gauche et le tronc commun à droite. Une CIV périmembraneuse est fréquente ; il se peut que la valve tricuspide, souvent insuffisante, soit déplacée vers l’apex comme dans une maladie d’Ebstein [1]. Une obstruction dynamique de la chambre de chasse sous-pulmonaire n’est pas rare à cause de sa position oblique liée au malalignement du septum. De fait, le sang suit une séquence physiologique à travers des cavités croisées: OD → VG → AP → poumons → OG → VD→ Ao. Ces malades ne sont pas cyanosés, mais le ventricule anatomiquement droit se retrouve en position sous-aortique, donc fonctionnant comme ventricule systémique. Il se dilate, développe une insuffisance tricuspidienne sévère, et devient insuffisant vers 20-30 ans [5,6]. C'est souvent à ce moment-là que le diagnostic est posé.
Vidéo: vue 4-cavités d'une transposition des gros vaisseaux naturellement corrigée; le VD est à gauche, avec une valve tricuspide insérée en-dessous de la mitrale sur le septum et un muscle papillaire septal (voir Figure 27.195).
Vidéo: vue 4-cavités d'une transposition des gros vaisseaux naturellement corrigée; le VD est à gauche, avec une valve tricuspide insérée en-dessous de la mitrale sur le septum et le VG à droite, avec une valve mitrale insérée plus proximalement.
Vidéo: vue long-axe dans le même cas que précédemment. Le VD est situé postérieurement (sur la gauche de l'écran); on le reconnaît grâce à la présence d'un pilier septal et à l'insertion plus apicale de la valve tricuspide.
Vidéo: vue 4-cavités d'une transposition des gros vaisseaux naturellement corrigée; le VD est à gauche, avec une valve tricuspide insérée en-dessous de la mitrale sur le septum et un muscle papillaire septal (voir Figure 27.195).
Vidéo: vue 4-cavités d'une transposition des gros vaisseaux naturellement corrigée; le VD est à gauche, avec une valve tricuspide insérée en-dessous de la mitrale sur le septum et le VG à droite, avec une valve mitrale insérée plus proximalement.
Vidéo: vue long-axe dans le même cas que précédemment. Le VD est situé postérieurement (sur la gauche de l'écran); on le reconnaît grâce à la présence d'un pilier septal et à l'insertion plus apicale de la valve tricuspide.
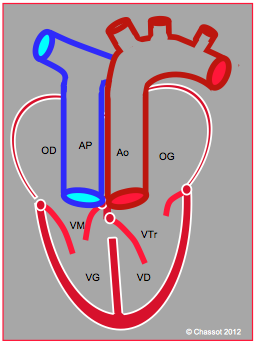
Figure 27.194 : Transposition des gros vaisseaux (TGV) naturellement corrigée. A la discordance ventriculo-artérielle (TGV) s’ajoute une discordance auriculo-ventriculaire. L’OD est connectée à une valve mitrale (VM) et à un ventricule anatomiquement gauche (VG), puis à l’AP. Le sang oxygéné revient à l’OG par les veines pulmonaires ; l’OG se draine à travers une valve tricuspide dans un ventricule anatomiquement droit, connecté à l’aorte. Le malade n’est pas cyanosé, mais son ventricule systémique est un ventricule droit, qui défaille après une vingtaine d'années [4].
A l’ETO, le diagnostic est posé parce que chaque ventricule se reconnaît à ses caractéristiques anatomiques, non à sa position (Figure 27.195). En vue 4-cavités, l’OD normale (recevant la VCI et la VCS), reconnaissable à son appendice auriculaire, est connectée à une valve à 2 feuillets insérée plus haut au niveau du septum que l’autre valve AV et à un ventricule finement trabéculé ne présentant que 2 muscles papillaires (ventricule anatomiquement gauche); une sténose de la CCVG est fréquente. L’OG, où s'abouchent les veines pulmonaires et un appendice auriculaire allongé, est connectée à une valve à 3 feuillets bas-insérée sur le septum et à un ventricule arrondi et fortement trabéculé qui présente 3 muscles papillaires, dont l’un inséré sur le septum (ventricule anatomiquement droit). Les gros vaisseaux sont transposées et parallèles comme dans la TGV. L'insuffisance tricuspidienne est habituelle.
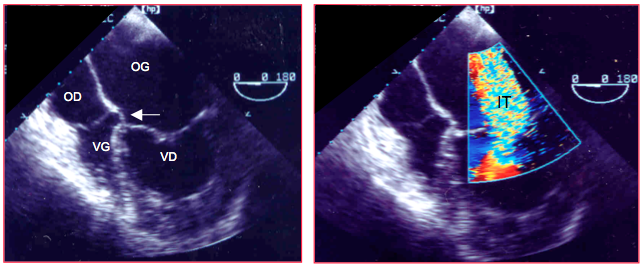
Figure 27.195 : TGV naturellement corrigée. La VCI se draine dans l’OD (situs solitus) connectée au VG, lui-même connecté à l’AP ; l’OG est connectée au VD, que l’on reconnaît à la bas-insertion de la tricuspide (flèche) ; le VD est en position sous-aortique. Le VD est hypertrophié, mais sa haute postcharge (pression systémique) a induit une insuffisance tricuspidienne massive (IT).
| Transposition naturellement corrigée |
|
Discordance auriculo-ventriculaire + discordance ventriculo-artérielle
Retour veineux systémique → OD → valve mitrale → VG → AP
Retour veineux pulmonaire → OG →valve tricuspide → VD → aorte
Oxygénation normale mais VD fonctionne comme ventricule systémique
|
Truncus arteriosus
Dans le syndrome du truncus arteriosus, un vaisseau commun surplombant une CIV donne naissance à l’aorte et à l’artère pulmonaire. Ce vaisseau possède une grande valve ventriculo-artérielle à 3 ou 4 feuillets, souvent dysplasique et insuffisante. Il existe 4 types de truncus, différenciés selon l'implantation de l'artère pulmonaire sur l'aorte distalement aux coronaires (voir Figure 14.70) [22].
- Type I : l’AP prend racine sur la face latérale gauche du vaisseau commun;
- Type II : les deux artères pulmonaires naissent séparément du truncus;
- Type III : il n’existe qu’une seule artère pulmonaire, le poumon controlatéral étant vascularisé par des collatérales ou des artères bronchiques;
- Type IV : l’AP est absente, et les poumons sont alimentés par des collatérales aorto-pulmonaires ; ce cas ressemble à une CIV avec atrésie pulmonaire.
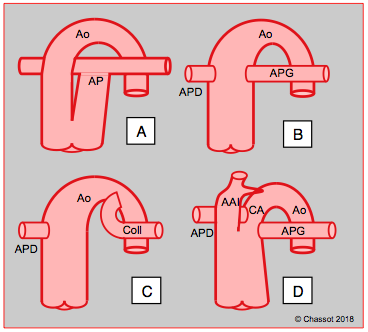
Figure 14.70 : Représentation schématique des différents types de truncus arteriosus. A : type I ; l’AP prend racine sur la face latérale gauche du vaisseau commun. B : type II ; les deux artères pulmonaires naissent séparément du truncus. C : type III ; il n’existe qu’une seule artère pulmonaire, l’autre est remplacée par une grande collatérale ou des artères bronchiques (Coll). D : type IV ; l’arc aortique est interrompu (AAI) après le tronc brachio-céphalique, la crosse et l’aorte descendante (Ao) font suite au canal artériel (CA) ; l’origine des AP est variable [22].
La large CIV assure une égalisation des pressions systémiques et pulmonaires et un mélange complet des sangs veineux et artérialisés, d'où une hypoxémie et une cyanose. Le rapport Qp:Qs dépend du rapport entre les RAP et les RAS (physiologie de ventricule unique). La malformation est rapidement symptomatique après la naissance, et se manifeste par une insuffisance ventriculaire congestive et une cyanose modérée. La circulation pulmonaire est surchargée et soumise à une pression systémique ; sans une restriction au flux (banding), des lésions vasculaires irréversibles se développent rapidement. L'échocardiographie montre bien qu'un seul tronc artériel est issu de la valve ventriculo-artérielle. Elle doit déterminer le type d'implantation de l'AP, le type de CIV et la morphologie de la valve ventriculo-artérielle (vues 4-cavités, court-axe et long-axe de la valve aortique). La démonstration de l'origine de l'AP sur le truncus est nécessaire pour différencier cette pathologie de l'atrésie pulmonaire avec CIV.
La correction chirurgicale consiste en un patch sur la CIV qui redirige le flux du VG vers l’aorte (en l’occurrence, le truncus) ; la valve néo-aortique est reconstruite ou remplacée si elle est insuffisante ; l’AP est déconnectée du tronc et anastomosée à un conduit valvé VD-AP.
| Truncus arteriosus |
| Un vaisseau commun surplombe une CIV et donne naissance à l’aorte et à l’artère pulmonaire. |
Anévrysme du sinus de Valsalva
L’anévrysme survient le plus souvent dans le sinus de Valsalva droit (69% des cas), plus rarement dans le sinus non-coronaire (26%) ou gauche (5%) (Vidéo et Figure 27.100). Une fuite aortique peut accompagner la dilatation de la racine aortique. La dilatation du sinus s'expand en diastole et se prolonge en doigt de gant en vue court-axe 40° et long-axe 120° de la racine aortique, souvent avec une zone anéchogène à son extrémité. Le flux couleur montre un tournoiement à l'intérieur du sinus. La malformation peut fistuliser dans la CCVD (anévrysme droit ou non-coronaire) ou dans la CCVG (anévrysme gauche). Le Doppler couleur montre alors un flux de haute vélocité systolo-diastolique entre la racine aortique et la chambre de chasse, l'OD ou l'OG. Elle occasionne un shunt G→D avec surcharge de volume du VD ou du VG, selon la cavité de réception. Un diagnostic différentiel est à faire avec l’anévrysme du septum membraneux, la fistule coronaire ou la fistule acquise (endocardite).
Vidéo: anévrysme du sinus de Valsalva droit en vue long-axe de la racine aortique.
Vidéo: anévrysme du sinus de Valsalva droit en vue long-axe de la racine aortique.
| Anévrysme du sinus de Valsalva |
| Le plus fréquent dans le sinus coronarien droit, déformé en doigt de gant. Peut fistuliser dans la CCVD ou la CCVG selon le sinus atteint. |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- ANDERSON R, Ho SH. Echocardiographic diagnosis and description of congenital heart disease: Anatomic principles and philosophy. In: ST JOHN SUTTON MG, ed. Textbook of echocardiography and Doppler in adults and children. Cambridge (MA): Blackwell Science, 1996, pp 711-43
- BAUMGARTNER H, BONHOEFFER B, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital heart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- CHASSOT PG, BETTEX D. Congenital heart disease. In: POELAERT J, SKATVAN K. Transesophageal echocardiography in anaesthesia and intensive care medicine, 2nd ed. London: BMJ Books, 2004, 221-47
- CONNELLY MS, ROBERTSON P, LIU P, et al. Congenitally corrected transposition of the great arteries in adults: Natural history. Circulation 1994; 90:I-51
- DOBSON R, DANTON M, NICOLA W, et al. The natural and un-natural history of the systemic right ventricle in adult survivors. J Thorac Cardiovasc Surg 2013; 145:1493-501
- GRAHAM TP. Ventricular performance in congenital heart disease. Circulation 1991; 84:2259-74
- LE POLAIN DE WAROUX JB, POULEUR AC, ROBERT A, et al. Mechanisms of recurrent aortic regurgitation after aortic valve repair. Predictive value of transesophageal echocardiography. JACC Cardiovasc Imaging 2009; 2:931-9
- MICHELENA HI, DELLA CORTE A, PRAKASH SK, et al. Bicuspid aortic valve aortopathy in adults: incidence, etiology and clinical significance. Int J Cardiol 2015; 201:400-7
- MILLER-HANCE WC, SILVERMAN NH. Transesophageal echocardiography (TEE) in congenital heart disease with focus on the adult. Cardiol. Clinics 2000; 18:861-92
- RIDLEY CH, VALLABHAJOSYULA P, BAVARIA JE; et al. The Sievers classifiction of the bicuspid aortic valve for the perioperative echocardiographer: the importance of valve phenotype for aortic valve repair in the era of the functional aortic annulus. J Cardiothorac Vasc Anesth 2016; 30:1142-51
- ROSENFELD HM, GENTLES TL, WERNKOVSKY G, et al. Utility of intraoperative echocardiography in the assessment of residual cardiac defects. Ped Cardiol 1998; 19:346-51
- RUDSKI LG, LAI WW, AFILALO J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: A report from the American Society of Echocardiography. J Am Soc Echocardiogr 2010; 23:685-713
- RUSSEL IA, ROUINE-RAPP K, STRATMANN G, MILLER-HANCE WC. Congenital heart disease in adult: A review with Internet-accessible transesophageal echocardiographic images. Anesth Analg 2006; 102:694-723
- SHEN T, PICARD MH, HUA L, et al. Assessment of tricuspid annular motion by speckle-tracking in anesthetized patients using transesophageal echocardiography. Anesth Analg 2018; 126:62-7
- SIEVERS HH, SCHMIDTKE C. A classification system for the bicuspid aortic valve from 304 surgical specimens. J Thorac Cardiovasc Surg 2007; 133:1228-33
- SILVERSIDES CK, KIESS M, BEAUCHESNE L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Outflow tract obstruction, coarctation of the aorta, tetralogy of Fallot, Ebstein anomaly and Marfan’s syndrome. Can J Cardiol 2010; 26:e80-e97
- SILVILAIRAT S, CABALKA AK, CETTA F, et al. Outpatient echocardiographic assessment of complex pulmonary outflow stenosis: Doppler mean gradient is superior to the maximum instantaneous gradient. J Am Soc Echocardiogr. 2005; 18:1143-8
- STEVENSON JG, SORENSEN GK, GARTMAN DM, et al. Left ventricular outflow tract obstruction: An indication for intraoperative transesophageal echocardiography. J Am Soc Echocardiogr 1993; 6:525-35
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- STÜMPER O, SUTHERLAND GR. Transesophageal echocardiography in congenital heart disease. London: Edward Arnold, 1994, 37-38
- VAN PRAAGH R, VAN PRAAGH S. The anatomy of common aortico-pulmonary trunk (truncus arteriosus communis) and its embryologic implications. A study of 57 necropsy cases. Am J Cardiol 1965; 16:406-25
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
- WILLIAMS WG, McCRINDLE BW, ASHBURN DA, et al. Outcomes of 829 neonates with complete transposition of the great arteries 12-17 years after repair. Eur J Cardiothorac Surg 2003; 24:1-9
