La tétralogie de Fallot (TdF) représente 5-10% des cardiopathies congénitales; elle est la plus fréquente des cardiopathies cyanogènes. Plus de 95% des enfants opérés atteignent l’âge adulte [5]. Son origine est une anomalie cono-truncale avec bascule antérieur-droit du septum conal et sous-développement de l'infundibulum droit. La bande pariétale embryonnaire est mal alignée et déviée, résultant en une obstruction de la chambre de chasse droite (CCVD) et en une large CIV sous-aortique [9,14]. La malformation associe quatre anomalies (Figure 14.56 et Figure 14.57).
- Une CIV sous-aortique (septum membraneux) (Vidéo);
- Une aorte à cheval sur les deux ventricules (la valve aortique est compétente chez les enfants) (Vidéo);
- Une sténose de la chambre de chasse droite et de la valve pulmonaire qui est restrictive, hypoplasique ou bicuspide, accompagnée d’un sous-développement plus ou moins important de l’artère pulmonaire et de ses branches (Vidéo);
- Une hypertrophie du VD.
Vidéo: CIV au niveau du septum membraneux sous-aortique, typique de la tétralogie de Fallot.
Vidéo: Vue long-axe de la grande valve aortique surplombant la CIV membraneuse dans une tétralogie de Fallot; le VD présente une hypertrophie concentrique majeure.
Vidéo: Vue long-axe de la chambre de chasse du VD, de la valve pulmonaire et de l'AP dans une tétralogie de Fallot; la CCVD présente une hypertrophie concentrique massive avec une lumière très étroite, la valve et le tronc de l'AP sont hypoplasiques.
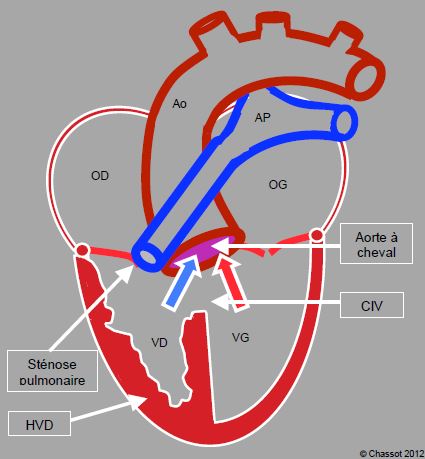
Figure 14.56 : Schéma de tétralogie de Fallot. La valve aortique est à cheval sur une large CIV. Le VD est hypertrophié, même si sa cavité n'est pas visible dans son plus grand diamètre dans ce plan de coupe. La valve et l'artère pulmonaire sont sténosées.
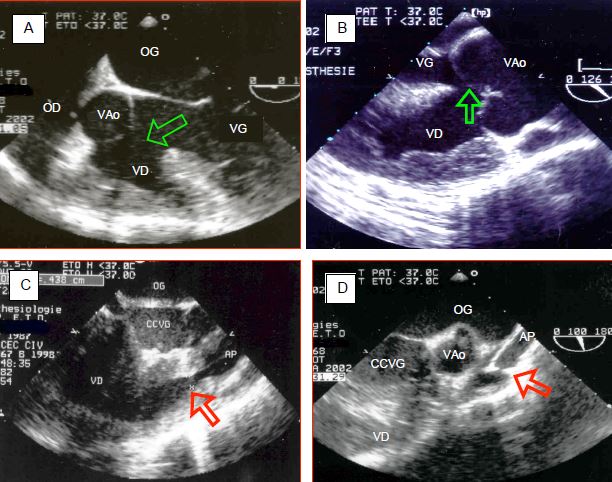
Figure 14.57 : Images échocardiographiques transoesophagiennes d’une tétralogie de Fallot. A: vue 5-cavités à 0° de l'aorte s'ouvrant à cheval sur les deux ventricules ; la flèche indique la CIV; la valve aortique reçoit du sang du VG et du VD; ce dernier est hypertrophié. B : vue long-axe à 120° de la racine aortique ; la valve surplombe la CIV (flèche) ; la paroi du VD mesure > 1.2 cm d’épaisseur et ses trabéculations sont hypertrophiées. C: sténose musculaire pulmonaire dans la chambre de chasse droite ; diamètre 0.44 cm (flèche) ; la valve et l’artère pulmonaires sont hypoplasique. D : atrésie de la valve pulmonaire, qui ne présente qu’un orifice minuscule (flèche) suivi d’une artère pulmonaire hypoplasique et tubulaire.
Il arrive qu'une CIA complète les lésions; on parle alors de pentalogie. Dans 10% des cas, une malformation coronarienne (artère circonflexe en provenance de la coronaire droite, par exemple) amène un vaisseau à croiser la face antérieure de la CCVD. Plusieurs autres malformations peuvent se trouver associées à la TdF : sténoses sur les troncs distaux de l’AP, CIV multiples, dextroposition de la crosse aortique, agénésie pulmonaire, MAPCA (major aorto-pulmonary collateral arteries) (voir plus loin). Il existe tout un éventail de lésions voisines de celles de la tétralogie. On rencontre un certain degré de sténose pulmonaire chez 10% de tous les congénitaux. Leur anatomie est voisine de celle d'un Fallot, mais sans CIV ni déplacement de l'aorte; ils ne sont pas cyanosés au repos. On parle parfois de Fallot rose pour les cas de tétralogie dont la sténose pulmonaire est modeste, ce qui leur assure une oxygénation normale et un Qp/Qs voisin de 1/1. A l’autre bout du spectre, l’atrésie pulmonaire complète induit une cyanose profonde.
Alors que la sténose de la valve pulmonaire est fixe parce que due à une hypoplasie, la sténose de la CCVD est de nature dynamique, puisque cette partie est entièrement musculaire. Toute augmentation de la contractilité ou baisse de la précharge en diminue le diamètre, accentue la sténose et freine le flux pulmonaire; la stimulation sympathique aggrave la cyanose, raison pour laquelle ces enfants sont souvent β-bloqués. Ce spasme infundibulaire donne lieu à des crises cyanotiques (blue spell) accompagnées d'hyperventilation qui réclament un traitement immédiat [10].
- Oxygène: FiO2 1.0;
- Position accroupie (squatting), compression des artères fémorales (augmentation des RAS), phényléphrine (5-10 mcg/kg);
- Morphine (0.05-1.0 mg/kg);
- Administration liquidienne;
- Esmolol (0.5 mg/kg).
Le développement spontané de collatérales aorto-pulmonaires au cours de la croissance permet à certains enfants porteurs de TdF de se développer normalement grâce à un flux pulmonaire fournit par ces shunts G-D (Figure 14.58) (Vidéo 427-8 Fallot Collat).
Mais cet équilibre est délicat, car le débit pulmonaire dépend du débit systémique : il augmente si les RAS s’élève, mais diminue en cas d’hypotension. Si les collatérales sont de faible importance, la PAP reste basse et l’enfant est cyanosé au moindre effort; si au contraire elles sont importantes, l’enfant risque de développer une hypertension pulmonaire. D'autre part, les collatérales imposent une surcharge de volume au VG qui doit fournir à la fois le débit systémique et le débit pulmonaire.
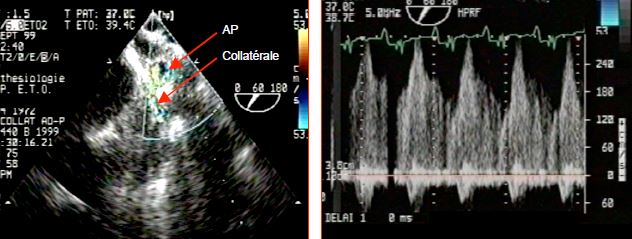
Figure 14.58 : Flux collatéral dans une tétralogie de Fallot. Le flux est visible entre une grosse collatérale issue de l'aorte descendante et une branche de l'artère pulmonaire (AP). Le flux est continu systolo-diastolique, puisque la pression systémique est constamment plus élevée que la pression pulmonaire. La PA diastolique est basse parce que les vaisseaux débitent en continu dans le lit pulmonaire à basse pression ; elle remonte s’il s’installe une hypertension pulmonaire. En nombre suffisant, ces collatérales peuvent assurer un débit pulmonaire normal au repos.
Les enfants souffrant de TdF sont cyanosés parce que l'aorte reçoit un mélange de sang veineux du VD et de sang artérialisé du VG, et parce que le débit pulmonaire est insuffisant. Le débit et la pression pulmonaires sont bas à cause de la sténose pulmonaire, qui protège les poumons d'une hypertension. Si les résistances vasculaires systémiques (RAS) augmentent, le flux pulmonaire s’élève, le shunt D-G diminue et la cyanose se réduit. La SaO2 est un reflet direct du flux pulmonaire. Comme il est soumis à la pression systémique, le VD dysfonctionne progressivement.
Mais cet équilibre est délicat, car le débit pulmonaire dépend du débit systémique : il augmente si les RAS s’élève, mais diminue en cas d’hypotension. Si les collatérales sont de faible importance, la PAP reste basse et l’enfant est cyanosé au moindre effort; si au contraire elles sont importantes, l’enfant risque de développer une hypertension pulmonaire. D'autre part, les collatérales imposent une surcharge de volume au VG qui doit fournir à la fois le débit systémique et le débit pulmonaire.

Figure 14.58 : Flux collatéral dans une tétralogie de Fallot. Le flux est visible entre une grosse collatérale issue de l'aorte descendante et une branche de l'artère pulmonaire (AP). Le flux est continu systolo-diastolique, puisque la pression systémique est constamment plus élevée que la pression pulmonaire. La PA diastolique est basse parce que les vaisseaux débitent en continu dans le lit pulmonaire à basse pression ; elle remonte s’il s’installe une hypertension pulmonaire. En nombre suffisant, ces collatérales peuvent assurer un débit pulmonaire normal au repos.
Les enfants souffrant de TdF sont cyanosés parce que l'aorte reçoit un mélange de sang veineux du VD et de sang artérialisé du VG, et parce que le débit pulmonaire est insuffisant. Le débit et la pression pulmonaires sont bas à cause de la sténose pulmonaire, qui protège les poumons d'une hypertension. Si les résistances vasculaires systémiques (RAS) augmentent, le flux pulmonaire s’élève, le shunt D-G diminue et la cyanose se réduit. La SaO2 est un reflet direct du flux pulmonaire. Comme il est soumis à la pression systémique, le VD dysfonctionne progressivement.
Traitement chirurgical
Dans les années soixante-dix, il était habituel d'opérer les malades en deux temps. On procédait d'abord à un shunt G-D pour augmenter le flux pulmonaire: shunt de Blalock-Taussig (artère sous-clavière → artère pulmonaire droite ou gauche), shunt de Potts (aorte descendante → AP gauche) ou shunt de Waterston (aorte ascendante → AP droite). La taille du shunt réglait son débit. Cette première intervention néonatale était suivie d’une correction totale entre 5 et 10 ans. Malheureusement, cette stratégie maintenait une hypoxie et une surcharge de pression sur le VD pendant trop d'années; elle occasionnait aussi une déformation des artères pulmonaires et freinait leur développement normal.
Actuellement, on procède à une correction totale entre 1 et 10 mois, ce qui évite la chirurgie néonatale mais supprime la cyanose et l’HVD assez tôt, normalise le flux pulmonaire, et favorise la croissance de l'arbre vasculaire des poumons [4,11]. L'opération consiste à séparer les circulations systémique et pulmonaire et à lever l’obstacle sur la voie pulmonaire (Figure 14.59) [6].
- Patch de fermeture au niveau de la CIV ou fermeture directe avec réalignement de la chambre de chasse (voie trans-tricuspidienne par l'OD pour éviter une ventriculotomie);
- Elargissement de la chambre de chasse droite par résection infundibulaire et agrandissement de la valve pulmonaire par valvotomie ou commissurotomie, parfois avec un patch transannulaire;
- Conduit valvé entre le VD et l'AP si l’anatomie ne se prête pas à la correction, si la valve pulmonaire est atrétique, on si une coronaire au trajet aberrant passe sur la face antérieure de la CCVD.
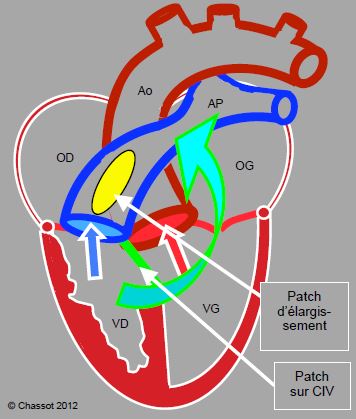
Figure 14.59 : Correction chirurgicale d’une tétralogie de Fallot. Le patch de la CIV divise les flux en dirigeant le sang veineux systémique vers l’AP et le sang artérialisé vers l’aorte ; un patch d’élargissement lève la sténose pulmonaire et sous-pulmonaire. La flèche indique la possibilité d’un conduit valvé entre le VD et l’AP lorsque le patch n’est pas réalisable.
L’approche de la CIV est transauriculaire et trans-tricuspidienne; l'accès à la valve pulmonaire se fait par l'AP. Eviter une incision ventriculaire améliore la fonction et limite les risques d'arythmie [13]. L'élargissement de la CCVD comporte le risque d'une insuffisance pulmonaire si le patch est trop généreux ou d’une sténose persistante s’il est trop restrictif; la correction est donc un compromis entre une régurgitation minime et le plus petit gradient résiduel. Le gradient maximal accepté est de 20-40 mmHg [17]. Un flux au-delà de 3 m/s, un gradient de plus de 40 mmHg ou un rapport PsystVD/PsystVG > 0.5 sont considérés comme excessifs. Lors de résection d'une hypertrophie dynamique de la chambre de chasse, il se peut que le gradient résiduel soit fonctionnel et non anatomique; il se réduit par ré-équilibration du tonus sympathique (béta-blocage), des conditions de charge et du taux d’Hb. Après une correction totale, la SaO2 doit être > 98%. La mortalité opératoire de la correction totale en bas âge est < 2% et la survie est de > 95% à 36 ans [1,5]. Toutefois, beaucoup d'enfants auront besoin d’une deuxième intervention à l'âge adulte en raison d’une insuffisance pulmonaire, ou plus rarement d’une sténose, ou pour placer un conduit plus large. Lorsqu’ils sont opérés à l’adolescence, seuls 10-15% des cas requièrent une réopération ultérieure, mais il s’agit là des rares enfants qui avaient survécu avec leur malformation pendant une quinzaine d’années.
La correction peut laisser plusieurs séquelles majeures [7,12,15].
- Arythmies dans > 50% des cas : bloc de branche droit ou bloc bifasciculaire (60-100%), extrasystolie ventriculaire, FA, mort subite (1-5%). Eviter un abord trans-ventriculaire diminue le taux d'arythmie.
- CIV résiduelle (10-20%).
- Insuffisance de la valve pulmonaire (IP); le degré de l'IP postopératoire est le facteur pronostique le plus important pour la fonction ventriculaire droite ultérieure. Lorsqu'elle est majeure (fraction de régurgitation > 25%), l'IP induit progressivement une dilatation du VD par surcharge de volume à laquelle est directement liée la fréquence des arythmies ventriculaires et des morts subites. La valve doit être remplacée assez tôt pour éviter les complications droites [3]. Toute augmentation de la postcharge du VD comme l'élévation des RAP et de la pression intrathoracique accroît la régurgitation.
- Sténose résiduelle du conduit pulmonaire ou de la CCVD; un rapport de pression VD:VG > 0.6 est mal toléré à long terme et le VD défaille. La correction peut se réaliser par cathétérisme: dilatation au ballon, ou implantation percutanée de bioprothèse (Melody™, Sapien™) si la zone d'implantation est assez rigide (conduit préalable, fibrose) [8].
- Insuffisance ventriculaire droite par surcharge de volume ou de pression qui apparaît à l’âge adulte; la correction chirurgicale ne permet plus une récupération fonctionnelle adéquate du VD lorsque sa taille est > 150 mL/m2 [16]. Il n’a toutefois pas pu être démontré que la réopération, même pratiquée précocement, permette la normalisation de la fonction systolique. Le traitement pharmacologique de l'insuffisance droite est très décevant chez les congénitaux [3].
- Dysfonction du VG; elle est proportionnelle au délai jusqu’à la correction totale, à l’importance de la cyanose et à la durée pendant laquelle le flux pulmonaire était assuré par un shunt palliatif (Blalock, Potts, etc). Elle est rare avec la correction totale en bas âge.
Tétralogie de Fallot et agénésie pulmonaire
Dans cette combinaison, la connexion entre le VD et l'AP est absente; la CCVD est un cul-de-sac. Cette agénésie est accompagnée d'un manque de développement variable de l'artère pulmonaire, compensé à la naissance par le flux du canal artériel. Dans les cas extrêmes, tout le flux pulmonaire est assuré par un réseau de collatérales issues de l'aorte sans lien avec l'arbre pulmonaire atrétique (MAPCA, major aorto-pulmonary collateral arteries); le shunt D-G à travers la CIV cause un mélange complet de sang veineux et artérialisé dans le VG.
Quand l'anatomie le permet, la correction chirurgicale consiste à fermer la CIV et à connecter le VD et l'AP au moyen d'un conduit valvé. Dans les cas de MAPCA, on procède à une unifocalisation: les collatérales sont détachées de l'aorte et réimplantées dans un conduit issu du VD; la CIV est occluse. Ces enfants sont pris en charge de manière analogue à ceux souffrant d'une physiologie univentriculaire (voir Hypoplasie ventriculaire) [10].
Tétralogie de Fallot et absence de valve pulmonaire
Cette situation diffère de la précédante par une connexion sans valve entre le VD et l'AP. La régurgitation est massive, le VD est dilaté et l'augmentation de pulsatilité de l'AP pendant la vie fœtale provoque une dilatation anévrysmale des vaisseaux pulmonaires accompagnée de compression bronchique et de trachéomalacie. La correction consiste à réduire la taille de l'AP, à fermer la CIV et à créer une valve pulmonaire (homogreffe). La prise en charge de ces enfants implique de maintenir la contractilité du VD qui est en surcharge de volume et à baisser les RAP pour restreindre l'insuffisance pulmonaire (hyperventilation, pression intrathopracique basse); il faut éviter tous les éléments qui peuvent induire une vasconstriction pulmonaire.
Anesthésie pour palliation
Si le flux pulmonaire est très diminué, l’enfant ne peut pas attendre l’âge d’une correction totale et doit subir une palliation provisoire sous forme d’un shunt de Blalock modifié: au lieu d’anastomoser l’artère sous-clavière directement à l’artère pulmonaire ipsilatérale, on interpose un shunt de Goretex™ 3.5-4 mm entre les deux vaisseaux du côté opposé à la crosse aortique. Ceci maintient une perfusion normale dans le bras et règle le flux pulmonaire d’après le diamètre du tube.
La prise en charge vise à augmenter les RAS avec des vasoconstricteurs systémiques (noradrénaline, phényléphrine) pour augmenter le flux à travers le shunt et pour forcer celui de la CIV dans le sens G-D. Une stimulation béta est contre-indiquée car elle augmenterait la composante dynamique de la sténose infundibulaire droite. L’intervention a lieu par thoracotomie; elle demande une héparinisation à faible dose (100 U/kg) et une rétraction du poumon qui diminue les échanger gazeux. Lorsque le shunt est ouvert, la PAdiast systémique baisse (Figure 14.60) (Vidéos).
Vidéo: Flux systolo-diastolique dans l'artère sous-clavière gauche issue de la partie distale de la crosse aortique après confection d'un shunt de Blalock.
Vidéo: Flux systolo-diastolique dans un shunt de Blalock entre l'artère sous-clavière et l'AP (vue du médiastin postérieur).
Le shunt palliatit impose une surcharge de volume au VG, et un support inotrope est souvent nécessaire. La SaO2 adéquate se situe entre 80 et 85%; une valeur supérieure indique que le flux pulmonaire est excessif. Toutefois, même avec des SaO2 acceptables, il peut se développer un œdème pulmonaire unilatéral du côté du shunt. Il est prudent de maintenir la ventilation en pression positive pendant 24 heures postopératoires.
Vidéo: Flux systolo-diastolique dans l'artère sous-clavière gauche issue de la partie distale de la crosse aortique après confection d'un shunt de Blalock.
Vidéo: Flux systolo-diastolique dans un shunt de Blalock entre l'artère sous-clavière et l'AP (vue du médiastin postérieur).
Le shunt palliatit impose une surcharge de volume au VG, et un support inotrope est souvent nécessaire. La SaO2 adéquate se situe entre 80 et 85%; une valeur supérieure indique que le flux pulmonaire est excessif. Toutefois, même avec des SaO2 acceptables, il peut se développer un œdème pulmonaire unilatéral du côté du shunt. Il est prudent de maintenir la ventilation en pression positive pendant 24 heures postopératoires.
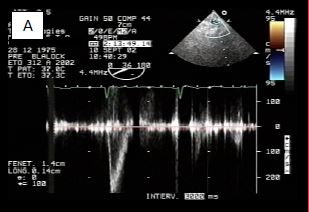
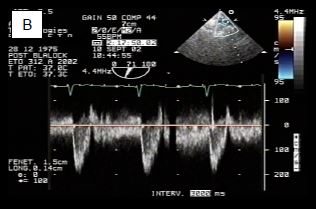
Figure 14.60 : Flux lors de la confection d’un shunt de Blalock-Taussig. A : flux dans l’artère sous-clavière avant la construction du shunt; le flux est exclusivement systolique comme dans toute artère systémique. B : après connexion à l’artère pulmonaire, le flux devient systolo-diastolique comme dans un shunt G→D; de ce fait, la PA diastolique s’abaisse.
Anesthésie pour correction totale
Le but de la prise en charge pour la correction totale est double: diminuer le shunt et augmenter le débit pulmonaire (voir Tableau 14.5).
- Augmenter les résistances artérielles systémiques: ceci diminue le shunt D-G cyanogène, mais au prix d'une baisse de la perfusion systémique si la vasoconstriction est intense. D'autre part, une hypertension artérielle augmente la postcharge du VG et du VD, ce dernier étant déjà en difficulté car soumis à une pression d'éjection systémique. La SpO2 est un monitorage efficace et immédiat de l'importance du shunt.
- Augmenter le flux pulmonaire: en cas d'obstruction fixe, la vasoconstriction artérielle (alpha-stimulants, phényléphrine) est indiquée. Lorsque l'obstruction est dynamique, le béta-blocage est également nécessaire pour relâcher la musculature de la CCVD. Les agents inotropes positifs sont contre-indiqués, tout comme l'atropine. La ventilation doit respecter une pression intrathoracuque basse et une hyperventilation pour favoriser le flux pulmonaire.
- Maintenir la normovolémie; en cas d'hypovolémie, la composante D-G du shunt augmente, comme lors d'une baisse de pression systémique. D’autre part, ces enfants sont polycythémiques et toute déshydratation augmente encore l’Ht, la viscosité et le risque de thromboses. L'induction s'accompagne de l'administration de 10-15 mL/kg de cristalloïde ou d'albumine 5% [10].
Une crise hypoxique (blue-spell) peut survenir à tout moment; si elle n’est pas gérée à temps, elle peut conduire au collapsus cardiovasculaire. Sous anesthésie générale, la crise se traduit par une désaturation artérielle, une tachycardie, une baisse de la pression artérielle et une disparition du souffle à l’auscultation. Le traitement doit être immédiat en cas de désaturation profonde [10].
- Approfondissement de l’anesthésie (fentanyl); éviter l’isoflurane, trop vasodilatateur.
- Ventilation à FiO2 1.0, hyperventilation normobarique (Pmoy intrathoracique basse).
- Phényléphrine 5-10 mcg/kg en bolus iv, perfusion de noradrénaline.
- Remplissage (15-30 mL/kg), surélévation des membres inférieurs.
- Bicarbonate (1-2 mEq/kg) si acidose métabolique.
- Si le péricarde est ouvert, compression manuelle de l’aorte.
- Esmolol (0.5 mg/kg, puis perfusion 50-300 mcg/kg/min).
L’anesthésie est basée sur une combinaison fentanyl-midazolam ou fentanyl-sevoflurane. L’induction peut se faire au masque (sevoflurane) ou par voie intraveineuse (kétamine) pour autant qu’il n’y ait pas de dysfonction ventriculaire ni de risque de blue-spell. Dans les cas hémodynamiquement instables, il est préférable d’utiliser principalement du fentanyl (50-75 mcg/kg) ou du sufentanil (5.0-7.5 mcg/kg) et du midazolam ou de l’etomidate en appoint. La cyanose est accompagnée de défauts de coagulation et d’inhibition plaquettaire. Elle potentialise la réaction inflammatoire systémique, limite l’hémodilution en CEC (risque d’hypoxémie) et contraint à sortir de pompe avec un Ht élevé.
Plusieurs problèmes majeurs dominent le postopératoire [10].
- Dysfonction systolique du VD : elle est traitée par dobutamine (5-10 mcg/kg/min) ou adrénaline (0.01-0.1 mcg/kg/min) + milrinone (0.5-1.0 mcg/kg/min). Bien qu’utile en cas de stase droite, la nitroglycérine (2 mcg/kg/min) n’est pas recommandée chez les Fallot. D’autre part, le VD hypertrophié des Fallot présente une dysfonction diastolique de type restrictif dans 30% des cas, ce qui implique une élévation importante de la PVC pour maintenir le débit du ventricule [2].
- Arythmies : tachy-arythmies susjonctionnelles, bloc AV complet nécessitant un pacing temporaire.
- Hémorragie.
- Séquelles de la chirurgie: ventriculotomie (dyskinésie de la paroi libre du VD), insuffisance pulmonaire (surcharge de volume du VD), CIV résiduelle (idem).
En présence d'une palliation préalable par un shunt systémique - pulmonaire ou en cas de collatérales aorto-pulmonaires importantes, la perfusion pulmonaire n'est assurée que si la pression systémique est satisfaisante. Toute vasodilatation artérielle diminue le débit du shunt, donc le flux pulmonaire; la cyanose augmente. Ces enfants bénéficient donc également d’une augmentation des RAS. La pression artérielle diastolique est chroniquement abaissée lorsque le shunt débite de manière satisfaisante, parce que la pression dans l'arbre pulmonaire opère un vol continu. Comme c'est le VG qui doit assurer la perfusion systémique et pulmonaire, il travaille en surcharge de volume et à la limite de la défaillance.
| Tétralogie de Fallot (TdF) |
|
Caractéristiques :
- CIV sous-aortique (septum membraneux)
- Aorte à cheval sur la CIV
- Sténose pulmonaire (CCVD, valve pulmonaire, tronc de l’AP)
- HVD (VD connecté à la pression systémique)
Shunt D → G cyanogène, débit pulmonaire abaissé (Qp ↑, Qp/Qs < 1.0)
Pour diminuer le shunt, augmenter les RAS (stimulation alpha), diminuer les RAP (hyperventilation)
Si composante dynamique (obstruction CCVD) : béta-bloqueur
SaO2 proportionnelle au Qp/Qs
Recommandations pour l’anesthésie :
- AG sevoflurane ou fentanyl/midazolam (ou etomidate pour l'induction)
- Ventilation : hypocapnie, FiO2 sans effet significatif sur la SpO2
- Augmenter les RAS pour ↑ SpO2
- Eviter la vasodilatation systémique, perfusion de vasoconstricteur si nécessaire
- Maintenir la précharge : l’hypovolémie augmente le shunt D → G cyanogène
Si le débit pulmonaire est assuré par un shunt palliatif (type Blalock-Taussig) ou des collatérales Ao → AP (flux fixe)
- Qp proportionnel à la PA systémique
- Maintenir les RAS ↑
- Hypovolémie/hypotension : Qp ↓, cyanose ↑
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- AL HABIB HF, JACOBS JP, MAVROUDIS C, et al. Contemporary patterns of management of tetralogy of Fallot: data from the Society of Thoracic Surgeons database. Ann Thorac Surg 2010; 90:813-20
- CHATURVEDI RR, SHORE DF, LINCOLN C, et al. Acute right ventricular restrictive physiology after repair of tetralogy of Fallot : association with myocardial injury and oxidative stress. Ciculation 1999; 100:1540-7
- DAVLOUROS PA, NIWA K, WEBB G, GATZOULIS MA. The right ventricle in congenital heart disease. Heart 2006; 92(Suppl 1): i27-i38
- DIDONATO RM, JONAS RA, LANG P, ROWE JJ, CASTANEDA AR. Neonatal repair of tetralogy of Fallot with and without pulmonary atresia. J Thorac Cardiovasc Surg 1991; 101:126-37
- ERIKSSEN G, LIESTOL K, SEEM E, et al. Achievements in congenital heart defect surgery: a prospective, 40-year study of 7'038 patients. Circulation 2015; 131:337-46
- HONJO O, Van ARSDELL GS. Cardiovascular procedures : surgical considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1589-608
- JIMENEZ M, ESPILl G, THAMBO JB, et al: Outcome of operated Fallot's tetralogy. Arch Mal Coeur Vaiss 2002; 95:1104-11
- KHAMBADKONE S. Percutaneous pulmonary valve implantation. Ann Pediatr Cardiol 2012; 5:53-60
- KLOESEL B, DINARDO JA, BODY SC. Cardiac embryology and molecular mechanisms of congenital heart disease – A primer for anesthesiologists. Anesth Analg 2016; 123:551-69
- NASR VG, DINARDO JA. The pediatric cardiac anesthesia handbook. Oxford: Wiley-Blackwell, 2017; 131-46
- PIGULA FA, KHALIL PN, MAYER JE, et al. Repair of tetralogy of Fallot in neonates and young infants. Circulation 1999; 100(Suppl II):157-61
- SILVERSIDES CK, KIESS M, BEAUCHESNE L, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Outflow tract obstruction, coarctation of the aorta, tetralogy of Fallot, Ebstein anomaly and Marfan’s syndrome. Can J Cardiol 2010; 26:e80-e97
- SYFRIDIS PG, KIRVASSILIS GV, PAPAGIANNIS JK, et al. Preservation of right ventricular structure and function following transatrial transpulmonary repair of tetralogy of Fallot. Eur J Cardiothorac Surg 2013; 43:336-42
- VAN PRAAGH R. Tetralogy of Fallot: underdevelopment of the pulmonary infundibulum and its sequelae. Am J Cardiol 1970; 47:1279
- VILLAFAÑE J, FEINSTEIN JA, JENKINS KJ, et al. Hot topics in tetralogy of Fallot. J Am Coll Cardiol 2013; 62:2155-66
- WARNES CA. Adult congenital heart disease. Importance of the right ventricle. J Am Coll Cardiol 2009; 54:1903-10
- WEINTRAUB R, SHIOTA T, ELKADI T, et al. Transesophageal echocardiography in infants and children with congenital heart disease. Circulation 1992; 86:711-22
