Récupération sanguine et retransfusion
Le fonctionnement des machines de récupération sanguine peropératoire par centrifugation (CellSaver™) est fondé sur deux principes physiques (Figure 28.16):
- La différence de densité des constituants sanguins: les particules les plus lourdes (globules rouges) sédimentent contre les parois de la cloche pendant la centrifugation, alors que les plus légères (plasma) restent au centre;
- La balance entre les forces centrifuge et hydrostatique: avec la force hydrostatique de l'aspiration, le plasma est éjecté en premier parce que la force centrifuge qui s'exerce sur lui est plus faible; les globules restent contre les parois parce que leur masse les rend plus sensibles à la force centrifuge.
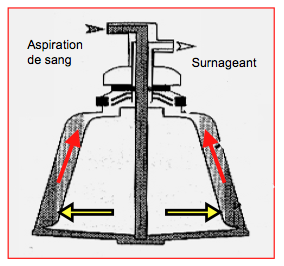
Figure 28.16 : Représentation d'une cloche de CellSaver™ avec les forces centrifuges (flèches jaunes) et hydrostatiques (flèches rouges).
Il suffit de laver ensuite la cloche avec un cristalloïde pour récupérer le sang, dont l'hématocrite est en général 50-65% [13]. Environ 200 mL de sang lavé correspondent à une poche de sang. Le système nécessite une anticoagulation (citrate ou héparine) administrée dans le circuit de récupération et lavée ensuite par la centrifugation; en salle d'opération, il mobilise une personne dédiée à son fonctionnement. Chez un homme de 70 kg avec un Ht de 45%, cette technique permet de récupérer 9'600 mL de sang si l'on accepte un Ht final de 21% et un taux de récupération dans le champ opératoire de 60% [14]. Mais les inconvénients ne sont pas négligeables.
- L'aspiration continue dans le champ opératoire crée des turbulences et de l'hémolyse;
- Il existe un risque d'embolie gazeuse si la retransfusion se fait en comprimant le sachet à l'aide d'une manchette à pression;
- Une erreur avec le liquide de lavage est possible: il doit être fait avec du NaCl 0.9%, non avec de l'eau stérile;
- L’infection est une contre-indication ; le risque de métastatisation hématogène en chirurgie du cancer n’est pas réellement prouvé (le sang devrait être irradié et leucodéplété avant retransfusion);
- Les électrolytes (notamment Mg2+, Ca2+), le bicarbonate (risque d'acidose) et les protéines (facteurs de coagulation) sont perdus dans le lavage; il en est de même des médicaments circulants.
Le rapport coût / bénéfice de la technique dépend de la quantité de sang récupéré: pour dix poches de sang, le coût s'abaisse à CHF 30.- par poche, ce qui est rentable [13]; la mise en place du système pour ne récupérer qu'une seule poche ne l'est certainement pas. Le seuil de rentabilité voisine 1'500 mL de sang récupéré, donc plus de 2.5 litres de volume traité [7]. La réduction du risque de transfusion est en moyenne de 0.37 en chirurgie de l'anévrysme aortique abdominal, mais seulement 0.97 en chirurgie vasculaire périphérique [1]. Il n'y a donc pas de preuve suffisante pour recommander la récupération sanguine de routine en chirurgie vasculaire. En chirurgie cardiaque, le système est de toute manière utile pour concentrer le volume résiduel de la CEC et éliminer l'héparine. Il est contre-indiqué en cas de maladie infectieuse (endocardite) et n’est pas recommandé en cas de maladie néoplasique [5]. Toutefois, le peu de preuve à ce sujet et l’effet favorisant de la transfusion sur la croissance tumorale tendent à renverser l’attitude conseillée jusqu’ici [6].
Circuits de CEC
La réduction de dimension des circuits de CEC dans les systèmes dits "mini-CEC" (MECC, voir Chapitre 7, Mini-CEC) diminue le volume d’amorçage, donc le degré d’hémodilution du patient. Ceci est particulièrement utile chez les patients anémiques ou de petite taille. Dans ces systèmes, la longueur des tuyaux est diminuée et le réservoir de cardiotomie est supprimé; il n'y plus de contact entre le sang et l'air. La pompe est une pompe de type centrifuge qui est responsable à la fois du drainage veineux par aspiration et de la propulsion du sang dans l'artère. Le système est complété par un oxygénateur, un échangeur de chaleur et un filtre. L'absence de réservoir nécessite un système permettant l'aspiration du sang du champ opératoire dans un bac rigide sous vide régulé qui fait office de vase d'expansion et qui est placé en dérivation sur la ligne veineuse Il est actuellement démontré que ces mini-circuits, quoique plus délicats à gérer, réduisent la réaction inflammatoire systémique, l’hémodilution, l’hémorragie postopératoire et le besoin en produits sanguins [2,6]. Bien qu'ils ne modifient pas le taux de reprise pour hémostase, ils diminuent significativement le taux de transfusion (OR 0.35) [8].
Le remplissage rétrograde autologue du circuit de CEC consiste à utiliser le volume circulant du patient comme amorçage. Cette technique limite considérablement l’hémodilution mais demande beaucoup de doigté et de synchronisation entre l’anesthésiste et le perfusionniste.
La microplégie consiste à utiliser comme solution de cardioplégie un mélange de sang de la CEC et d’une solution concentrée d’additifs cardioplégiants. Le degré d’hémodilution et l’anémie de CEC sont réduits, ce qui diminue potentiellement le besoin en globules rouges externes [6]. Des circuits de CEC biocompatibles sont maintenant sur le marché. Quoique plus onéreux, ils tendent à diminuer l’hémorragie et le besoin en transfusion postopératoire. Cet avantage est toutefois marginal, et ces circuits n’ont leur sens que dans le cadre d’une stratégie multimodale d’épargne sanguine [12].
L’ultrafiltration conventionnelle consiste à interposer dans le circuit de CEC un appareil constitué de fibres semi-perméables qui filtrent l'eau, les électrolytes et les protéines les plus petites (poids moléculaire < 20'000 Da); l'héparine est partiellement filtrée (voir Chapitre 7 Hémofiltration). Les échanges à travers la membrane sont fonction de la pression hydrostatique (pompe artérielle de la CEC). Les plaquettes, l'albumine et les facteurs de coagulation sont conservés; une partie des médiateurs inflammatoires est éliminée (TNF, IL-6, IL-10, C3a). Le système permet de soustraire jusqu'à 180 ml par minute (4-5 L H2O par heure) pour un débit de 500 mL/min. L'intérêt de la procédure est de diminuer l’hémodilution et de remonter l'hématocrite.
L’ultrafiltration modifiée (MUF: modified ultrafiltration) utilise le même procédé mais après la mise en charge du patient: le sang est débarrassé d’une bonne partie de l’excès liquidien accumulé pendant la CEC en le filtrant via le circuit extracorporel dont les canules sont maintenues en place pendant que le coeur du malade assure la perfusion systémique. Les besoins en globules rouges et en produits sanguins dérivés sont significativement réduits [4,6].
Toutefois, la modification ultime de la CEC est de ne pas l'utiliser. Les pontages à cœur battant (OPCAB), par exemple, réduisent le besoin en héparine (ACT visé: 250-300 secondes), donc le risque hémorragique. En effet, le taux de transfusion passe de 63% sous CEC à 50% sans CEC [10].
Agents topiques
Il existe de nombreux moyens hémostatiques locaux utilisables dans le champ opératoire : compresses (Surgicel™), enduits dérivés de thrombine bovine et/ou de fibrinogène (très immunogènes), colle faite d’un mélange de glutaraldéhyde et d’albumine bovine. Comme ils réduisent le suintement diffus et le saignement en nappe, ces agents tendant à diminuer la consommation de concentrés érythrocytaires, mais cela n’a jamais été formellement démontré [6]. Quelle que soit leur efficacité, ces substances ne remplacent jamais une hémostase chirurgicale méticuleuse. La coagulation et la ligature restent le pivot central d’une épargne sanguine raisonnée, même si elles prolongent sensiblement la durée opératoire.
Mesures de la coagulation
En CEC, la gestion de l'héparine basée sur la mesure du taux circulant plutôt que sur celle de l'ACT est plus précise; elle permet également une meilleure adéquation de la quantité de protamine nécessaire à l'antagonisme de l'héparine (rapport 0.8:1). Cette manière de procéder tend à réduire le nombre global de transfusions [3].
La possibilité de déterminer le status coagulatoire du patient en salle d’opération ou aux soins intensifs (Point-of-care testing) est une avancée considérable dans la gestion globale des produits sanguins, car elle offre plusieurs avantages [11].
- Remplacement spécifique du ou des facteur(s) déficients(s) ;
- Identification des patients qui peuvent bénéficier d’un traitement pharmacologique ;
- Confirmation d’une perte sanguine de nature chirurgicale lorsque le test est normal ;
- Abandon de l’attitude indiscriminée qui consistait à administrer un maximum de produits (PFC, thrombocytes, facteurs sous plusieurs formes) en ignorant lequel était efficace ;
- Diminution de la consommation de concentrés érythrocytaires par meilleure gestion de l’hémostase.
Le thromboélastogramme (rTEG™, ROTEM™) et les tests d’agglutination plaquettaire ont permis de construire des algorithmes pour une gestion cohérente des produits sanguins (voir Figure 28.12). Un test pratiqué au déclampage de l'aorte permet de prévoir les éléments à substituer au moment de la mise en charge.
Tout examen de laboratoire consomme une certaine quantité de sang. C'est un élément oublié dans l'épargne sanguine. Or un cas standard de chirurgie cardiaque perd en moyenne 450 mL de sang au cours de son séjour hospitalier en échantillons prélevés pour divers tests [9]. C'est l'équivalent d'une poche de sang ! Elle peut être épargnée en étant plus scrupuleux sur les besoins réels et en ne procédant qu'aux examens qui ont un impact sur la thérapeutique.
| Epargne sanguine : techniques peropératoires |
|
Récupération sanguine (CellSaver) : rentable si l’on récupère ≥ 1'500 ml de sang (≥ 2.5 litres de volume traité)
Circuits de CEC : mini-CEC, amorçage rétrograde, microplégie, ultrafiltration (continue et modifiée)
Agents topiques dans le champ opératoire
Hémostase chirurgicale méticuleuse
Thromboélastogramme et test d’agrégabilité plaquettaire
|
© CHASSOT PG, MARCUCCI C, SPAHN DR. Juin 2011; dernière mise à jour, Novembre 2018
Références
- ALVAREZ GG, FERGUSSON DA, NEILIPOVITZ DT, HEBERT PC. Cell salvage does not minimize perioperative allogeneic blood transfusion in abdominal vascular surgery: a systematic review. Can J Anaesth 2004; 51:425-31
- BENEDETTO U, LUCIANI R, GORACCI M, et al. Miniaturized cardiopulmonary bypass and acute kidney injury in coronary artery bypass graft surgery. Ann Thorac Surg 2009; 88:529-35
- BOER C, MEESTERS MI, MILOJEVIC M, et al. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery. J Cardiothorac Vasc Anesth 2018; 32:88-120
- BOODHWANI M, WILLIAMS K, BABAEV K, et al. Ultrafiltration reduces blood transfusions following cardiac surgery: A meta-analysis. Eur J Cardiothorac Surg 2006; 30:892-7
- FERNANDEZ MC, GOTTLIEB M, MENITOCE JE. Blood transfusion and postoperative infection in orthopaedic patients. Transfusion 1992; 32:318-22
- FERRARIS VA, BROWN JR, DESPOTIS GJ, et al. 2011 update to the Society of Thoracic Surgeons and the Society of Cardiovascular Anesthesiologists blood conservation clinical practice guidelines. Ann Thorac Surg 2011; 91:944-82
- FREISCHLAG JA. Intraoperative blood salvage in vascular surgery – worth the effort ? Critical Care 2004; 8(Suppl 2):S53-6
- HARLING L, WARREN OJ, MARTIN A, et al. Do minituruzed extracoroporeal circuits confer significant clinical benefit without compromiding safety ? A meta-analysis of randomized controlled trials. ASAIO J 2011; 57:141-51
- KOCH CG, REINEKS EZ, TANG AS, et al. Contemporary bloodletting in cardiac surgical care. Ann Thorac Surg 2015; 99:779-84
- LAMY A, DEVEREAUX PJ, PRABHAKARAN D, et al. Off-pump or on-pump coronary artery bypass grafting at 30 days. N Engl J Med 2012; 366:1489-97
- McMULLAN V, ALSTON RP. Aprotinin and cardiac surgery : a sorry tale of evidence misused. Br J Anaesth 2013; 110 : 675-8
- RANUCCI M, BALDUINI A ; DITTA A, et al. A systemtaic review of biocompatible cardiopulmonary bypass circuits and clinical outcome. Ann Thorac Surg 2009 ; 87 :1311-9
- WATERS JH. Red blood cell recovery and reinfusion. Anesthesiol Clin N Am 2005; 23:283-94
- WATERS JH, LEE JS, KARAFA MT. A mathematical model of cell salvage efficiency. Anesth Analg 2002; 95:1312-7
