Un shunt est défini par le rapport entre le débit pulmonaire (Qp) et le débit systémique (Qs). Dans une hémodynamique normale, les deux débits sont égaux: Qp = Qs. Dans un shunt G-D, le rapport Qp/Qs est > 1; lorsqu'il est > 1.5-2, l'indication opératoire est posée car le débit pulmonaire est le double du débit systémique. Dans un shunt D-G, le rapport Qp/Qs est < 1; un rapport de 0.5:1 indique que le débit pulmonaire est la moitié du débit systémique. Tout shunt D-G est une indication thérapeutique. Le débit pulmonaire peut être augmenté (shunt G-D) ou diminué (shunt D-G, sténose pulmonaire). Une augmentation de longue durée du débit pulmonaire peut conduire à une hypertension pulmonaire, alors que la réduction du débit pulmonaire conduit à la cyanose.
Un shunt présente quatre caractéristiques principales: la direction de son flux (G-D, D-G ou bidirectionnel), la dimension de l'orifice (restrictif ou non-restrictif), la dilatation des cavités d'aval et les modifications induites sur le débit pulmonaire [2]. Le débit du shunt est fonction du diamètre de l'orifice (ou du conduit), de la pression dans la cavité d'amont et de la résistance au flux dans la cavité d'aval. Le flux est systolo-diastolique, avec deux pics de vélocité; la valeur maximale de cette dernière est habituellement de 1 à 4 m/s [1]. A dimension égale, le débit d'un shunt augmente si la pression d'amont s'élève ou si celle d'aval s'abaisse.
Un shunt présente quatre caractéristiques principales: la direction de son flux (G-D, D-G ou bidirectionnel), la dimension de l'orifice (restrictif ou non-restrictif), la dilatation des cavités d'aval et les modifications induites sur le débit pulmonaire [2]. Le débit du shunt est fonction du diamètre de l'orifice (ou du conduit), de la pression dans la cavité d'amont et de la résistance au flux dans la cavité d'aval. Le flux est systolo-diastolique, avec deux pics de vélocité; la valeur maximale de cette dernière est habituellement de 1 à 4 m/s [1]. A dimension égale, le débit d'un shunt augmente si la pression d'amont s'élève ou si celle d'aval s'abaisse.
- Shunt gauche → droit (retour veineux pulmonaire anormal, CIA, canal AV, CIV, canal artériel) (Figure 14.8) (Tableau 14.4): il diminue si les RAS baissent ou si les RAP augmentent. Dans une CIA, il augmente si la POG s'élève (baisse de compliance du VG). La surcharge du circuit pulmonaire conduit plus ou moins rapidement à une hypertension pulmonaire. Une SaO2 élevée n'est pas la garantie que le transport d'O2 (DO2) soit satisfaisant; avec un rapport Qp/Qs ≥ 3:1, le DO2 diminue même si le sang artériel est correctement oxygéné (risque de cyanose). La surcharge du circuit pulmonaire conduit plus ou moins rapidement à une hypertension pulmonaire, à une insuffisance ventriculaire congestive et à une maladie vasculaire pulmonaire avec des RAP si hautes qu'elles induisent secondairement un shunt bidirectionnel (syndrome d'Eisenmenger).
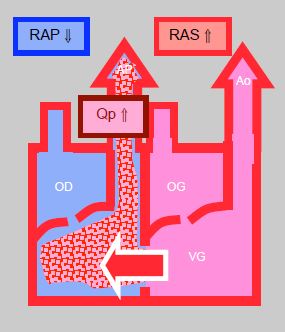
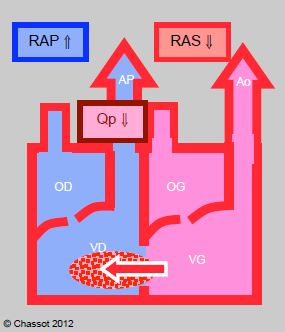
Figure 14.8 : Shunt gauche → droit. Il augmente lorsque les RAS s’élèvent et que les RAP baissent; le flux pulmonaire (Qp) est alors excessif. Le shunt diminue si les RAS baissent et si les RAP augmentent.
- Shunt droit → gauche cyanogène (tétralogie de Fallot, CIV + atrésie pulmonaire, transposition des gros vaisseaux, ventricule unique) (Figure 14.9) (Tableau 14.5): il augmente si les RAS baissent ou si les RAP augmentent; la cyanose est proportionnelle à la baisse de pression systémique. Pour diminuer un shunt cyanogène, il faut baisser les résistances pulmonaires et la postcharge droite, ou augmenter les résistances systémiques et la postcharge gauche. Les variations de la SaO2 suivent celles du rapport Qp/Qs; l'augmentation de la FiO2 a un effet minime sur la cyanose due à un shunt D-G, car celle-ci est due à un flux sanguin qui ne traverse pas les poumons. Une SaO ≥ 75% est en général tolérée, mais une valeur < 70-75% est une indication opératoire car elle correspond à un Qp/Qs < 0.5:1.

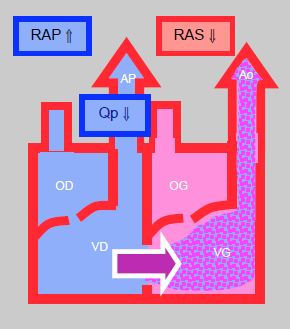
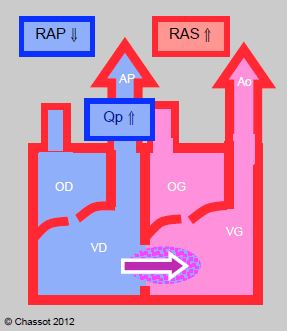
Figure 14.9 : Shunt droit
gauche. Il augmente lorsque les RAS baissent, ce qui diminue le flux artériel pulmonaire (Qp). Le shunt diminue si les RAS augmentent et si les RAP baissent; de ce fait, le flux pulmonaire augmente et la SaO2 s’améliore.
- Shunt palliatif gauche → droit (shunt de Blalock-Taussig, shunt central aorto-pulmonaire, collatérales aorto-pulmonaires) (Figure 14.10): le débit est fixé par le diamètre du shunt ou des collatérales; il conduit à une surcharge ventriculaire gauche. Le débit pulmonaire est directement fonction de la pression systémique: la SaO2 diminue si les RAS baissent (hypotension, hypovolémie) ou si les RAP augmentent. L'équilibre est parfois difficile à trouver. L'utilisation d'un α-stimulant (néosynéphrine, nor-adrénaline) freine effectivement la désaturation artérielle, mais risque d'augmenter fortement le rapport Qp/Qs et de conduire à une surcharge pulmonaire et à une hypoperfusion systémique. Il est habituellement préférable de jouer sur les RAP (FiO2 basse, hypoventilation modérée). La pression diastolique systémique est basse à cause de la fuite continue dans le lit pulmonaire, ce qui peut compromettre la circulation coronarienne.
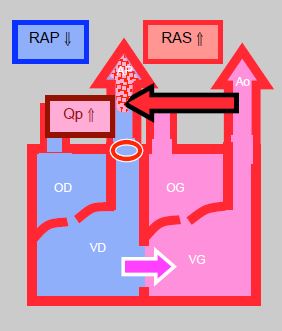
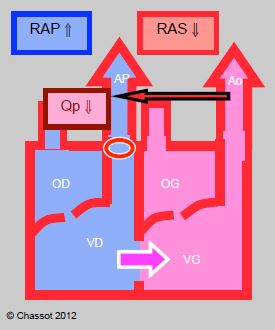
Figure 14.10 : Shunt correctif gauche → droit pour augmenter le débit pulmonaire (Qp) lors de sténose pulmonaire. Son débit diminue lorsque les RAS baissent et augmente avec celles-ci.
- Shunt bidirectionnel: lorsque l'orifice est large et le gradient de pression faible, le flux peut aller dans un sens en systole et dans l'autre en diastole, ou varier selon les RAS, les RAP et les pressions de ventilation. La saturation en O2 de l'AP est plus élevée que celle du retour veineux systémique, mais la satureation dans l'aorte est plus basse que celle des veines pulmonaires. Dans un shunt bidirectionnel, le flux effectif est la composante du flux total de l'aorte et de l'AP qui provient de la circulation appropriée, le flux total (Qt) étant la somme du flux effectif (Qeff) et du flux recirculé par le shunt (Qrecirc) [3]. Dans la transposition des gros vaisseaux, où les deux circulations sont parallèles et non en série, le flux effectif est en réalité celui du shunt qui a lieu par la CIA ou la CIV (voir Transposition des gros vaisseaux). Dans la physiologie du ventricule unique ou du truncus arteriosus, les deux circulations sont interdépendantes; comme les RAP sont plus basses que les RAS, la circulation pulmonaire a tendance à "voler" le circuit systémique, particulièrement pendant la diastole; la surcharge de l'AP s'accompagne d'une hypoperfusion systémique (ischémie myocardique) et d'une acidose métabolique.
Si le défect est de petite taille, le shunt est dit restrictif car le débit y est faible et le gradient de pression élevé. Le flux à travers l'orifice sera plus ou moins fixe et peu influencé par les changements du rapport entre les résistances vasculaires pulmonaires et systémiques (RAP/RAS). Ce type de shunt a une importance hémodynamique stable: il varie peu durant l'anesthésie et l'opération. C'est le cas des petites CIV. Si le défect est grand, le shunt est dit non-restrictif : il y a peu de gradient ou même égalisation des pressions au travers de la communication. L'importance hémodynamique de ce type de shunt dépend du rapport RAP/RAS. Dans le cas extrême, le défect est tellement grand que les deux structures forment en fait une seule chambre commune (oreillette unique, ventricule unique). D’une manière générale, plus la taille du shunt est grande, plus son débit dépend du rapport entre les RAP et RAS. Les shunts situés au niveau ventriculaire (CIV) et artériel (canal artériel, shunt de Blalock) dépendent du rapport RAP/RAS, alors que les shunts situés au niveau auriculaire (CIA) dépendent davantage de la compliance respective des cavités droite et gauche.
D'une manière générale, le shunt cause une dilatation de la cavité de réception et une surcharge de travail pour le ventricule d’amont. Un shunt G-D au niveau ventriculaire (CIV) ou artériel (canal artériel, shunt de Blalock) augmente le débit pulmonaire, donc le retour veineux au coeur gauche. Il occasionne primairement une surcharge de volume du VG, qui est la pompe motrice pour le flux à travers le shunt; ce flux a lieu essentiellement en systole, lorsque la valve pulmonaire est ouverte. Le VD fonctionne comme un conduit passif. Seule l'augmentation progressive des RAP induit secondairement une surcharge de pression du VD. Le shunt G-D en amont des valves auriculo-ventriculaires (CIA, retour veineux pulmonaire anormal), par contre, crée une surcharge de volume pour le VD qui doit propulser le volume augmenté dans l'AP (Figure 14.11).

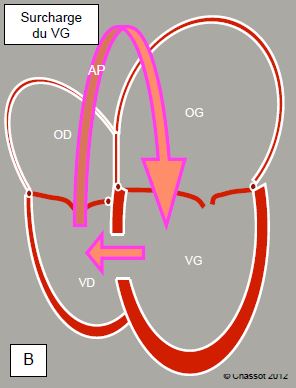
Figure 14.11 : Surcharge ventriculaire en cas de shunt G→D. A : Lors de shunt pré-tricuspidien (CIA, retour veineux pulmonaire anormal), l'OD et le VD sont dilatés (cavités d’aval du shunt); après l’AP, le sang revient à l’OG et repasse dans l’OD ; la surcharge de volume est assumée par le VD qui est dilaté et hyperdynamique. L’apex du cœur est formé par le VD, non par le VG. Cette surcharge de volume est bien tolérée pendant 2-3 décennies. B : En cas de shunt post-tricuspidien (CIV, canal artériel) le flux propulsé par le VG passe directement dans l’AP et revient par les veines pulmonaires dans l’OG et le VG ; la surcharge de volume est pour le VG. Mais ce shunt représente une surcharge de pression en même temps que de volume: il est moins bien toléré et le ventricule droit s'hypertrophie lorsque la pression pulmonaire devient élevée.
Le but premier de la prise en charge d’un enfant porteur de shunt est d’équilibrer les flux pulmonaire (Qp) et systémique (Qs), et d’obtenir un rapport Qp/Qs voisin de 1:1. Pour ce faire, on modifie les RAP et les RAS de manière à baisser le Qp dans un shunt G-D (RAP élevées et RAS basses) et à augmenter le Qp dans un shunt D-G cyanogène (RAP basses et RAS élevées). Dans le premier cas, on diminue la FiO2 et on augmente la PaCO2 par hypoventilation pour induire une acidose respiratoire (vasoconstriction pulmonaire); l'augmentation de l'hématocrite peut également jouer un rôle en élevant la visicosité. Dans le deuxième cas, au contraire, on augmente la FiO2 et on baisse la PaCO2 par hyperventilation pour créer une alcalose. Lors de shunt D-G cynogène, la manœuvre ne vise pas l’obtention de la SaO2 la plus haute possible, mais l’équilibre entre les deux circuits : le Qp doit assurer une SaO2 satisfaisante (souvent 75-85%) et le Qs un apport tissulaire normal (absence d’acidose métabolique). Le rapport Qp/Qs doit être aussi voisin que possible de 1:1. La présence d’un shunt potentialise les effets de l’hypovolémie sur la pression artérielle, à cause de la fuite constante de volume dans le circuit pulmonaire à basse pression.
Deux lois physiques adaptées à l'hémodynamique permettent de quantifier mathématiquement ces données:
Loi d'Ohm: Q = P / R (débit cardiaque = pression / résistance)
Loi de Poiseuille: Q = (ΔP • r4) / 8 • η • L
où: P = pression
r = rayon du conduit (shunt)
η = viscosité du sang
L = longueur du conduit
Le débit d'un shunt est donc proportionnel au gradient de pression à travers l'orifice et à la quatrième puissance du rayon de cet orifice, et inversément proportionnel à la résistance à travers le shunt et à la longueur de celui-ci.
Le shunt est bien mis en évidence à l'échocardiographie par le flux couleur et le Doppler spectral, en plus de la visualisation directe de l'anatomopathologie. La valeur d'un shunt (Qp/Qs) peut se calculer à l'échocardiographie par le rapport du flux ou du volume systolique à travers l'artère pulmonaire et à travers l'aorte (ou la chambre de chasse systémique). Un shunt peut se calculer plus fiablement au cathétérisme par l'enrichissement en oxygène de l'artère pulmonaire ou par l'apauvrissement en O2 de l'aorte à partir du principe de Fick [2]:
Le shunt est bien mis en évidence à l'échocardiographie par le flux couleur et le Doppler spectral, en plus de la visualisation directe de l'anatomopathologie. La valeur d'un shunt (Qp/Qs) peut se calculer à l'échocardiographie par le rapport du flux ou du volume systolique à travers l'artère pulmonaire et à travers l'aorte (ou la chambre de chasse systémique). Un shunt peut se calculer plus fiablement au cathétérisme par l'enrichissement en oxygène de l'artère pulmonaire ou par l'apauvrissement en O2 de l'aorte à partir du principe de Fick [2]:
- Débit pulmonaire (Qp) = VO2 / (CvpO2 - CapO2)
- Débit systémique (Qs) = VO2 / (CaoO2 - CvO2)
- Shunt (Qp / Qs) = (CaoO2 - CvO2) / (CpvO2 - CapO2)
où: VO2 = consommation d’O2
CaoO2 = contenu artériel aortique en O2
CvO2 = contenu veineux central en O2
CvpO2 = contenu veineux pulmonaire en O2 ( ≈ CaoO2)
CapO2 = contenu de l'artère pulmonaire en O2
Comme le contenu veineux pulmonaire en O2 est très voisin de celui de l’aorte, on peut le remplacer par la CaoO2. Le contenu artériel en O2 (CaO2) est la somme de l'O2 transporté par l'Hb et de l'O2 dissous:
CaO2 = Hb (g/L) x 1.34 (mL O2/g Hb) x SaO2 + PO2 (mmHg) x 0.003 (mL O2/mmHg/dL)
CaO2 = Hb (g/L) x 1.34 (mL O2/g Hb) x SaO2 + PO2 (mmHg) x 0.003 (mL O2/mmHg/dL)
Comme les mesures sont faites à l'air ambiant (FiO2 0.21), l'O2 dissous est négligeable et peut être abandonné. La quantité d'Hb étant la même dans tous les échantillons simultanés, on peut ne garder que la saturation en O2. Dans le calcul du shunt, les saturations peuvent donc remplacer le contenu en O2. La formule devient :
Shunt (Qp / Qs) = (SaO2 - SvO2) / (SaO2 - SapO2)
L'échantillonnage pour les saturations doit se faire en amont et en aval du shunt. La saturation en O2 de l'OD est la moyenne de trois flux distincts: la VCS représente 30% du retour veineux chez l'adulte (40-50% chez le bébé) avec une SvO2 de 75-77%, la VCI représente 65% du retour veineux avec une SvO2 de 78% et le sinus coronaire 5% du retour avec une saturation de 25%. La saturation de l'OD et celle de l'AP sont donc normalement: 0.30 x 77% + 0.65 x 78% + 0.05 x 25% = 75%. La saturation de l'OG est la même que celle des veines pulmonaires, en moyenne 96% à l'air ambiant [3].
La thermodilution au moyen du cathéter artériel pulmonaire mesure le débit pulmonaire (Qp), alors les systèmes PiCCO mesurent le débit systémique (Qs); en présence de shunt, ils ne sont plus égaux. D'autre part, la recirculation de liquide froid à travers une CIA ou une CIV conduit à une sous-estimation du débit réel par la Swan-Ganz.
Shunt (Qp / Qs) = (SaO2 - SvO2) / (SaO2 - SapO2)
L'échantillonnage pour les saturations doit se faire en amont et en aval du shunt. La saturation en O2 de l'OD est la moyenne de trois flux distincts: la VCS représente 30% du retour veineux chez l'adulte (40-50% chez le bébé) avec une SvO2 de 75-77%, la VCI représente 65% du retour veineux avec une SvO2 de 78% et le sinus coronaire 5% du retour avec une saturation de 25%. La saturation de l'OD et celle de l'AP sont donc normalement: 0.30 x 77% + 0.65 x 78% + 0.05 x 25% = 75%. La saturation de l'OG est la même que celle des veines pulmonaires, en moyenne 96% à l'air ambiant [3].
La thermodilution au moyen du cathéter artériel pulmonaire mesure le débit pulmonaire (Qp), alors les systèmes PiCCO mesurent le débit systémique (Qs); en présence de shunt, ils ne sont plus égaux. D'autre part, la recirculation de liquide froid à travers une CIA ou une CIV conduit à une sous-estimation du débit réel par la Swan-Ganz.
| Shunts |
|
Un shunt présente 4 caractéristiques
- Sa direction (G-D non-cyanogène, D-G cyanogène)
- Sa taille (restrictif ou non-restrictif)
- La dilatation des cavités de réception
- L’augmentation ou la diminution du débit pulmonaire
Un shunt situé en amont des valves auriculo-ventriculaires provoque une surcharge de volume pour le VD, alors qu’un shunt situé au niveau ventriculaire ou artériel provoque une surcharge de volume pour le VG. L’augmentation chronique du débit pulmonaire accroit progressivement la PAP, ce qui provoque secondairement une hypertension pulmonaire et une surcharge de pression pour le VD.
Le shunt est défini par son rapport au débit systémique : Qp / Qs. La prise en charge vise à ramener ce rapport Qp/Qs le plus proche possible de 1:1 (Qp = Qs). Lors de shunt D-G cyanogène, le but n’est pas d’obtenir la SaO2 la plus haute possible, mais l’équilibre entre les deux circuits : le Qp doit assurer une SaO2 satisfaisante (souvent 75-85%) et le Qs un apport tissulaire normal (absence d’acidose métabolique).
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- BETTEX D, CHASSOT PG. Transesophageal echocardiography in congenital heart disease. In: BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1186-1212
- DUPUIS C, KACHANER J, PAYOT M. Cardiologie pédiatrique. Paris: Flammarion, 1991, 137-42
- JOFFE DC, SHI MR, WELKER CC. Understanding cardiac shunts. Pediatric Anaesth 2018; 28:316-25

