Caractéristiques
La prévalence de l’IM secondaire est de 30% après infarctus et de 20-28% chez les coronariens qui subissent des pontages aorto-coronariens [2,10,18]. L’IM d’origine ischémique est la traduction d’un problème ventriculaire et non valvulaire. Lorsqu’elle est modérée ou sévère, elle double la mortalité et quadruple le risque de défaillance ventriculaire [4]. Elle relève de plusieurs mécanismes différents (Figure 27.25) [14].
La prévalence de l’IM secondaire est de 30% après infarctus et de 20-28% chez les coronariens qui subissent des pontages aorto-coronariens [2,10,18]. L’IM d’origine ischémique est la traduction d’un problème ventriculaire et non valvulaire. Lorsqu’elle est modérée ou sévère, elle double la mortalité et quadruple le risque de défaillance ventriculaire [4]. Elle relève de plusieurs mécanismes différents (Figure 27.25) [14].
- Restriction asymétrique de la course systolique des feuillets (IM restritive, type IIIb) sur akinésie ou dyskinésie segmentaire de la paroi ventriculaire, entraînant un déplacement latéral et/ou apical d'un muscle papillaire. La tension excessive sur les cordages maintient le feuillet ou la commissure en-dessous du plan de coaptation en systole et la valve fuit obliquement du côté du feuillet atteint (Vidéo).
- Restriction symétrique sur cardiomyopathie dilatative d'origine ischémique avec dilatation importante du VG (IM restrictive, type IIIb). L'écartement des piliers tire les feuillets dans le ventricule et les maintient en-dessous du plan de coaptation en systole; la fuite mitrale est centrale (Vidéo).
- Bascule d'un ou des deux feuillets sur rupture ou ischémie papillaire; la rupture partielle ou totale d’un pilier entraîne un basculement de la commissure correspondante dans l'OG en systole (IM sur prolapsus, type II) et une régurgitation massive (Vidéo). La non-contraction d'un muscle papillaire en systole (ischémie) donne trop de longueur aux cordages; le point de coaptation des feuillets est alors éversé dans l'OG (IM type II) (Vidéo).
- Ischémie basale; l’ischémie des segments basaux du VG (paroi inféro- et postéro-basale) empêche l’anneau mitral de modifier sa forme en systole (contraction majoritairement postérieure et accentuation de la forme en selle) ; l'anneau s'aplatit et sa surface augmente de 14-20% par dilatation de sa partie postérieure, car la partie antérieure est fixée au trigone fibreux [1,15]. Le jet est en général central (IM fonctionnelle, type I) (Vidéo).
Vidéo: insuffisance mitrale secondaire sur dilatation du VG due à une cardiomyopathie ischémique avec akinésie antéro-latérale étendue entraînant une IM légèrement asymétrique.
Vidéo: insuffisance mitrale secondaire sur dilatation du VG due à une cardiomyopathie ischémique diffuse; l'IM est symétrique.
Vidéo: insuffisance mitrale massive sur rupture totale du muscle papillaire antérieur.
Vidéo: insuffisance mitrale sur prolapsus de la commissure antérieure par lésion ischémique du muscle papillaire antérieur.
Vidéo: insuffisance mitrale centrale fonctionnelle de type I.
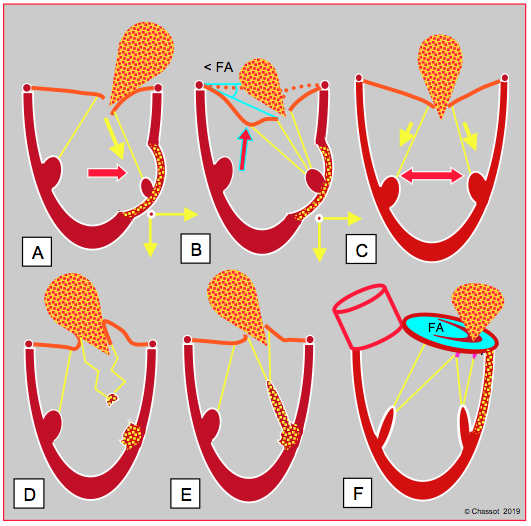
Figure 27.25 : Insuffisance mitrale ischémique. L’IM peut être de type IIIb restrictif (A, B et C), de type II prolapsus (D et E) ou de type I fonctionnel (F). A : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur et vers l’apex en systole ; le feuillet correspondant est restrictif ; l’IM est excentrique. B : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur avec une traction excessive sur les codages de 2ème ordre ; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. C : cardiomyopathie ischémique avec dilatation homogène du VG ; l’IM restrictive est centrale. D : la rupture partielle ou complète d’un pilier provoque un basculemrnt total de la commissure dans l’OG en systole ; on voit un morceau du pilier rompu oscillant au bout des cordages. E : ischémie d’un pilier occasionnant un prolapsus de la commissure correspondante parce que le pilier s’allonge au lieu de se contracter en systole. F : l'ischémie basale cause une dilatation postérieure de l’anneau mitral et une fuite centrale.
La fréquence respective des ces différentes formes est de 61% des cas pour l'IM restrictive (IIIb), 24% pour le prolapsus (type II) et 15% pour l'IM fonctionnelle (type I) [17]. La rupture totale de pilier (type II extrême) entraîne une IM si massive et un état de choc cardiogène si profond que 50-75% des malades décèdent avant d'atteindre la salle d'opération. La rupture concerne le pilier postérieur dans les trois quarts des cas parce que sa vascularisation uniquement par l'interventriculaire postérieure (issue de la CD ou de la CX) est plus fragile que celle du pilier antérieur, vascularisé par l'IVA et la CX (voir Figure 26.24) [7].
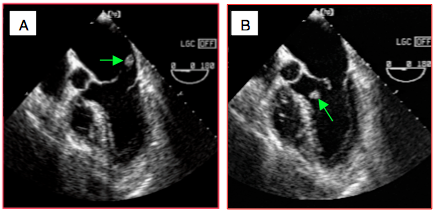
Figure 26.24 : Rupture ischémique totale d'un muscle papillaire. On aperçoit un fragment de pilier à l’extrémité de cordages, flottant dans l’OG en systole (A) et dans le VG en diastole (B). L’orifice de régurgitation est si grand et la dysfonction du VG si profonde que la Vmax de l’IM est basse (1-1.5 m/s) ; le flux Doppler couleur est laminaire en diastole et en systole, seule sa couleur change.
L’ischémie du pilier n’est pas en soi la seule cause de l’IM, et peut même la corriger (Figure 27.25E). En effet, lorsque le pilier est ischémique, il s’allonge au lieu de se contracter en systole à cause de la tension sur les cordages ; ceci donne davantage de course à ces derniers, et le feuillet se rapproche du point de coaptation dont il était maintenu éloigné par l’akinésie pariétale [11].
Il est important de distinguer une restriction du feuillet postérieur et un prolapsus du feuillet antérieur, car leur traitement est très différent. Dans les deux cas, le jet de l’IM est excentrique et dirigé vers la paroi latérale et postérieure de l’OG, par-dessus le feuillet postérieur. En cas de prolapsus (IM type II), le feuillet antérieur est basculé dans l’OG en systole, alors que le feuillet postérieur se situe au plan de coaptation. Dans la restriction (IM type IIIb), le feuillet antérieur est au plan de coaptation mais le feuillet postérieur est retenu en dessous de celui-ci par traction sur les cordages en systole (Figure 26.45).
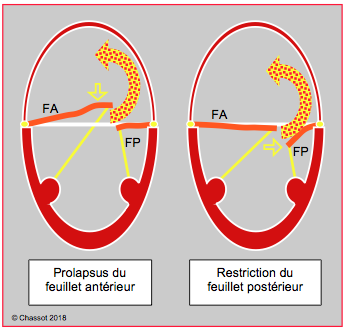
Figure 26.45 : Insuffisance mitrale excentrique dirigée vers la paroi latéro-postérieure de l’OG ; elle peut être due à un prolapsus du feuillet antérieur (FA) ou à une restriction du feuillet postérieur (FP). Dans le premier cas, le feuillet antérieur est basculé en arrière du plan de l’anneau mitral (prolapsus vrai), alors que dans le second le feuillet postérieur est maintenu en dessous du plan de l’anneau (faux prolapsus). Dans les deux cas, le jet a la même direction.
Selon qu’elle déplace un pilier davantage vers l’extérieur ou vers l’apex, l’akinésie de la paroi induit des situations différentes (voir Figure 26.47) [9,10].
- Si l’ischémie segmentaire déplace le pilier vers l’extérieur, ce qui est fréquemment le cas pour le pilier postérieur, la tension est particulièrement grande pour les cordages de 2ème ordre du feuillet antérieur ; ceci crée une angulation dans le corps du feuillet qui prend une allure en aile de mouette (seagull sign) ; cette déformation est la cause principale de l’IM (voir Figure 26.44). La correction chirurgicale consiste en une section des cordages de 2ème ordre.
- Si l’ischémie déplace le pilier vers l’apex, ce qui le plus souvent le cas pour le pilier antérieur, la traction est plus homogène sur les cordages, mais l’angle de fermeture du feuillet antérieur est plus important.
- Si l’ischémie nécrose le point d’insertion d’un ou de plusieurs cordages, le feston correspondant de la valve prolabe dans l’OG en systole (Type II).
- Une nécrose complète du pilier aboutit à sa rupture et à une IM massive, habituellement accompagnée de choc cardiogène et d’OAP ; la Vmax de l’IM est basse (< 3 m/s) à cause de la grande taille de l’orifice et de la dysfonction du VG.
- Si la traction intraventriculaire est excessive sur un feuillet alors que l'autre reste en place, le jet d'IM est excentrique et peut être confondu avec celui d'un prolapsus du feuillet opposé (voir ci-dessus Figure 26.45).
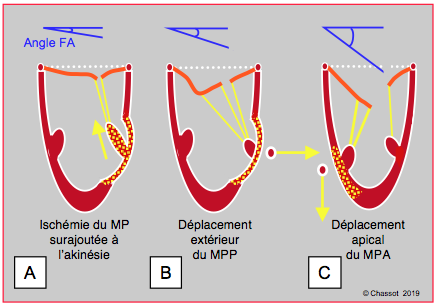
Figure 26.47 : Angle de fermeture du feuillet antérieur (FA) de la valve mitrale mesuré entre l’extrémité du FA et le plan de l’anneau mitral en systole. A : l’ischémie du pilier surajoutée à celle de la paroi donne davantage de course aux cordages et permet aux feuillets de se rapprocher de leur point de coaptation ; l’angle se referme et l’IM diminue. B: akinésie pariétale postérieure et déplacement externe du pilier postérieur ; la traction prédomine sur les cordages de 2ème ordre parce qu’elle est désaxée vers l’extérieur ; le feuillet antérieur est angulé en son centre et déformé en aile de mouette. C : akinésie pariétale antérieure et déplacement apical du pilier antérieur ; la traction prédomine dans le sens longitudinal et tire de manière homogène sur les cordages ; l’angle de fermeture est maximal. MPP: muscle papillaire postérieur. MPA: muscle papillaire antérieur.
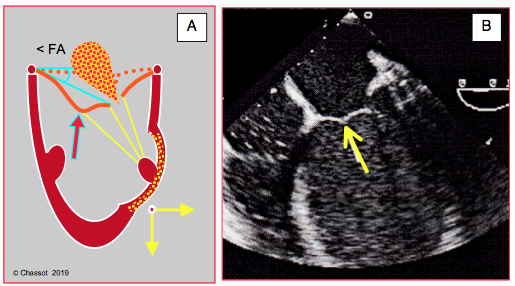
Figure 26.44 : Akinésie ou dyskinésie segmentaire entraînant le muscle papillaire vers l’extérieur avec une traction excessive sur les codages de 2ème ordre du feuillet antérieur dans une insuffisance mitrale ischémique; ceci se traduit par une image en aile de mouette du feuillet antérieur (flèches). < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. Dans l'image ETO, on voit clairement la dilatation sphérique du VG. La section chirurgicale des cordages de 2ème ordre peut être curative dans ce cas de figure.
Quantification
La caractéristique échocardiographique de l'IM restrictive est le maintien d'un ou des deux feuillets mitraux en-dessous du plan de l'anneau mitral en systole à cause de la traction excessive exercée par les cordages ancrés sur une paroi ventriculaire localement ou globalement dilatée. Le point de coaptation est situé à une certaine distance intraventriculaire du plan de l'anneau. Le triangle formé en systole par le plan de l'anneau et les deux feuillets ressemble à une tente (à l'envers en ETO mais à l'endroit en ETT); il détermine quelques paramètres permettant de quantifier le degré de déformation mitrale liée à la pathologie ventriculaire (Figure 27.26). Dans l'IM secondaire, l'anneau mitral est plus plat, il perd sa forme en selle et s'agrandit; il diminue son degré de rétrécissement et son coulissage vertical en systole [6]. La déformation est sévère lorsque les conditions suivantes sont remplies (mesures faites en mésosystole) [6,13,16,17].
- Diamètre de l'anneau > 4.0 cm (en vue long-axe 120-140°), surface de l'anneau > 12 cm2;
- Distance entre le point de coaptation et le plan de l'anneau: distance de tente (tenting distance) ≥ 1.1 cm (normal < 7 mm);
- Surface entre le plan de l'anneau et les feuillets mitraux: surface de tente (tenting surface) ≥ 2.5 cm2 (normale < 1.2 cm2);
- Volume entre le plan de l'anneau et les feuillets mitraux (3D): volume de tente (tenting volume) ≥ 3.5 cm3;
- Non-planarité de l'anneau > 150° (perte de la forme en selle);
- Angle du feuillet antérieur avec le plan de l'anneau > 20°;
- Angle du feuillet postérieur avec le plan de l'anneau > 30°.
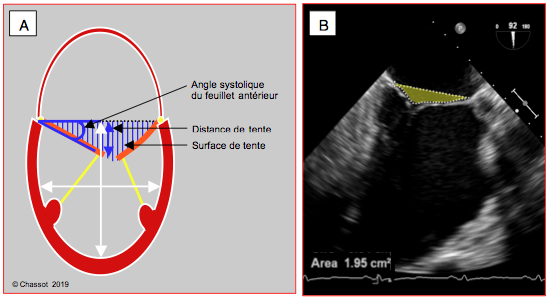
Figure 27.26 : IM restrictive (Type IIIb) sur dilatation du VG. A: Le degré de restriction est défini par la distance du point de coaptation au plan de l’anneau mitral (distance de tente, flèche bleue), la surface triangulaire comprise entre les feuillets et le plan de l’anneau (surface de tente), et l’angle de fermeture du feuillet antérieur mesuré entre le plan de l’anneau et l’extrémité du feuillet [16]. Le rapport des diamètres du VG en long axe et en court axe définit le degré de sphéricisation de celui-ci (rapport normal long-axe / court-axe : > 1.5). B: dessin de la surface de tente (1.95 cm2) en vue 4-cavités d'un VG dilaté et sphérique.
Ces mesures sont réalisées en vue mi-œsophage 4-cavités 0°, bicommissurale 60°, 2-cavités 90° et/ou long-axe 120°. Dans les IM ischémiques, la ligne de coaptation entre les feuillets conserve en général sa forme en croissant, puisque ces derniers sont normaux. Le PISA et la vena contracta ne sont plus de section circulaire mais reproduisent plus ou moins une fente. Leur diamètre tel qu'il est mesuré habituellement sous-estime considérablement leur importance car il suppose une symétrie circulaire. De ce fait, les critères de sévérité sont plus faibles, et l'IM secondaire est considérée comme sévère dès que la surface de l'orifice de régugitation (calculée par le PISA ou la vena contracta) est > 0.3 cm2 et le volume de régugitation > 30 mL. Au problème de la forme en croissant et non-circulaire de l'orifice de régurgitation s'ajoute l'atteinte ischémique ou fonctionnelle du VG que peut décompenser une IM même modérée. D'autre part, un diamètre de vena contracta ≥ 0.4 cm et une surface de régurgitation de ≥ 0.3 cm2 sont associés à une élévation de la mortalité [3]. Ces remarques justifient les seuils plus bas pour la définition de l'IM sévère lorsqu'elle est secondaire. Les critères de sévérité de l’IM ischémique sont donc plus restrictifs que ceux de l’IM organique primaire [10,19].
- Largeur du jet à la vena contracta > 0.4 cm;
- Surface de l’orifice de régurgitation ≥ 0.3 cm2;
- Rayon de 1er aliasing du PISA ≥ 0.7 cm (Valias 40 cm/s);
- Distance plan de l’anneau – point de coaptation > 1.1 cm;
- Angle feuillet antérieur – plan de l’anneau > 20° en systole;
- Volume régurgité ≥ 30 mL;
- Fraction de régurgitation ≥ 30%.
Pour rappel, les critères de sévérité de l'IM organique primaire sont les suivants: largeur du jet à la vena contracta > 0.7 cm, surface de l’orifice de régurgitation ≥ 0.4 cm2, rayon de 1er aliasing (PISA) ≥ 1 cm, volume régurgité ≥ 60 mL, fraction de régurgitation > 45%.
Toutefois, lorsque les mesures sont exécutées en 3D, on tend maintenant à prendre les mêmes critères de sévérité que pour les IM primaires, puisque la technologie tridimensionnelle permet la mesure réelle de l'orifice de régurgitation quelle que soit sa forme; elle est exempte des approximations géométriques utilisées en 2D [5,12].
Lorsque l’IM est un phénomène aigu et que l’OG est de taille normale, le reflux systolique dans les veines pulmonaires est massif (voir Figure 26.35).
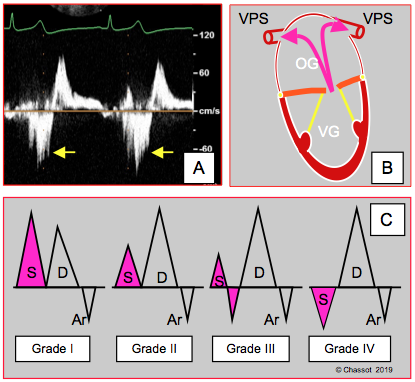
Figure 26.35 : Reflux systolique dans les veines pulmonaires. A : image spectrale au Doppler pulsé dans la veine pulmonaire supérieure gauche dans un cas d'IM sévère; les flèches indiquent le reflux systolique. B : les veines droites présentent moins d’angle que les veines gauches par rapport à l’axe d’une IM centrale symétrique. C : la composante systolique du flux veineux pulmonaire n’est pas modifiée par une trace d’IM, mais est diminuée dans une IM modérée, partiellement inversée dans une IM modérée-à-sévère et renversée dans une IM sévère ; ce reflux progressif n’existe pas si l’OG est dilatée et très compliante, si la fonction diastolique du VG est diminuée ou si la pression artérielle systémique est basse.
Les différents mécanismes de l’IM ischémique sont importants à diagnostiquer en salle d’opération, car ils modifient la technique de valvuloplastie (voir Chapitre 26, ETO et plastie mitrale). D’autre part, l’IM ischémique est un phénomène dynamique qui varie au cours du temps ; son augmentation sous stimulation sympathique est un facteur de mauvais pronostic [8]. Les IM secondaires sont particulièrement sensibles aux conditions hémodynamiques du patient; elles fluctuent avec la précharge, la postcharge et la fonction ventriculaire dans une bien plus grande mesure que les IM structurelles. Sous anesthésie, il est donc capital de les évaluer lorsque le malade est équilibré.
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
Toutefois, lorsque les mesures sont exécutées en 3D, on tend maintenant à prendre les mêmes critères de sévérité que pour les IM primaires, puisque la technologie tridimensionnelle permet la mesure réelle de l'orifice de régurgitation quelle que soit sa forme; elle est exempte des approximations géométriques utilisées en 2D [5,12].
Lorsque l’IM est un phénomène aigu et que l’OG est de taille normale, le reflux systolique dans les veines pulmonaires est massif (voir Figure 26.35).

Figure 26.35 : Reflux systolique dans les veines pulmonaires. A : image spectrale au Doppler pulsé dans la veine pulmonaire supérieure gauche dans un cas d'IM sévère; les flèches indiquent le reflux systolique. B : les veines droites présentent moins d’angle que les veines gauches par rapport à l’axe d’une IM centrale symétrique. C : la composante systolique du flux veineux pulmonaire n’est pas modifiée par une trace d’IM, mais est diminuée dans une IM modérée, partiellement inversée dans une IM modérée-à-sévère et renversée dans une IM sévère ; ce reflux progressif n’existe pas si l’OG est dilatée et très compliante, si la fonction diastolique du VG est diminuée ou si la pression artérielle systémique est basse.
Les différents mécanismes de l’IM ischémique sont importants à diagnostiquer en salle d’opération, car ils modifient la technique de valvuloplastie (voir Chapitre 26, ETO et plastie mitrale). D’autre part, l’IM ischémique est un phénomène dynamique qui varie au cours du temps ; son augmentation sous stimulation sympathique est un facteur de mauvais pronostic [8]. Les IM secondaires sont particulièrement sensibles aux conditions hémodynamiques du patient; elles fluctuent avec la précharge, la postcharge et la fonction ventriculaire dans une bien plus grande mesure que les IM structurelles. Sous anesthésie, il est donc capital de les évaluer lorsque le malade est équilibré.
| IM ischémique |
| Mécanismes: - Akinésie pariétale : traction asymétrique sur des cordages (IM type IIIb) - Cardiomyopathie ischémique avec dilatation ventriculaire (IM type IIIb symétrique) - Ischémie ou rupture partielle d’un pilier : prolapsus commissural (IM type II) - Ischémie des segments basaux : non-contraction de l’anneau (IM type I) - Rupture totale de pilier (choc cardiogène) Quantification de l'IM ischémique: - Distance de tente IM sévère: ≥ 1.1 cm - Surface de tente IM sévère: ≥ 2.5 cm2 - Angle feuillet antérieur IM sévère: ≥ 20° - Angle feuillet postérieur IM sévère: ≥ 30° - Vena contracta IM sévère: vena contracta > 0.4 cm - Orifice de régurgitation IM sévère: surface de l'orifice de régurgitation > 0.3 cm2 - Volume de régurgitation IM sévère: volume régurgité > 30 mL - PISA (rayon 1er aliasing) IM sévère: rayon 1er aliasing ≥ 0.7 cm (Valias 0.4 m/s) |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- GORMAN JH III, RYAN LP, GORMAN RC. Pathophysiology of ischemic mitral insufficiency: Does repair make a difference ? Heart Fail Rev 2006; 11:219-29
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GRIGIONI F, ENRIQUEZ-SARANO M, ZEHR KJ, et al. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation 2001; 103:1759-64
- JAIN P, FABBRO M. ACC Expert Consensus Decision Pathway on the management of mitral regurgitation: A review of the 2017 document fot cardiac anesthesiologist. J Cardiothorac Vasc Anesth 2019; 33:274-89
- KHABBAZ KR, MAHMOOD F, SHAKIL O, et al. Assessment of mitral annular geometry in patients with functional mitral regurgitation. Ann Thorac Surg 2013; 95:105-10
- LANCELLOTTI P, PRICE S, EDVARDSEN T, et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and Acute Cardiovascular Care Association. Eur Heart J Cardiovasc Imaging 2015; 16:119-46
- LANCELLOTTI P, TROISFONTAINES P, TOUSSAINT AC, et al. Prognostic importance of exercise-induced changes in mitral regurgitation in patients with chronic ischemic left ventricular dysfunction. Circulation 2003; 108:1713-7
- LEE AP, ACKER M, KUBO SH, et al. Mechanisms of recurrent functional mitral regurgitation after mitral valve repair in nonischemic dilated cardiomyopathy: importance of distal anterior leaflet tethering. Circulation 2009; 119:2606-14
- MAGNE J, SENECHAL M, DUMESNIL JG, PIBAROT P. Ischemic mitral regurgitation: A complex multifaceted disease. Cardiology 2009; 112:244-59
- MESSAS E, GUERRERO JL, HANDSCHUMACHER MD, et al. Paradoxic decrease in ischemic mitral regurgitation with papillary muscle dysfunction. Circulation 2001; 104:1952-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11:e007028
- OURY JH, CLEVELAND JC, DURAN CG, ANGELL WW. Ischemic mitral valve disease: classification and systemic approach to management. J Card Surg 1994; 9(suppl2):262-73
- RYAN L, JACKSON B, PARISH L. Regional and global patterns of annular remodeling in ischemic mitral regurgitation. Ann Thorac Surg. 2007 Aug;84:553-9
- RYAN L, JACKSON B, PARISH L. Quantification and localization of mitral valve tenting in ischemic mitral regurgitation using real-timew three-dimensional echocardiography. Eur J Cardiothorac Surg 2007; 31:839-4
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- WIERUP P, NIELSEN SL, EGELBLAD H, et al. The prevalence of moderate mitral regurgitation in patients undergoing CABG. Scand Cardiovasc J 2009; 43:46-9
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
