L'anamnèse, les facteurs de risque et la clinique n'ont malheureusement pas une très grande valeur prédictive pour diagnostiquer un syndrome coronarien aigu, pas plus que la réponse de la douleur à la nitroglycérine [17].
Modifications électriques
Dans les secondes qui suivent une occlusion coronarienne, le potassium fuit par les canaux KATP et s'accumule dans le tissu interstitiel, d'où il n'est pas éliminé puisqu'il n'y a localement plus de flux sanguin. Le gradient transmembranaire de K+ diminue, et la zone se dépolarise. Le potentiel transmembranaire négatif de la diastole faiblit et la région devient plus positive que le voisinage; le courant s'établit de la zone ischémique vers les tissus normaux. Ce phénomène apparaît dès que le flux baisse de plus de 20% [30]. En systole, l'ischémie diminue l'amplitude du potentiel d'action et raccourcit sa durée, si bien que la zone ischémique est plus négative que l'entourage; le courant passe alors de la zone saine vers la zone ischémique; sur le tracé de surface, il apparaît une surélévation du segment ST (Figure 9.11). Lors d'ischémie sous-endocardique, ce courant s'éloigne des électrodes de surface, et donne lieu à une image de sous-décalage du segment ST.
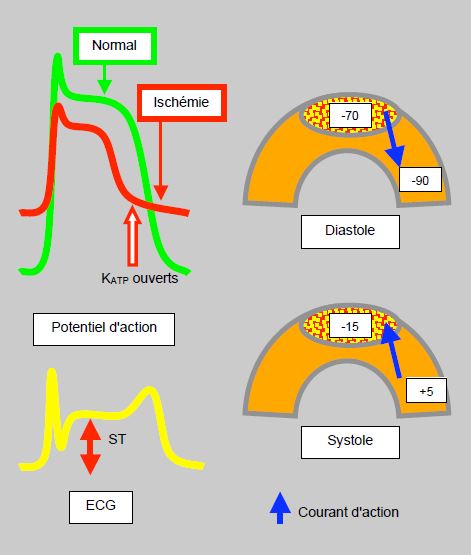
Figure 9.11 : Modifications ischémiques du potentiel d'action et de l'ECG de surface. En cas d'ischémie (trait rouge), le potentiel de repos est moins négatif; la dépolarisation est moindre, et le retour au potentiel de repos est plus rapide. En diastole, la dépolarisation ischémique donne lieu à une valeur moins négative dans la zone ischémique (zone pointillée rouge et jaune); le courant d'action va alors de la zone ischémique vers les zones saines. En systole, la zone ischémique est plus négative que son entourage, et le courant d'action va des régions saines vers la zone ischémique, ce qui se traduit par une surélévation du segment ST [d'après réf 30 et 39].
Le degré de modification ST considéré comme significatif varie selon les dérivations et les classes de patients, mais il doit être présent dans au moins 2 dérivations contiguës ; il se calcule au point J de l’ECG (Figure 9.12) [36,39].
- Sus-décalage ST au point J ≥ 0.2 mV (2 mm) en V2 et V3 ou ≥ 0.1 mV (1 mm) dans les autres dérivations (infarctus type STEMI) ; en V2-V3, le seuil est abaissé à 0.15 mV (1.5 mm) chez les femmes et surélevé à 0.25 mV (2.5 mm) chez les hommes < 40 ans.
- Sous-décalage ST ≥ 0.05 mV (0.5 mm) en V2 et V3 ou ≥ 0.1 mV (1 mm) dans les autres dérivations (angor instable ou infarctus non-STEMI); inversion de l'onde T et rapport R/S > 1.
- Les altérations du segment ST sont présentes dans 2 dérivations contiguës: antérieures (V1-V6), inférieures (II, III, aVF) ou latérales/apicales (I, aVL).
- Les obstructions de la circonflexe sont le mieux saisies en V7 (ligne axillaire postérieure) et V8 (ligne médio-scapulaire gauche).
- Les lésions droites sont visibles en V3R et V4R (surélévation ST > 0.05 mV).
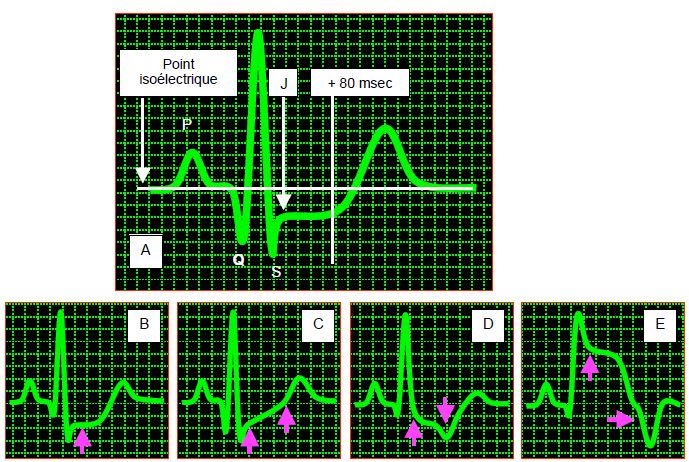
Figure 9.12: Sous-décalage du segment ST. A: Le sous-décalage est mesuré 80 msec après le point J par rapport à la ligne isoélectrique repérée dans l'espace PQ. En-dessous, formes variables du segment ST. B: sous-décalage horizontal. C: segment oblique ascendant. D: segment oblique descendant. E: sus-décalage.
L'importance et l'étendue de ces modifications sont proportionnelles à la masse tissulaire ischémiée. L'onde Q de nécrose apparaît 4 à 12 heures plus tard. Sa probabilité augmente avec la taille de l’infarctus et avec le nombre de segments transmuraux touchés.
L'importance du décalage du segment ST et le nombre de dérivations concernées traduisent l'étendue de la masse ventriculaire ischémiée. La présence ou l'absence d'onde Q ne sont pas assez fiables pour déterminer à elles seules si l'infarctus est transmural ou sous-endocardique [4]. Ce dernier ne présente des modifications typiques (sous-décalage ST, inversion de l'onde T) que dans 50% des cas vérifiés à l'autopsie. L'infarctus sans sur-élévation ST est plus fréquent chez les personnes âgées.
Comme l'ECG de repos est normal chez la moitié des patients ischémiques, il est habituel de le compléter par des tests plus pertinents (voir Investigations coronariennes).
- ECG de Holter sur 24-48 heures;
- ECG d'effort;
- Echocardiographie (voir Echocardiographie);
- Scintigraphie au thallium-dipyridamole;
- Echocardiographie de stress à la dobutamine;
- IRM et CT-scan;
- SPECT ou PET-scan;
- Coronarographie.
Imagerie
L'échocardiographie transthoracique met en évidence les altérations de la cinétique segmentaire (ACS), la fonction ventriculaire globale, le volume des cavités, et la présence d'éventuelles valvulopathies d'accompagnement. Les ACS apparaissent dès que la lésion dépasse les 20% de l'épaisseur de paroi myocardique. Le test actuellement considéré comme l'étalon-or est le PET-scan (Positron Emission Tomography), puisqu'il permet de différencier la viabilité du myocarde (le fluorodéoxyglucose est un traceur du métabolisme cellulaire) et les anomalies du flux coronaire (le rubidium met en évidence la perfusion locale). La technique demande une installation complexe et coûteuse ; elle est peu disponible et en passe d’être détrônée par l’IRM cardiovasculaire. Celle-ci permet de délimiter la zone infarcie, de quantifier le myocarde à risque, d'évaluer la viabilité tissulaire et d'identifier des hémorragies ou des cicatrices [10]. L'angio-CT offre une bonne résolution spatiale des plaques athéromateuses et des calcifications, mais il ne permet pas de distinguer un thrombus. En cas d'incohérence entre la clinique, l'imagerie et le laboratoire, c'est le taux de troponine et son évolution qui est déterminant pour le diagnostic [36].
L'échocardiographie transthoracique met en évidence les altérations de la cinétique segmentaire (ACS), la fonction ventriculaire globale, le volume des cavités, et la présence d'éventuelles valvulopathies d'accompagnement. Les ACS apparaissent dès que la lésion dépasse les 20% de l'épaisseur de paroi myocardique. Le test actuellement considéré comme l'étalon-or est le PET-scan (Positron Emission Tomography), puisqu'il permet de différencier la viabilité du myocarde (le fluorodéoxyglucose est un traceur du métabolisme cellulaire) et les anomalies du flux coronaire (le rubidium met en évidence la perfusion locale). La technique demande une installation complexe et coûteuse ; elle est peu disponible et en passe d’être détrônée par l’IRM cardiovasculaire. Celle-ci permet de délimiter la zone infarcie, de quantifier le myocarde à risque, d'évaluer la viabilité tissulaire et d'identifier des hémorragies ou des cicatrices [10]. L'angio-CT offre une bonne résolution spatiale des plaques athéromateuses et des calcifications, mais il ne permet pas de distinguer un thrombus. En cas d'incohérence entre la clinique, l'imagerie et le laboratoire, c'est le taux de troponine et son évolution qui est déterminant pour le diagnostic [36].
Modifications biologiques
Pour être spécifique, un marqueur de lésion myocardique doit être une molécule qui se trouve en haute concentration dans le cœur et en très faible concentration dans les autres organes [20]. Pour être sensible, il doit apparaître très tôt et en forte quantité dans le plasma, et sa valeur doit être proportionnelle à l’importance de la lésion myocardique. Plusieurs marqueurs sont utilisés en clinique, mais tous ont été supplantés par les troponines ultrasensibles (TnI-hs ou TnT-hs) (Figure 9.13) [26].
- Les troponines (voir ci-dessous) sont le pivot central du diagnostic des syndromes coronariens aigus. Une modification du taux de troponine pendant les 3 premières heures accompagnant des altérations ECG est considérée comme spécifique. Si, au contraire, les troponines restent dans une valeur normale pendant 3 heures chez un malade sans douleur et sans signe électrocardigraphique avec un score GRACE < 140 (voir ci-dessous), le diagnostic de N-STEMI peut être exclu [33].
- Le BNP (Brain natriuretic peptide) est libéré par les cellules ventriculaires en fonction de leur étirement ; il provoque une natriurèse, une diurèse, une baisse de la rénine et une vasodilatation artérielle et veineuse. Il est un mécanisme de rétroaction contre la surcharge. Son taux circulant est un critère fiable d’insuffisance ventriculaire, mais il n’est pas un marqueur de la souffrance ischémique [20].
- La myoglobine se trouve dans le cytoplasme des cellules musculaires et des myocytes ; dans ces deux localisations, la séquence des amino-acides est la même, donc l’origine est indissociable. L’ascension du taux de myoglobine est la première modification enregistrée lors de souffrance cellulaire myocardique, avec celle des Tn-hs ; elle survient 1-3 heures après la lésion (pic à 6-12 heures) mais elle est peu spécifique.
- Les créatine-kinases (CK) sont des enzymes répandus dans tous les tissus contractiles, qui agissent comme régulateurs de la production de phosphates à haute énergie. Les CK-MB, spécifiques pour le coeur, sont décelables dans les 4-6 heures après le début des symptômes (pic à 12-24 heures, disparition à 48-72 heures). La valeur maximale des CK-MB n’est pas corrélée à la taille de l’infarctus [15], mais leur élévation après angioplastie et chirurgie coronarienne a une valeur prédictive pour les complications cardiaques [8].
- Avec l'utilisation systématique des tetsts ultrasensibles pour les troponines, le dosage de la myoglobine et des CK-MB est tombé en désuétude [3].
- La copeptine, partie terminale du précurseur de la vasopressine, est sécrétée dans la neuro-hypophyse; son taux (> 10 pmol/mL) est un marqueur du niveau de stress biologique vécu par l'individu. Elle n'est spécifique ni du cœur ni de l'infarctus, mais sa présence confirme qu'un événement grave est en cours, ce qui est un élément important dans les 2 premières heures où les troponines ne sont souvent pas encore diagnostiques [17,42].
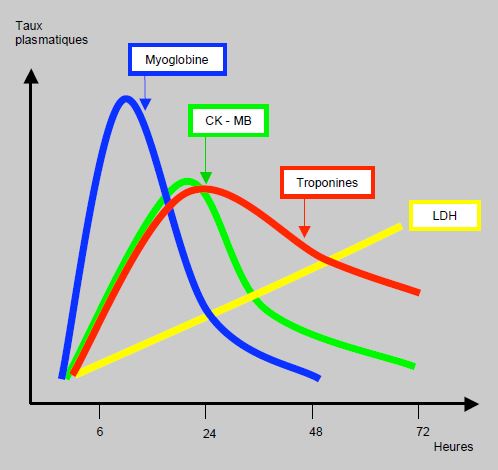
Figure 9.13 : Variations de la biologie sérique après infarctus du myocarde. La myoglobine est un marqueur précoce, mais actuellement supplanté par les troponines ultrasensibles dont le taux est altéré déjà 1 heure après la lésion. Troponines mentionnées dans le graphique: tests standards [d’après réf 20].
Pour un diagnostic efficace, les biomarqueurs doivent être intégrés dans un ensemble d'éléments cliniques, le plus souvent regroupés en indices quantifiés par un score. Parmi les nombreux scores imaginés comme aide au diagnostic, quatre sont le plus souvent utilisés (Tableau 9.3) [17].
- Score TIMI;
- Score de GRACE;
- Score de Goldman modifié: 8 critères valant chacun 1 point (douleur thoracique au repos, survenant de plus en plus fréquemment, durant > 60 minutes, ne cédant pas à la nitroglycérine, identique à celle d'un infarctus antérieur, apparaissant < 6 semaines après une revascularisation, hypotension, dyspnée);
- Heart score: 5 critères valant 0, 1 ou 2 points chacun (anamnèse, ECG, âge, facteurs de risque, taux de troponine).

Troponines
Les troponines (TnC, TnI et TnT) règlent la liaison Ca2+-dépendante de la tropomyosine avec l’actine et la myosine. La majeure partie du complexe des troponines est liée aux myofibrilles, mais une partie est libre dans le sarcoplasme. C’est cette dernière qui est responsable du pic sérique précoce de TnT (1-3 heures après la lésion, pic à 12-24 heures) ; les lésions structurales de myofibrilles sont responsables des taux tardifs (6-10 jours) [11]. La TnI ne présente pas cet aspect biphasique [1]. Les troponines sont le marqueur le plus spécifique de la nécrose myocardique (troponine I > 0.04 mcg/L, troponine T > 0.1 mcg/L, sensibilité 100% à 12 heures). L’ascension des troponines au-delà du 99ème percentile des valeurs enregistrées chez des individus sains est proportionnelle à l’importance du dommage myocardique, mais n’est pas spécifique de sa cause. Une modification du taux de > 3 fois la déviation standard est considérée comme significative.
Le développement de tests ultrasensibles (TnI-hs ou TnT-hs) permet maintenant de détecter des taux circulants infimes (1-3 ng/L), donc de poser un diagnostic plus précoce (1-3 heures après l'événement au lieu de 6 heures) [41]. Est considérée comme significative une variation de TnI-hs ou TnT-hs de 50-60% lorsque le taux est inférieur au 99ème percentile de la valeur de référence supérieure, ou de > 20% lorsque le taux est supérieur à cette dernière [22]. Une augmentation de 50-120% des TnT-hs dans les 3 premières heures accroît la sensibilité et la spécifité du test à presque 100% [1]. Ceci pousse à classer comme infarctus N-STEMI des cas qui étaient considérés comme angor instable avec les tests de routine [7]. Il n'y a pas à craindre un excès de sensibilité ni de faux-positifs, car toute élévation des troponines, quelle qu'elle soit, traduit une souffrance myocardique et une aggravation du pronostic [17]. Le taux de troponine est non seulement élevé en cas de souffrance myocardique, mais il est aussi fluctuant; même anormale, une valeur stable sur 3 heures signe une ischémie chronique et exclut un NSTEMI. Dans le postopératoire de chirurgie non-cardiaque majeure, environ 17% des patients présentent une élévation anormale des troponines-hs; leur morbi-mortalité cardiaque est directement associée à l'importance de cette variation [32].
Le développement de tests ultrasensibles (TnI-hs ou TnT-hs) permet maintenant de détecter des taux circulants infimes (1-3 ng/L), donc de poser un diagnostic plus précoce (1-3 heures après l'événement au lieu de 6 heures) [41]. Est considérée comme significative une variation de TnI-hs ou TnT-hs de 50-60% lorsque le taux est inférieur au 99ème percentile de la valeur de référence supérieure, ou de > 20% lorsque le taux est supérieur à cette dernière [22]. Une augmentation de 50-120% des TnT-hs dans les 3 premières heures accroît la sensibilité et la spécifité du test à presque 100% [1]. Ceci pousse à classer comme infarctus N-STEMI des cas qui étaient considérés comme angor instable avec les tests de routine [7]. Il n'y a pas à craindre un excès de sensibilité ni de faux-positifs, car toute élévation des troponines, quelle qu'elle soit, traduit une souffrance myocardique et une aggravation du pronostic [17]. Le taux de troponine est non seulement élevé en cas de souffrance myocardique, mais il est aussi fluctuant; même anormale, une valeur stable sur 3 heures signe une ischémie chronique et exclut un NSTEMI. Dans le postopératoire de chirurgie non-cardiaque majeure, environ 17% des patients présentent une élévation anormale des troponines-hs; leur morbi-mortalité cardiaque est directement associée à l'importance de cette variation [32].
Bien qu’elles ne permettent pas de faire la différence entre une ischémie et les dégâts de l’intervention chirurgicale elle-même, les troponines restent un bon indicateur d’infarctus en chirurgie cardiaque et non-cardiaque. Une élevation des troponines dans le postopératoire, même en dessous du niveau traduisant un infarctus, a une valeur prédictive positive de 80% pour une augmentation de la mortalité et de la morbidité postopératoires ; plus élevée est la valeur du pic, plus grande est la mortalité dans l'année qui suit [22,24,25,27]. Une simple élévation périopératoire des troponines sans angor ni modifications du segment ST double la mortalité à 4 ans [21]. Une variation du taux de CK-MB n'a pas autant de valeur prédictive. En chirurgie non-cardiaque, une ischémie myocardique postopératoire définie par les troponines à haute sensibilité est présente chez 8-19% des patients à risque intermédiaire et élevé après une opération majeure, bien que 58% d’entre eux ne remplissent pas les critères d’un infarctus et que 84% soient asymptomatiques [6,23,37]. Ils souffrent de ce qu’il est convenu d’appeler MINS (Myocardial Injury after Noncardiac Surgery) [6]. Cette souffrance myocardique sans traduction clinique ni électrocardiographique correspond toutefois à une pathologie bien réelle, puisqu'elle est associée à une péjoration significative du pronostic et à une augmentation de 3 fois de la mortalité (OR 2.9) (voir Ischémie et infarctus périopératoire) [29]. Chez les patients à risque ischémique, il est logique de doser les troponines avant une opération majeure et à 48/72 heures postopératoires.
Outre l'ischémie, de nombreuses autres causes de souffrance myocardique sont responsables d'une ascension du taux de troponines sans pour autant signifier un infarctus [1].
- Tachy-arythmie supraventriculaire; le raccourcissement de la diastole affaiblit l'apport d'O2 au myocarde.
- Défaillance ventriculaire; l'élévation des troponines est corrélée à une augmentation de la mortalité.
- Péricardite et myocardite; les Tn sont élevées dans 34-49% des cas. Il est possible que la cause en soit un vasopasme inflammatoire [43].
- Embolie pulmonaire; la dilatation et le stress de paroi infligé au VD par l'augmentation brusque de sa postcharge sont la cause d'une libération momentanée de troponine. Celle-ci est de mauvais pronostic puisqu'elle est associée à une mortalité 4 fois plus élevée qu'en son absence [18].
- Maladie de Takotsubo; l'élévation des troponines est très modeste, et disproportionnellement faible par rapport à la masse myocardique akinétique (TnT < 6 ng/mL, TnI < 15 ng/mL) [31].
- Sepsis; de multiples causes peuvent être responsables de l'élévation des troponines qui survient dans près de la moitié des patients en choc septique: déséquilibre DO2/VO2, hypoxémie, hypotension, anémie, endotoxines, cytokines, etc.
- Ictus; 18% des AVC s'accompagnent d'une élévation des troponines, probablement en rapport avec la tempête sympathique qui accompagne les accidents vasculaires cérébraux [14].
- Effort physique extrême; une fatigue myocardique analogue à la fatigue musculaire peut survenir immédiatement après un exercice sportif intense comme un marathon, et peut engendrer une augmentation passagère des troponines [34].
Diagnostic après revascularisation
Dans le postopératoire, les critères diagnostiques pour un infarctus sont souvent difficiles à remplir, vu que l'ischémie est en général silencieuse, que l'absence d'onde Q est fréquente et que les enzymes sont modifiées par la lésion chirurgicale. Le rapport des CK-MB aux CK totales peut d'ailleurs sous-estimer la lésion cardiaque vu l'élévation des CK suite à l'opération. Les critères actuellement recommandés suivent prioritairement l'évolution du taux de troponine. Le diagnostic d'infarctus est posé dans les cas suivants [36,39].
- Montée et descente typiques du taux de troponine (TnT-hs) avec un pic (> 10 fois la valeur du 99ème percentile) après l'acte chirurgical (en l'absence d'autre explication, telle une embolie pulmonaire), en combinaison avec l'un au moins des éléments suivants :
- Douleurs ischémiques (peu fréquentes).
- Apparition progressive d'onde Q pathologiques (≥ 30 ms dans 2 dérivations ECG contiguës).
- Modifications du segment ST (sus-décalage ≥ 1 mm, sous-décalage ≥ 1-2 mm) dans au moins 2 dérivations contiguës ; apparition d’un bloc de branche gauche.
- Inversion symétrique de l'onde T (> 1 mm).
- Nouvelles altérations de la cinétique segmentaire à l'échocardiographie (lésion impliquant > 20% de l'épaisseur de la paroi myocardique).
- Intervention sur les coronaires (thrombolyse, dilatation, pose de stent, pontage aorto-coronarien).
- Image coronarographique de thrombose de vaisseaux natifs, de stents ou de greffons.
- Infarctus aigu ou cicatrisé à la pathologie.
Alors que l’infarctus survenant en-dehors du contexte de la revascularisation est défini par la présence d’au moins une valeur de troponine au-delà du 99ème percentile de la limite de référence supérieure, le seuil diagnostique d’infarctus est déplacé à 5 fois cette valeur après PCI et 10 fois après pontages coronariens chirurgicaux; ces mesures sont réalisées pendant les premières 48 heures après la procédure [36]. Après pontage aorto-coronarien, la mortalité croît linéairement avec le taux d’enzymes postopératoires, aussi bien pour les CK-MB que pour les troponines [12,35]. Le risque relatif de mortalité passe de 3% (CK-MB 5-10 fois la norme) à 8.7% (20-30 fois la norme) et à 27% (> 40 fois la norme) ; pour les troponines, le risque de mortalité est de 2% lorsqu’elles sont augmentée de 20 fois, de 3.6% lorsqu’elles sont augmentées de 40 à 90 fois et de 11% au-delà de 100 fois [12]. Mais une élévation isolée de ≤ 10 fois la limite supérieure de référence (LSR) survient dans la majorité des patients qui subissent des pontages aorto-coronariens, notamment lorsqu'on teste les troponines à haute sensibilité (TnT-hs) [40]. Pour éviter une surestimation de l'infarctus, le taux de troponines considéré comme diagnostique a été relevé à > 70 fois la LSR en valeur isolée et de > 35 fois la LSR lors d'association avec une onde Q sur l'ECG [28]. Si la valeur préopératoire était déjà anormale, une élévation de > 20% est considérée comme diagnostique, pour autant que la valeur soit > 10 fois la valeur du 99ème percentile [36]. La traîtrise particulière de la situation postopératoire est l'aspect le plus souvent silencieux des épisodes ischémiques et des nécroses myocardiques.
Evaluation de la viabilité myocardique
Il est capital de déterminer si une zone myocardique est nécrosée et cicatricielle, auquel cas elle est irrécupérable, ou si elle souffre d’ischémie active mais est encore viable, situation où elle peut bénéficier d’une revascularisation rapide. Ce dilemme est particulièrement épineux lorsque le ventricule souffre de dysfonction sévère (FE < 0.35), parce qu’une revascularisation inutile est un risque sans bénéfice, alors qu’une revascularisation de myocarde viable améliore la fonction du VG et le pronostic du patient [2]. Sous-estimer la potentialité de récupération de segments myocardiques conduit à une revascularisation partielle, ce qui augmente les risques de complications cardiaques postopératoire (incidence 48%), alors qu’une revascularisation totale les diminue de presque 4 fois (incidence 14%) [38]. La récupération d’une hibernation est rapide, alors que celle de la sidération prend de 3 jours à quelques semaines.
Plusieurs techniques d’imagerie permettent de définir le degré de viabilité du myocarde et sa potentialité à récupérer après revascularisation [9].
- Le SPECT (single photon emission computed tomography au thallium 201 ou au technetium 99) et le PET (positron emission tomography au fluorodéoxyglucose) évaluent l’intégrité de la membrane cellulaire (201Tl et 99mTc) et le métabolisme myocardique (18F-FDG).
- L’échocardiographie de stress à la dobutamine ; une amélioration de la contraction sous dobutamine est un signe de viabilité.
- L’IRM avec injection de gadolinium ; ce dernier restant dans le liquide extracellulaire, il s’accumule dans les zones cicatricielles non viables.
Le PET-scan a la plus haute sensibilité et la plus grande valeur prédictive négative (95%), mais l’écho de stress et l’IRM/gadolinium la plus haute spécificité et la meilleure valeur prédictive positive (80%) [9]. Quels que soient les résultats de l'imagerie, c'est le taux de biomarqueurs et son évolution qui sont les éléments déterminants du diagnostic, car les techniques radiologique et échocardiographiques peuvent être leurrées par la sidération, l'hibernation, les cardiomyopathies ou les maladies infiltratives [16,36].
Plus la dysfonction ventriculaire est sévère, plus le bénéfice à long terme de la revascularisation est grand, même si le risque opératoire immédiat augmente [2]. Lorsque la FE est abaissée, revasculariser rapidement les zones viables donne de meilleurs résultats que le traitement médical, malgré le risque lié à l’intervention. Toutefois, le degré de remodelage et de dilatation du VG impose une limite ; lorsque son Dtd est > 7 cm (> 4 cm/m2), la revascularisation apporte moins de bénéfice [19].
| Diagnostic de l’ischémie myocardique |
|
Examens complémentaires
- Tests d’effort: ergométrie, écho de stress dobutamine
- Tests de perfusion myocardique: scintigraphie technetium ou thallium-dipyridamole
- Tests de viabilité myocardique: écho de stress, SPECT, PET-scan, IRM au gadolinium
- Coronarographie: scan multibarrette, angiographie
|
| Critères pour le diagnostic d’infarctus |
|
1) Ascension typique du taux de troponines ultrasensibles entre 1 et 3 heures après le début des symptômes, accompagnée d’au moins 1 des éléments suivants:
- Angor instable
- Sus-décalage ST de > 1 mm ou sous-décalage ST de > 2 mm dans ≥ 2 dérivations contiguës
- Onde Q à l’ECG
- Inversion symétrique de l’onde T
- Nouvelles ACS à l’échocardiograhie
2) Ondes Q apparues ultérieurement à l’ECG;
3) Intervention sur les coronaires;
4) Image coronarographique de thrombose;
5) Infarctus aigu ou cicatrisé à la pathologie.
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- AGEWALL S, GIANNITSIS E, JERNBERG T, KATUS H. Troponin elevation in coronary vs. non-coronary disease. Eur Heart J 2011; 32:404-11
- ALLMAN KC, SHAW LJ, HACHAMOVITCH R, et al. Myocardial viability testing and impact of revascularisation on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002; 39:1151-8
- ANDERSSON JL, MORROW DA. Acute myocardial infarction. N Engl J Med 2017; 376:2053-64
- ANTMAN EM, BRAUNWALD E. ST-elevation myocardial infarction: Pathology, pathophysiology, and clinical features. In: ZIPES DP, et al, eds. Braunwald's heart disease. A textbook of cardiovascular medicine, 7th edition. Philadelphia, Elsevier-Saunders, 2005, 1141-65
- ANTMAN EM, COHEN M, BERNINK PJ, et al. The TIMI risk score fur unstable angina/non-ST elevation myocardial infarction: a method for prognostication and therapeutic decision making. JAMA 2000; 284:835-42
- BOTTO F, ALONSO-COELLO P, CHAN MT, et al. Myocardial injury after noncardiac surgery: a large international prospective cohort study establishing diagnostic criteria: characteristics, predictors, and 30-day outcomes. Anesthesiology 2014:120:564-78
- BRAUNWALD E, MORROW DA. Unstable angina. Is it time for a Requiem ? Circulation 2013; 127:2452-7
- BRENER SJ, LYTLE BW, SCHNEIDERJP, et al. Association between CK-MB elevation after percutaneous or surgical revascularisation and three-year mortality. J Am Coll Cardiol 2002; 40:1961-7
- BUCKLEY O, DI CARLI M. Predicting benefit from revascularisation in patients with ischemic heart failure. Imaging of myocardial ischemia and viability. Circulation 2011; 123:444-50
- BULLUCK H, DHARMAKUMAR R, ARAI AE, et al. Cardiovascular magnetic resonance in acute ST-segment-elevation myocardial infarction: recent advances, controversies, and future directions. Circulation 2018; 137:1949-64
- CHAN MY, PRONOVOST PJ. Clinical utility of biomarkers in myocardial injury. Curr Opin Anesthesiol 2004; 17:49-55
- DOMANSKI MJ, MAHAFFEY K, HASSELBLAD V, et al. Association of myocardial enzyme elevation and survival following coronary artery bypass graft surgery. JAMA 2011; 305:585-91
- FOX KA, DABBOUS OH, GOLDBERG RJ, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ 2006; 333:1091
- FURE B, BRUUN WYLLER T, THOMMESSEN B. Electrocardiographic and troponin T changes in acute ischaemic stroke. J Intern Med 2006; 259:592-7
- GIBSON CM, MURPHY SA, MARBLE SJ, et al. Relationship of creatine kinase-myocardial band release to thrombolysis in myocardial infarction perfusion grade after intracoronary setnt placement: an ESPRIT substudy. Am Heart J 2002; 143:106-10
- GOEDDEL LA, HOPKINS AN, FERNANDO RJ, et al. Analysis of the 4th Universal Definition of Myocardial Infarction – Key concepts and perioeprative implications. J Cardiothorac Vasc Anesth 2019; 33:3486-95
- HOLLANDER JE, THAN M, MUELLER C. State-of-the-art evaluation of emergency department patients presenting with potential acute coronary syndromes. Circulation 2016; 134:547-64
- JIMENEZ D, URESANDI F, OTERO R, et al. Troponin-based risk stratification of patients with acute nonmassive pulmonary embolism: systematic review and metaanalysis. Chest 2009; 136:974-82
- JONES RH, VELASQUEZ EJ, MICHLER RE, et al. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med 2009; 360:1705-17
- KEMP M, DONOVAN J, HIGHAM H, HOOPER J. Biochemical markers in myocardial injury. Br J Anaesth 2004; 93:63-73
- KERTAI MD, BOERSMA E, BAX JJ, et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart 2003; 89:1327-34
- KIM LJ, MARTINEZ EA, FARADAY N, et al. Cardiac ptroponin I predicts short-term mortality in vascular surgery patients. Circulation 2002; 106:2366-71
- LADHA KS, BEATTIE WS, TAIT G, et al. Association between preoperative ambulatory heart rate and postoperative myocardial injury: a retrospective cohort study. Br J Anaesth 2018; 121:722-9
- LANDESBERG G, MOSSERI M, ZAHGER D, et al. Myocardial infarction following vascular surgery: The role of prolonged, stress induced, ST-depression type ischemia. J Am Coll Cardiol 2001; 37:1839-45
- LANDESBERG G, SHATZ V, AKOPNIK I, et al. Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term survival after major vascular surgery. J Am Coll Cardiol 2003; 42:1547-54
- LAPPAS GD, STAFFORD-SMITH M. Diagnosis of perioperative ischemia and infarction. In: HOWELL S, et al, Eds. Heart disease and the surgical patient. New York:Informa Healthcare, 2007, 161-96
- LEMANACH Y, PERREL A, CORIAT P, ET AL. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102:885-91
- MOUSSA ID, KLEIN LW, SHAH B, et al. Consideration of a new definition of clinically relevant myocardial infarction after coronary revascularization: an expert consensus document from the Society for Cardiovascular Angiography and Interventions (SCAI). J Am Coll Cardiol 2013; 62:1563-70
- OBERWEIS BS, SMILOWITZ NR, NUKALA S, et al. Relation of perioperative elevation of troponin to long-term mortality after orthopedic surgery. Am J Cardiol 2015; 115:1643-8
- OPIE LH, HEUSCH G. Pathophysiology. In: OPIE LH. Heart physiology. From cell to circulation. 4th edition. Philadelphia, Lippincott, Williams & Wilkins 2004, p 525-98
- PILGRIM TM, WYSS TR. Takotsubo cardiomyopathy or transient left ventricular apical ballooning syndrome: a systematic review. Int J Cardiol 2008; 124:283-92
- PUELACHER C, LURATI BUSE G, SEEBERGER D, et al. Perioperative myocardial injury after noncardiac surgery: incidence, mortality, and characterization. Circulation 2018; 137:1221-32
- ROFFI M, PATRONO C, COLLET JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2016; 37:267-315
- SHAVE R, GEORGE KP, ATKINSON G, et al. Exercise-induced cardiac troponin T release: a meta-analysis. Med Sci Sports Exerc 2007; 39:2099-106
- THIELMANN M, SHARMA V, AL-ATTAR N, et al. ESC Joint Working Groups on Cardiovascular Surgery and the Cellular Biology of the Heart Position Paper: peri-operative myocardial injury and infarction in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2017; 38:2392-411
- THYGESEN K, ALPERT JS, JAFFE AS, et al. Fourth universal definition of myocardial infarction (2018). J Am Coll Cardiol 2018; 72:2231-64
- VAN WAES JA, NATHOE HM, DE GRAAFF JC, et al. Myocardial injury after noncardiac surgery and its association with short-term mortality. Circulation 2013; 127:2264-71
- VOCI P, BILLOTTA F, CARETTA Q, et al. Low dose dobutamine echocardiography predicts the early response of dysfunction myocardial segments to coronary artery bypass grafting. Am Heart J 1995; 129:521-6
- WAGNER GS, MACFARLANE P, WELLENS H, et al. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogramm. Part VI: acute ischemia/infarction. J Am Coll Cardiol 2009; 53:1003-11
- WANG TK, STEWART RA, RAMANATHAN T, et al. Diagnosis of MI after CABG with high-sensitivity troponin T and new ECG or echocardiogram changes: relationship with mortality and validation of the Universal Definition of MI. Eur Heart J Acute Cardiovasc Care 2013; 2:323-33
- WESTERMANN D, NEUMANN JT, SÖRENSEN NA, et al. High-sensitivity assays for troponin in patients with cardiac disease. Nat Rev Cardiol 2017; 14:472-83
- WILDI K, ZELLWEGER C, TWERENBOLD R, et al. Incremental value of copeptin to highly sensitive cardiac troponin I for rapid rule-out of myocardial infarction. Int J Cardiol 2015; 190:170-6
- YILMAZ A, MAHRHOLDT H, ATHANASIADIS A; et al. Coronary spasm as the underlying cause for chest pain in patients with PVB19 myocarditis. Heart 2008; 94:1456-63
