ETO de la valve aortique normale
L’examen de la valve aortique se fait essentiellement dans 4 vues différentes (Figures 26.69 et 26.70) [18,21].
L’examen de la valve aortique se fait essentiellement dans 4 vues différentes (Figures 26.69 et 26.70) [18,21].
- Vue long-axe MO (120°). Selon le degré d’enfoncement de la sonde, on voit la chambre de chasse gauche (sonde profonde) ou l’aorte ascendante (sonde retirée) ; vue des cuspides coronaire droite (CD antérieure, à côté de la CCVD) et non-coronaire (NC postérieure, à côté de l’OG) ; parfois cuspide coronaire gauche (CG) au lieu de NC (postérieure, à côté de l’OG, avec départ du tronc commun). Le plan de coupe passe par le grand axe de la cuspide CD et presque le long de la commissure entre les cuspides NC et CG (voir Figure 26.71C). Dans ce plan, rien ne permet de différencier les cuspides CG et NC, sauf le départ du tronc commun s'il est visible. Le départ de la coronaire droite dans le sinus de Valsalva droit est en général facile à mettre en évidence (Figures 26.69A).
- Vue court-axe MO basal (40°, avec très léger pivotement horaire de la sonde). Vue des 3 cuspides et de leurs commissures ; la cuspide NC est située en regard du septum interauriculaire; départ du tronc commun dans le sinus de Valsalva CG; départ de la coronaire droite dans le sinus de Valsalva droit, le plus éloigné du transducteur sur l'écran (Figures 26.69B). Une petite surface triangulaire apparaît au centre en diastole en cas d’insuffisance modérée ou sévère. La meilleure technique pour obtenir une image correctement orientée sur le court-axe de la valve aortique est de partir de la vue précédente bien centrée sur les cuspides aortiques et de procéder à une rotation anti-horaire du capteur de 120° jusqu'à 40°.
- Vue long-axe TG (120°). Vue des cuspides CD (la plus éloignés) et CG ou NC (du côté de la valve mitrale). Alignement CCVG - valve aortique – aorte ascendante pour les mesures de flux Doppler (Figure 26.70B).
- Vue 5-cavités TG profonde (0°). Vue des cuspides CD (sur la gauche) et NC ou CG (du côté de la valve mitrale), souvent tronquée ; alignement CCVG - valve aortique – aorte ascendante pour les mesures de flux Doppler (Figure 26.70A). Ces deux vues TG 0° et 120°, parfois difficiles à obtenir, sont souvent mutuellement exclusives ; on obtient l’une ou l’autre selon la position et le remodelage du VG. Le taux d'échec pour l’alignement du flux et du Doppler est de l'ordre de 12% [20].
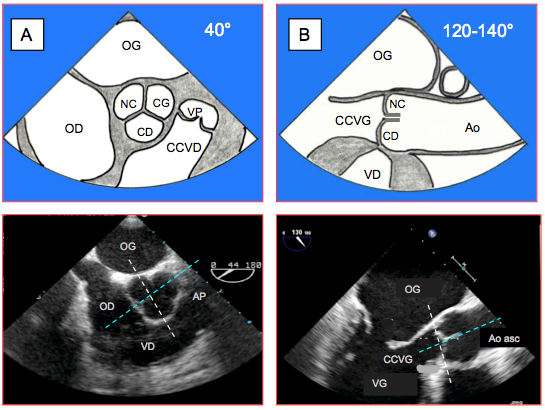
Figure 26.69 : Vues ETO mi-œsophage de la valve aortique (schéma en haut et image ETO en bas). A : vue court-axe basale rétrocardiaque mi-oesophage à 40°. B : vue long-axe 120° de la racine aortique. NC : cuspide non-coronaire. CG : cuspide coronaire gauche. CD : cuspide coronaire droite. VP : valve pulmonaire. CCVD : chambre de chasse du VD [2]. Sur l’image en court-axe (à gauche), le traitillé blanc représente l’intersection avec le plan à 120-140° ; sur l’image en long-axe (à droite), il représente l’intersection avec le plan à 40°. Le traitillé bleu est l’intersection avec le troisième plan, qui est un plan long-axe perpendiculaire à celui de l’ETO mais qui est situé en avant du capteur oesophagien (plan gauche-droit, coronal ou frontal) et qui n’intercepte pas ce dernier ; il n’est donc visible qu’en ETO tridimensionnelle.
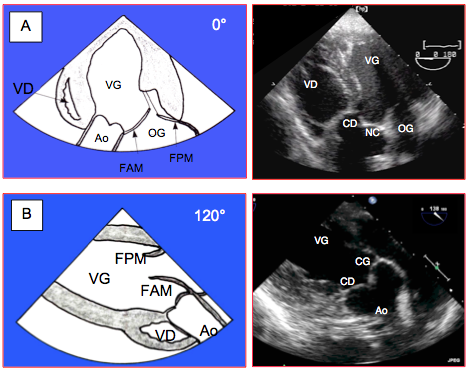
Figure 26.70 : Vues ETO transgastriques de la valve aortique. A : vue 5-cavités TG profond (0°) ; vue des cuspides coronaire droite (CD) et coronaire gauche (CG) ou non-coronaire (NC) ; alignement CCVG - valve aortique – aorte ascendante. B : vue long axe TG à 120°. Ces deux vues TG 0° et 120° présentent un bon alignement CCVG - valve aortique – aorte ascendante pour les mesures de flux Doppler. Elles sont parfois mutuellement exclusives ; on obtient l’une ou l’autre selon la position et le remodelage du VG.
Le plan qui intercepte le plus grand diamètre de l’anneau est un plan long-axe dit coronal ou gauche-droit, perpendiculaire au plan long-axe à 120°, coupant celui-ci selon le traitillé bleu dans la Figure 26.69. Ce plan frontal est irréalisable en ETO car il est situé en avant de l’œsophage et ne passe pas par le capteur de la sonde (Figure 26.71). Seule la reconstruction tri-dimensionnelle (ETO 3D) permet de le visualiser. La vue transgastrique profonde à 0° donne une vision voisine de ce troisième plan, mais ne lui est pas exactement co-planaire ; d’autre part, cette vue donne des images distantes et imprécises de la valve aortique. Elle n’est donc pas un substitut à la reconstruction 3D. La distance entre l’anneau et l’ostium coronarien droit est bien visible dans le plan 2D long-axe 120-140° (voir Figure 26.73), mais celle qui sépare l’anneau de l’ostium gauche (tronc commun) n’est pas accessible à l’ETO 2D, car elle se trouve précisément dans le plan coronal gauche-droit que l’on n’obtient qu’à l’écho 3D. La valeur moyenne de la distance entre l’anneau aortique et chaque ostium est de 13.5 mm [15].
Le plan ETO long-axe à 120-140°, où l’on mesure le diamètre de l’anneau aortique, coupe l’ovale de cet anneau dans son plus petit diameter (Figure 26.71). L’ETO bidimensionnelle sous-estime donc le diamètre réel de l’anneau aortique, et ceci pour deux raisons [16]:
- La vue mi-oesophagienne long-axe (120-140°) coupe l’anneau elliptique dans son petit diamètre (plan sagittal);
- Le plan de coupe ne passe pas par le centre de l’anneau mais un peu en avant de celui-ci.
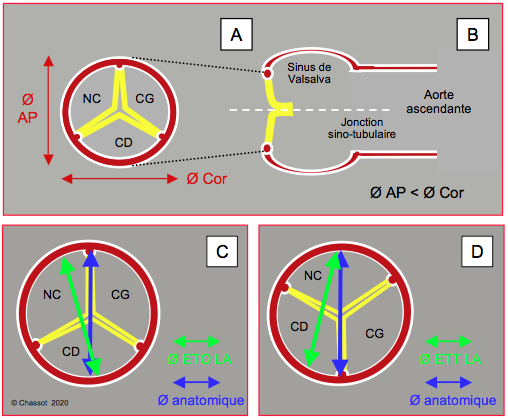
Figure 26.71 : Corrélation anatomo-échocardiographique des diamètres et des plans de coupe de la valve aortique. A: l’anneau aortique est elliptique, alors que l’aorte ascendante est circulaire. Le diamètre antéro-postérieur (Ø AP) est plus court que le diamètre gauche-droit ou diamètre coronal (Ø Cor). B : plan du diamètre coronal (traitillé blanc). C : le diamètre de l’anneau aortique tel qu’on le mesure en vue long-axe 120° (Ø ETO LA, en vert) à l’ETO est légèrement plus étroit que le diamètre anatomique (en bleu), parce qu’il ne passe pas par le centre de l’anneau. D : en vue transthoracique (ETT) parasternale long-axe, la différence est sensiblement plus marquée (Ø ETT LA, en vert) [7,18].
En systole, la surface d'ouverture de la valve aortique est de 3 - 4 cm2. A l'échocardiographie 2D, elle se calcule par la planimétrie en vue court-axe ou par l'équation de continuité (mesure des flux à travers la valve et à travers la CCVG en vue transgastrique long-axe ou 5-cavités) (voir Quantification de l'IA). La forme de cette ouverture se modifie au cours de l'éjection (Figure 26.72) [4].
- Circulaire en protodiastole, pendant le pic du flux (vélocité maximale); cette image surestime la surface d'ouverture moyenne.
- Triangulaire pendant ≥ 70% de la durée d'éjection.
- En étoile à 3 branches en télésystole, lorsque le flux devient faible.
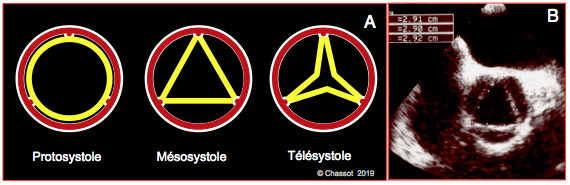
Figure 26.72 : Ouverture de la valve aortique en systole. A : sa forme et sa surface changent au cours de l’éjection. B : dimensions de la valve aortique dans sa forme mésosystolique triangulaire isocèle ; les dimensions affichées sont les longueurs de chacun des côtés. La forme triangulaire est celle adpotée pour la mesure du volume systolique (VS = surface d'ouverture x intégrale des vélocités), parce qu'elle est celle de la valve pendant la majeure partie de la systole [4].
La position des cuspides ouvertes est pratiquement parallèle au flux sanguin pendant l'éjection; le flux reste laminaire (vélocité 1.0 – 1.5 m/s) et le gradient est < 10 mmHg, parce que le diamètre change très peu entre la chambre de chasse, l'anneau aortique, les cuspides et la racine de l'aorte ascendante. L'écartement du bord libre des cuspides est de 2.0 – 2.2 cm. Les sinus de Valsalva représentent un renflement de 2-3 mm par rapport à l'anneau aortique. Leur présence permet d'éviter l'accolement des cuspides à la paroi de l'aorte pendant la systole. Si elles adhéraient à la paroi, les cuspides pourraient ne pas se refermer immédiatement en protodiastole; ce retard entraînerait constamment une fuite aortique. En diastole, la hauteur de coaptation des cuspides par leur bord libre est de 4-8 mm; c'est la pression diastolique aortique qui assure l'étanchéité en appuyant les cuspides l'une contre l'autre. Les mesures de diamètre de la racine aortique sont faites en systole, en ne prenant en compte que la plus grande valeur obtenue pour être sûr de couper le plus grand diamètre et non un diamètre tangentiel (Figure 26.73) (Tableau 26.5) [7,9,10,18].
- Diamètre de la chambre de chasse: 18-24 mm (mesure faite en protosystole dans les 5 premiers millimètres en-dessous de la valve aortique);
- Diamètre de l’anneau aortique: 18-25 mm (1.3 cm/m2);
- Diamètre des sinus de Valsalva: 21-39 mm (1.7 cm/m2);
- Diamètre de la jonction sino-tubulaire: 20-34 mm (1.5 cm/m2);
- Distance anneau aortique – jonction sino-tubulaire: 20-25 mm;
- Diamètre de l’aorte ascendante au niveau de l’artère pulmonaire droite: 22-35 mm (1.5 cm/m2); seule mesure effectuée en diastole. L'avantage de mesurer le diamètre de l'aorte ascendante en regard de son croisement avec l'AP droite est de déterminer le niveau de la mesure de manière claire et d'utiliser un repère accessible au chirurgien dans le champ opératoire.
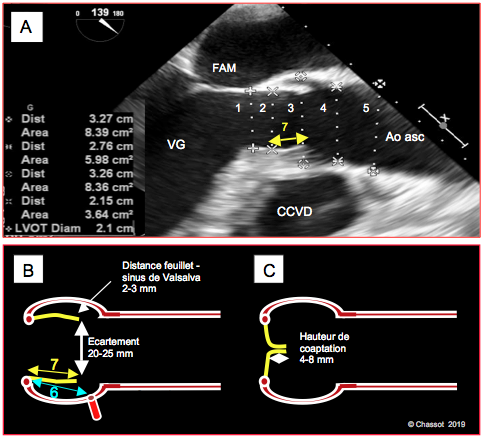
Figure 26.73 : Dimensions de la valve aortique et de la racine de l’aorte. A : diamètres en long axe 120° (ETO). 1 : chambre de chasse du VG. 2 : anneau aortique. 3 : sinus de Valsalva. 4 : jonction sino-tubulaire. 5 : aorte ascendante. Ces diamètres se mesurent en systole. Le diamètre de l’aorte ascendante se mesure en diastole; une manière claire de s'accorder sur le niveau de cette dernière mesure est de la faire au croisement de l’artère pulmonaire droite (non visible sur l’image). B : écartement des cuspides en systole (20-25 mm); elles ne sont pas collées à la paroi des sinus de Valsalva, mais distantes de 2-3 mm. 6 : distance entre l’anneau aortique et l’ostium coronarien droit ; 7 : hauteur de la cuspide droite (jaune) ; normalement, 6 est > 7. C : en diastole, la hauteur de coaptation du bord libre des cuspides est de 4-8 mm ; c’est la pression diastolique de l’aorte qui les maintient occluses.
Alors qu'elle est aisée en court-axe, la mesure du diamètre d'un conduit devient plus difficile en long-axe, car la position exacte de la coupe n'est jamais assurée. Si la racine de l'aorte est asymétrique et si les cuspides sont décalées, le plan de coupe long axe (100-140°) est certainement excentrique et la mesure erronée. De petits pivotements de la sonde et de légères rotation du capteur permettent de centrer le plan correctement (Figure 26.74).
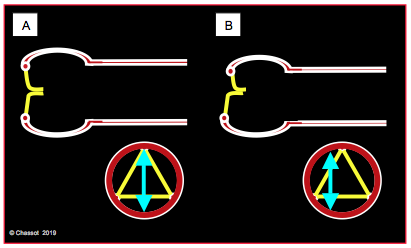
Figure 26.74 : Mesure des diamètres de la racine aortique. A: mesure du vrai diamètre; les structures sont symétriques, la coupe est bien centrée. B: mesure erronée; les structures sont asymétriques, la coupe est décentrée et la valeur mesurée plus petite que le diamètre réel.

Echo 3D
L'image la plus parlante est la reconstruction 3D "en face" de la valve aortique vue depuis l'aorte; la cuspide coronaire droite est l'élément le plus antérieur. Par découpes perpendiculaires à l'axe CCGV-aorte, on peut mesurer le diamètre et la surface de section de la CCVG et de l'anneau aortique, qui sont elliptiques et non circulaires, alors que l'écho 2D n'a accès qu'à la mesure du petit diamètre [13]. La planimétrie de l'ouverture valvulaire en systole et en diastole est réalisable dans 92% des cas [11].
Il est recommandé de procéder en plusieurs étapes pour l’imagerie 3D (Figure 26.75) [13,15].
- Centrer l’image de la valve en court-axe et en long-axe au milieu de l’écran (vues orthogonales X-plane); la qualité de l’image 2D détermine celle de la reconstruction 3D.
- Acquisition en mode full volume d’un volume contenant la CCVG, la racine aortique et le début de l’aorte ascendante, la zone d'intérêt étant centrée sur la valve aortique; l’enregistrement se fait en apnée.
- Orientation des plans transverse, sagittal et coronal sur le volume reconstruit.
- Coupe transverse passant par la partie la plus amont des cuspides (points d’articulation avec l’anneau aortique) ; l’anneau est de forme ovale.
- Mesure des diamètres de l’anneau dans le plan sagittal (petit diamètre) et coronal (grand diamètre).
- Mesure de la hauteur des cuspides.
- Mesure des distances entre l’anneau aortique et l’ostium droit (plan sagittal) et entre l’anneau et l’ostium gauche (plan coronal).
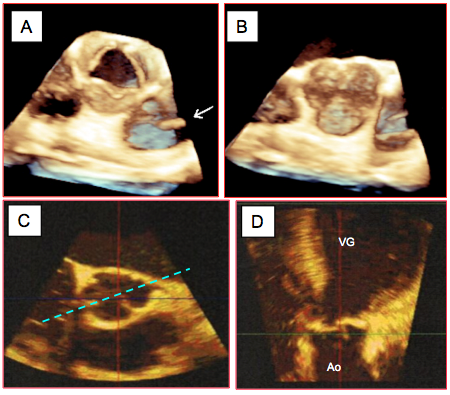
Figure 26.75 : Vues ETO 3D de la valve aortique. A: vue "en-face" depuis la racine de l'aorte en systole; cette vue correspond au court-axe 40°. B : même vue en diastole. La flèche indique la présence d'un cathéter pulmonaire dans l'AP. C : court-axe de l’anneau aortique (plan transverse); le traitillé indique le plan de coupe coronal. D : long-axe de l’anneau (plan coronal) ; ce plan n’est pas réalisable en ETO 2D.
De nouveaux algorithmes paramétriques divisent les cuspides et les parois en minuscules éléments quadrilatères finis dont la dimension, l'orientation et la déformation sont suivies au cours du cycle cardiaque. Ils peuvent reconstruire les structures de la racine aortique et y déterminer une série de mesures, telles la circonférence et les diamètres de l'anneau aortique, des sinus de Valsalva et de la jonction sino-tubulaire, ou encore la surface de coaptation, la hauteur des cuspides, la longueur de leur bord libre, la distance des ostia coronariens et le volume des sinus de Valsalva (voir Figure 26.82) [8,19].
| ETO de la valve aortique |
| La valve aortique est exaninée en ETO 2D dans 4 vues: - Vue court-axe mi-oesophage 40° - Vue long-axe mi-oesophage 120° - Vue transgastrique profonde 3-5 cavités 0° - Vue transgastrique long-axe 120° |
ETO 2D de l'insuffisance aortique
Par analogie à la classification de Carpentier pour les IM, les insuffisances aortiques sont classées en trois catégories selon la mobilité des cuspides et les dimensions de la racine aortique, la première étant suvdivisée en 4 groupes (Figure 26.76) [3,5,17].
- Type I : cuspides normales, dilatation de la racine aortique; jet d'IA central.
- Ia: dilatation de la jonction sino-tubulaire et de l'aorte ascendante;
- Ib: dilatation des sinus de Valsalva (racine aortique);
- Ic: dilatation de l'anneau aortique;
- Id: perforation d'une cuspide.
- Type II : excès de tissu et de mouvement d’une ou des cuspides, prolapsus; jet excentrique.
- Type III : mouvement restrictif des cuspides, fibrose, fusion commissurale, rétraction, calcifications; jet variable.
fig2676
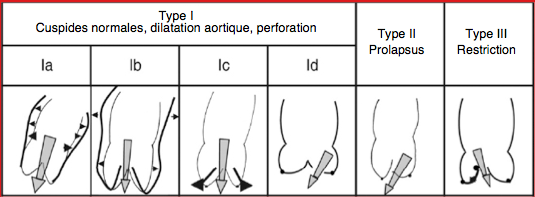
Figure 26.76: Les différents types anatomo-pathologiques d’insuffisance aortique classés selon le degré de mobilité des cuspides, avec l’illustration des mécanismes en cause [5].
L'examen de la valve s'accompagne de celui de la racine aortique et de ses dimensions (vue long-axe 120° et reconstruction 3D), qui permet de décrire plusieurs phénotypes différents dans le type I (mesures prises en télédiastole sauf pour l'anneau aortique qui est mesuré en méso-systole) [1,17].
- Dilatation de l'anneau aortique; diamètre normal: 2.1-2.3 cm chez la femme, 2.3-2.6 cm chez l'homme;
- Anévrysme de la racine aortique: diamètre au niveau des sinus de Valsalva > 4.5 cm;
- Anévrysme de l'aorte ascendante: diamètre > 5.0 cm;
- Non-coaptation des cuspides en vue long-axe 120°;
- Espace triangulaire résiduel en diastole au centre de la valve en vue court-axe 40°.
- Hypertrophie dilatative et sphéricisation du VG, dilatation modérée de l’OG (Vidéo);
- Dilatation de la racine de l’aorte (Vidéo);
- Altération modérée de la fonction systolo-diastolique du VG.
Vidéo: dilatation et hypertrophie excentrique du VG en cas d'insuffisance aortique majeure.
Vidéo: dilatation de la racine aortique entraînant une non-coaptation diastolique des cuspides dans un syndrome de Marfan.
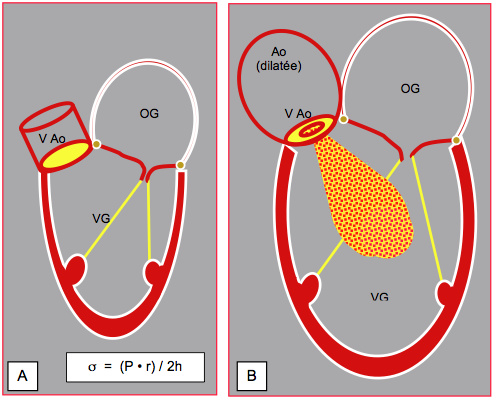
Figure 26.77 : Représentation schématique du remodelage des cavités gauches lors d'une insuffisance aortique sevère. A : cœur normal. La loi de Laplace indique que le stress de paroi (σ) est proportionnel à la pression générée (P) et au rayon de la cavité (r), et inversément proportionnel à son épaisseur (h). B : Insuffisance aortique sévère. L'oreillette gauche est dilatée, le VG subit une hypertrophie dilatative majeure, sa paroi est épaissie et sa cavité est très agrandie. L'IA chronique donne lieu aux plus importantes dilatations du VG, appelées autrefois "cœur de bœuf".
L'hypertrophie dilatative du VG est pathognomonique d'une IA chronique importante, au point que son absence permet d'exclure une insuffisance sévère. Toutefois, elle est absente dans les cas d'IA aiguë (endocardite, dissection A, traumatisme).
En imagerie bidimensionnelle, les lésions des cuspides présentent certaines caractéristiques (Figures 26.78 et 26.79) [12,21].
- Prolapsus ou déchirure d’une cuspide qui bombe dans la CCVG en diastole; la coaptation aortique, qui a normalement lieu du côté aortique de l’anneau, est déplacée en direction de la CCVG. En vue court-axe 40°, la cuspide qui prolabe présente un double contour sur son bord libre (Vidéos).
- Rétraction d’une ou plusieurs cuspides (vue long-axe 120°) (Vidéo).
- Défaut de coaptation central avec orifice de régurgitation triangulaire en diastole (vue court-axe mi-oesophage 40°) (Vidéo).
- Bombement diastolique du corps du feuillet antérieur de la valve mitrale dans l’OG ; lésion de jet (jet lesion) au point d’impact de l’IA sur ce feuillet antérieur (plaque fibreuse échodense).
- Vibration diastolique du feuillet antérieur de la valve mitrale due au jet de l’IA qui le lèche à vélocité élevée; cette vibration est à l'origine du roulement de Flint (Figure 26.80) (Vidéo).
Vidéo: prolapsus de la cuspide droite qui bascule dans la CCVG en diastole et occasionne une fuite excentrique.
Vidéo: déchirure de la cuspide droite prolabant dans la CCVG en diastole.
Vidéo: Non-occlusion de la valve aortique en diastole suite à une rétraction des cuspides (IA type III), en vue long-axe 120°.
Vidéo: vue court-axe 50° d'une insuffisance aortique par défaut de coaptation centrale.
Vidéo: roulement de Flint; si elle est dirigée vers l'extrémité du feuillet mitral antérieur, l'insuffisance aortique le fait vibrer en diastole.
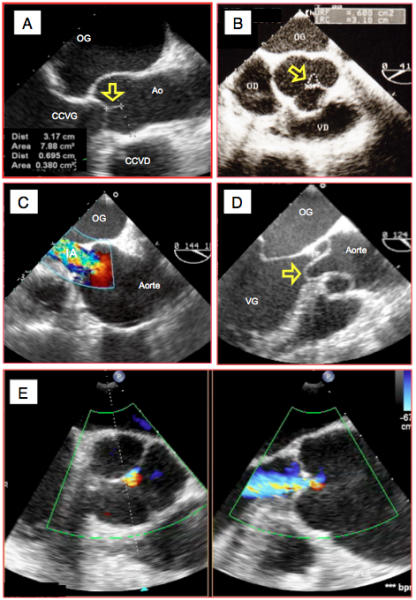
Figure 26.78 : Images bidimensionnelles d’IA: lésions de la racine aortique. A : hauteur normale de coaptation des cuspides aortiques (dans ce cas 7 mm). B : persistance d'un orifice triangulaire central en diastole lors de dilatation de l'anneau aortique; la surface de l’orifice (0.6 cm2) signe une IA sévère. C: syndrome de Marfan avec anévrysme de la racine de l'aorte et fuite aortique centrale majeure. D: membrane de dissection A protrudant en diastole à travers la valve aortique et enpêchant sa coaptation. E: vues simultanées en court-axe et en long-axe d'une insuffisance aortique modérée avec la technique 3D X-plane.
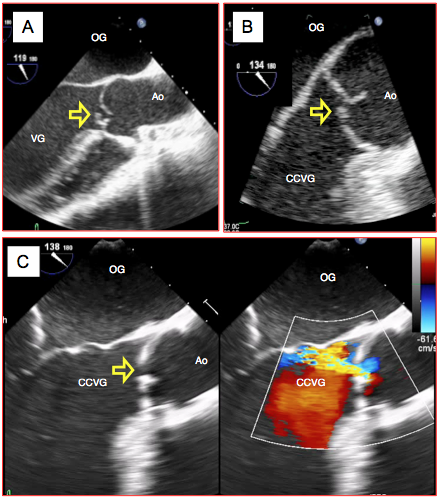
Figure 26.79 : Images bidimensionnelles d’IA: lésions des cuspides. A : prolapsus de la cuspide droite en vue long-axe. B : prolapsus de la cuspide coronarienne droite; la cuspide non-coronaire est bien en place, et sa zone de coaptation est normale. C : rétraction des cuspides dans un RAA laissant un orifice oblique; le flux couleur indique le passage de la régurgitation en diastole.
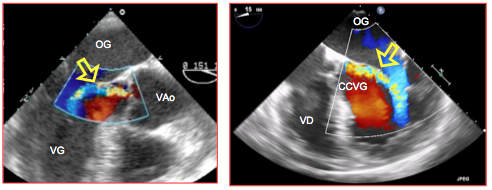
Figure 26.80 : Roulement de Flint. Le jet d'IA qui fuit dans la CCVG à haute vélocité (3-4 m/s) fait vibrer le feuillet antérieur de la valve mitrale (flèche); il est à l'origine du roulement de Flint, murmure diastolique audible au foyer mitral qui s'ausculte dans certains cas par-dessus le souffle diastolique de l'insuffisance aortique.
Insuffisance aortique aiguë
L'endocardite ou la dissection aortique peuvent conduire respectivement à une desctruction ou à une déstabilisation de la valve qui entraîne une IA massive aiguë. Le remodelage des cavités cardiaque est absent. La surcharge mixte de volume et de pression conduit rapidement à une profonde défaillance gauche. L'accroissement de la pression diastolique du VG provoque une fermeture prématurée de la valve mitrale et parfois une IM diastolique (Figure 26.81).
Vidéo: une endocardite aiguë peut détruire suffisamment la valve aortique pour occasionner une insuffisance massive qui remplit tout le VG en diastole.
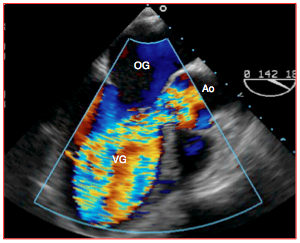
Figure 26.81 : Insuffisance aortique aiguë sur endocardite foudroyante. Le flux couleur montre que la régurgitation remplit la totalité du VG, repoussant la valve mitrale et bloquant le flux de remplissage diastolique normal. La survie de ce patient n'est pas possible sans un remplacement de sa valve en urgence.
ETO 3D de l'insuffisance aortique
A partir de vues orthogonales à 40° et 120° centrées sur la valve aortique, il est possible de reconstruire la structure en full-volume et d'y procéder à des découpes pour obtenir, par exemple, la vue "en-face" des cuspides comme si l'on y accédait depuis l'aorte. Il est ainsi aisé d'examiner leur forme, leur position ou leur mouvement, et de mesurer la surface de l'orifice de régurgitation qui subsiste en diastole. Ces informations sont précieuses avant la CEC en cas de plastie chirurgicale [12,14]. La reconstruction paramétrique des structures de la racine aortique permet de mesurer de manière semi-automatique la surface de coaptation, la hauteur des cuspides, la longueur de leur bord libre, la distance des ostia coronariens, le volume des sinus de Valsalva ou les dimensions de l'orifice de régurgitation (Figure 26.82) [8,19].
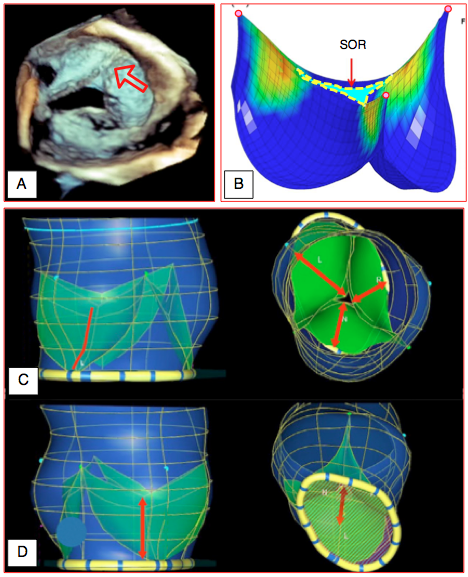
Figure 26.82 : Imagerie 3D en cas d'insuffisance aortique. A: dans un cas de biscuspidie (la flèche indique le raphé), l'image 3D "en-face" révèle avec clarté la dimension et la position de l'orifice valvulaire B: reconstruction paramétrique des cuspides et de la surface de l'orifice de régurgitation (SOR) dans une IA sévère; les zones colorées représentent les surfaces d'appui en diastole [d'après: Sohmer B, et al. Aortic valve cusp coaptation surface area using 3-dimensional transesophageal echocardiography correlates with severity of aortic valve insufficiency. J Cardiothorac Vasc Anesth 2018; 32:344-51]. C: hauteur des cuspides en reconstruction paramétrique de la racine de l'aorte. D: hauteur de coaptation [d'après: Khamooshian A, et al. Dynamic three-dimensional geometry of the aortic valve apparatus – A feasibility study. J Cardiothorac Vasc Anesth 2017; 31:1290-300].
L'imagerie 3D permet également de mesurer la surface de section réelle de la vena contracta (segment le plus étroit du jet d'IA juste en-dessous de la valve, voir Quantification de l'IA). La mesure à partir de son diamètre suppose que cette surface est circulaire, ce qui est rarement le cas. Un plan de coupe 3D perpendiculaire au jet par découpe au sein de la reconstruction full-volume permet au contraire d'évaluer la surface réelle de la VC quelle que soit sa forme et sans approximation géométrique [6]. En cas d'orifices multiples, les surfaces peuvent être additionnées.
| ETO de l'insuffisance aortique |
| L’échocardiographie permet de définir 3 types d’IA : - Type I : cuspides normales, dilatation de l’anneau aortique, jet central - Type II : excès de tissu et de mouvement d’une ou des cuspides, prolapsus, jet excentrique - Type III : mouvement restrictif des cuspides, calcifications, jet variable Toujours rechercher soigneusement une IA avant une opération en CEC, car elle peut causer une dilatation aiguë du VG pendant la cardioplégie ou la fibrillation ventriculaire, même si elle est minime. Caractéristiques bidimensionnelles de l’IA sévère - Non-coaptation centrale (orifice triangulaire en court axe 40°) ou bascule de cuspide(s), déchirure, orifice dans une cuspide, dilatation de la racine aortique - Vibration diastolique du feuillet antérieur de la valve mitrale - HVG dilatée, sphéricisation du VG |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BETTEX D, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie-réanimation. Paris, Masson, Williams & Wilkins, 1997, 454 p
- BOODHWANI MJ, DE KERCHOVE L, GLINEUR D, et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. J Thorac Cardiovasc Surg 2009; 137:286-94
- DARMON PL, HILLEL Z, MOGTADER A, et al. Cardiac output by transesophageal echocardiography using continuous-wave Doppler across th aortic valve. Anesthesiology 1994; 80:796-805
- EL KHOURY G, GLINEUR D, RUBAY J, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21
- FANG L, HSIUNG MC, MILLER AP; et al. Assessment of aortic regurgitation by live three-dimensional transthoracic echocardiographic measurements of vena contracta area: usefulness and validation. Echocardiography 2005; 22:775-81
- HAHN RT, ABRAHAM T, ADAMS MS, et al. Guidelines for performing a comprehensive transesophageal echocardiography examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2013; 26:921-64
- KHAMOOSHIAN A, AMADOR Y, HAI T, et al. Dynamic three-dimensional geometry of the aortic valve apparatus – A feasibility study. J Cardiothorac Vasc Anesth 2017; 31:1290-300
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LE POLAIN DE WAROUX JB, POULEUR AC, ROBERT A, et al. Mechanisms of recurrent aortic regurgitation after aortic valve repair. Predictive value of transesophageal echocardiography. JACC Cardiovasc Imaging 2009; 2:931-9
- MUKHERJEE C, HEIN F, HOLZHEY D, et al. Is real-time 3D transesophageal echocardiography a feasible approach to detect coronary ostium during transapical aortic valve implantation? J Cardiothorac Vasc Anesth 2013; 27:654-9
- MURARU D, BADANO LP, VANNAN M, ILICETO S. Assessment of aortic valve complex by three-dimensional echocardiography: a framework for its effective application in clinical practice. Eur Heart J Cardiovasc Imaging 2012; 13:541-55
- PATEL PA, FASSL J, THOMPSON A; et al. Transcatheter aortic valve replacement – Part 3: the central role of perioperative transesophageal echocardiography. J Cardiothorac Vasc Anesth 2012; 26:698-710
- PATEL PA, GUTSCHE JT, VERNICK WJ, et al. The functional aortic annulus in the 3D era: focus on transcatheter aortic valve replacement for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2015; 29:240-5
- PRODROMO J, D'ANCONNA G, AMADUCCI A, et al. Aortic valve repair fort aortic insufficiency: a review. J Cardiothorac Vasc Anesth 2012; 26:923-32
- ROBERTS JD, DHAWAN R, CHANEY MA, LANG RM. Aortic valve anatomy and assessment by transesophageal echocardiography. Anesth Analg 2013; 117:1286-90
- SOHMER B, JAFAR R, PATEL P, et al. Aortic valve cusp coaptation surface area using 3-dimensional transesophageal echocardiography correlates with severity of aortic valve insufficiency. J Cardiothorac Vasc Anesth 2018; 32:344-51
- STODDARD MF, HAMMONS RT, LONGAKER RA. Doppler transesophageal echocardiographic determination of aortic valve area in adult with aortic stenosis. Am Heart J 1996; 132:337-42
- VON HOMEYER P, OXORN DC. Aortic regurgitation: echocardiographic diagnosis. Anesth Analg 2016; 122:37-42
