En ventilation en pression positive (IPPV, Intermittent Positive Pressure Ventilation), les variations de la Pit proviennent des modifications du volume pulmonaire et non de celles de la cage thoracique. Pendant la phase inspiratoire, la Pit s’élève au-dessus de la Patm. En l’absence de PEEP (Positive End-Expiratory Pressure), la phase expiratoire correspond à une apnée, la Pit étant en équilibre avec la Patm. Il n’y a pas de phase de Pit négative (Figure 5.94). La pression ventilatoire (Pv) est transmise aux structures intrathoraciques proportionnellement à la compliance pulmonaire (diminuée en cas de BPCO, SDRA, œdème, etc). En inspirium, les cavités cardiaques sont comprimées par la Pit ; la Ptm qu’elles doivent fournir pour générer la même pression intracavitaire (Pic) diminue proportionnellement à la pression ventilatoire (Pv) :
Ptm = Pic - Pv
Pic = Ptm + Pv
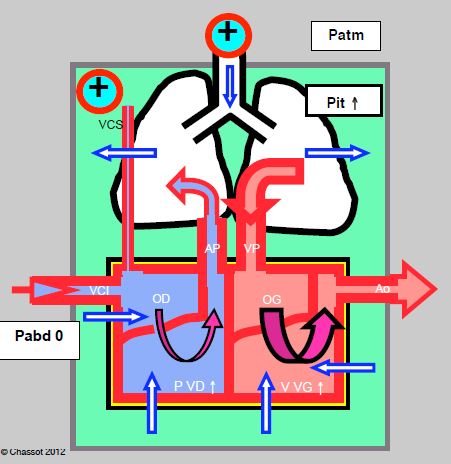
Figure 5.94 : Inspirium en ventilation en pression positive (IPPV). La situation est analogue à celle d'un Valsalva, mais la source de la pression positive est pulmonaire, contrairement à l’expirium spontané où la Pit monte à cause du mouvement de la cage thoracique. La transmission de cette pression de l’arbre trachéo-bronchique à travers le parenchyme pulmonaire est variable selon la compliance des poumons. Le retour veineux et l'éjection du coeur droit sont freinés et le flux pulmonaire diminue, alors que les poumons, comprimés de l'intérieur comme une éponge, remplissent le retour au coeur gauche. La précharge du VG augmente (augmentation du volume systolique), et la postcharge du VD s’élève (augmentation de pression intraventriculaire). La position du septum interventriculaire dépend du rapport de ces deux phénomènes. Pit : pression intrathoracique. Patm : pression atmosphérique. Ptm : pression transmurale. VCI : veine cave inférieure. VCS : veine cave supérieure. AP : artère pulmonaire. VP : veines pulmonaires.
Au niveau du cœur droit, l’inspirium en IPPV se caractérise par une gêne hémodynamique [13].
- Baisse du retour veineux à cause de l’augmentation de la POD (pression d’aval). La compression de l’abdomen par le diaphragme est passive et diminuée ; si le malade est curarisé, il n’y a plus de surpression abdominale à cause de la paralysie musculaire, ce qui accentue le frein au retour veineux par la VCI (baisse de la pression d’amont). Comme son trajet intrathoracique est très court, la VCI n’est pas influencée par la Pit mais seulement pas la Pabd ; or la VCI représente les 2/3 du retour veineux chez l’adulte.
- Augmentation de la postcharge du VD ; la surpression intrapulmonaire augmente la résistance à l’éjection du VD et contribue à la baisse de son volume systolique. La postcharge ventriculaire droite augmente de la valeur de la pression moyenne de ventilation (Pvm). Cependant, moins les poumons sont compliants, moins ils transmettent la Pv à l’ensemble de la cavité thoracique ; l’élévation inspiratoire de la Pit est donc moindre que celle de la Pv, ce qui diminue l’aide systolique apportée au VD par sa compression externe (diminution de Ptm). L’IPPV peut être dangereuse en cas d’insuffisance ventriculaire droite et/ou de BPCO sévère.
La situation est l’inverse au niveau du cœur gauche, puisque sa précharge est intrathoracique et sa postcharge extrathoracique [13].
- La précharge du VG augmente : les poumons sont comprimés comme une éponge, et la Pv augmente le gradient de pression qui génère le retour veineux pulmonaire vers l'OG. Moins les poumons transmettent la Pv à la cage thoracique, plus l’augmentation de précharge est importante puisque l’élévation de Pv (pression d’amont des veines pulmonaires) s’accompagne d’une moindre compression de l’OG (pression d’aval) par la Pit. Le flux mitral augmente de 10-30% [2]. Cet effet dépend du degré de remplissage de la circulation pulmonaire; il ne s'applique qu'à un volume circulant normal ou élevé; en cas d'hypovolémie, la pression ventilatoire provoque au contraire un collapsus vasculaire intrapulmonaire et une chute brutale de la précharge gauche; le poumon devient l'équivalent d'une zone I de West.
- L’éjection du VG bénéficie d'une Pit qui s'additionne à la Pic par compression externe; sa postcharge réelle diminue [11]. Si le VG développe une pression systolique de 120 mmHg et qu’il règne momentanément dans la cage thoracique une surpression de 20 mmHg, la pression mesurée au bras est de 120 + 20 = 140 mmHg ; pour fournir la même pression systolique en périphérie, le VG peut économiser 20 mmHg, donc sa postcharge effective baisse [6]. L’IPPV, et a fortiori la PEEP, constituent une véritable prothèse pour le VG. Leur sevrage, par contre, peut entraîner une défaillance gauche.
L’expirium de l’IPPV inverse ces conditions, mais la Pit n’est jamais subatmosphérique ; la situation est celle d’une apnée (voir Figure 5.91). Comme cette phase est normalement plus longue que celle de l’inspirium, les effets hémodynamiques globaux vont être tributaires de la Pit moyenne, qui est la moyenne par rapport au temps de toutes les pressions instantanées enregistrées au cours d'un cycle respiratoire. L’effet d’un cycle ventilatoire retentit sur plusieurs cycles cardiaques, vu le rapport de fréquence qui existe entre les deux.
La position du septum interventriculaire dépend du rapport entre l’augmentation de pression dans le VD (augmentation de postcharge) et l’augmentation de volume dans le VG (augmentation de précharge). Lorsqu'on ventile avec des volumes courants importants (VC 10-12 ml/kg) et que la Pv est significativement plus élevée que la Pit (faible transmission de la pression par les poumons en cas de SDRA, de BPCO ou d’emphysème), la Pic du VD augmente au point de le dilater et de produire un bombement du septum interventriculaire dans la cavité gauche (effet Bernheim) [1].
La PEEP
La pression positive télé-expiratoire (PEEP) accentue les effets de l’inspirium en IPPV, et les maintient en permanence ; la Pit moy reste constamment élevée. Avec des niveaux croissants de PEEP, le retour veineux est freiné et l’OD diminue de volume. Au-delà de 15 cm H2O, la postcharge du VD s’élève significativement, avec un risque de déplacement du septum interventriculaire vers la gauche (Figure 5.95). Si elle est normale, la fonction contractile du VD n’est pas altérée pour des valeurs de PEEP jusqu’à 20 cm H2O, bien que la vélocité du flux artériel pulmonaire diminue progressivement [7,10]. Toutefois, une PEEP de 10-12 cm H2O peut suffire à décompenser un VD insuffisant ou ischémique. Sa dilatation provoque un basculement vers la gauche du septum interventriculaire qui interfère avec le remplissage du VG. Une manœuvre de recrutement à 40 cm H2O provoque momentanément une dilatation du VD et un collapsus du VG. Par contre, la compression externe du VG étant une aide à son éjection, sa postcharge effective diminue. Le sevrage de la ventilation mécanique correspond à la perte de cette aide pour la fonction systolique gauche, et peut se solder par une défaillance du VG.
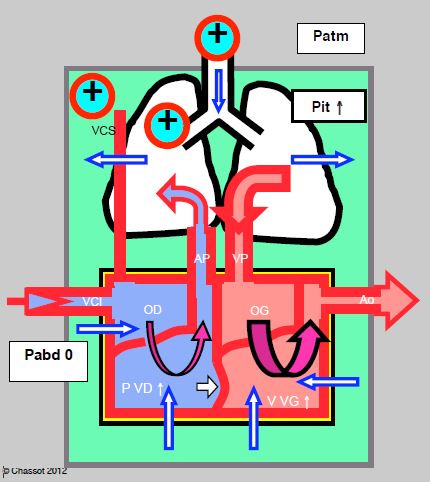
Figure 5.95 : Ventilation en pression positive avec PEEP. La Pit reste en permanence supérieure à la Patm. L'augmentation de postcharge du VD lors de PEEP élevée (> 15 cm H2O) se traduit par une augmentation du volume télédiastolique de ce dernier (dilatation sur élévation de la pression artérielle pulmonaire) ; cette agrandissement du VD peut faire bomber le septum interventriculaire dans le VG. Pit : pression intrathoracique. Patm : pression atmosphérique. Ptm : pression transmurale. VCI : veine cave inférieure. VCS : veine cave supérieure. AP : artère pulmonaire. VP : veines pulmonaires.
L’importance de ces effets est commandée par plusieurs facteurs: la volémie, la fonction ventriculaire préexistante, la dimension des ventricules, la qualité de la transmission de la pression par les poumons, le niveau de la PEEP. De plus, une augmentation du volume pulmonaire par la PEEP, particulièrement au niveau des segments basaux, accroît la pression de surface sur le péricarde, comprime le coeur et collabe la veine cave supérieure. Lorsque cette condition est associée à une hypovolémie (petits volumes cardiaques), la contrainte mécanique imposée par les poumons prédomine par rapport à la contrainte péricardique sur le remplissage diastolique du ventricule gauche [12]. Lorsque le volume télédiastolique est élevé, au contraire, la butée représentée par le péricarde est l’élément principal dans la limitation du remplissage gauche.
L’effet de la PEEP sur le retour veineux est plus complexe qu’une simple augmentation de la POD [4]. En effet, l’élévation de celle-ci s’accompagne d’une augmentation de la pression systémique de remplissage (PRSm) par un transfert de volume veineux depuis le compartiment fixe vers le volume veineux disponible (voir Figure 5.84) ; le mécanisme est une veinoconstriction sympatho-adrénergique. A cela s’ajoute un transfert de volume sanguin du lit pulmonaire vers le lit systémique et une augmentation de la pression abdominale. Le résultat est un maintien du gradient de pression global sur le retour veineux vers l’OD. Il est clair que l’hypovolémie bloque ces phénomènes.
Jusqu’à 15-20 cm H2O, la PEEP ne provoque aucun relargage de substances cardiodépressives et n’affecte pas la contractilité ventriculaire, mais elle déplace la courbe de Starling et la courbe du retour veineux vers la droite, d’une valeur correspondant à celle de l’augmentation de la pression intrathoracique moyenne (Figure 5.96) [3,5]. Le point auquel opère le VG est ainsi déplacé sur le plateau de la courbe du retour veineux. De ce fait, le débit cardiaque diminue, et ne varie pas avec une augmentation de la contractilité. Seul un remplissage liquidien supplémentaire permet de retrouver la valeur initiale du débit cardiaque ; à l’inverse, ce dernier est effondré lorsque la PEEP s’ajoute à une hypovolémie.
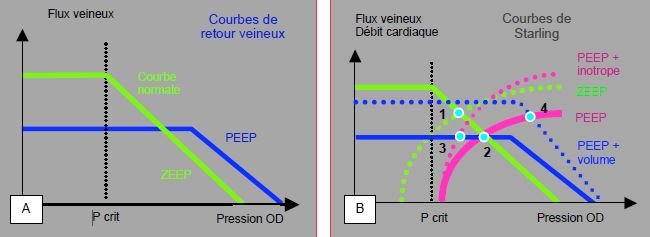
Figure 5.96 : Effet de la PEEP sur le retour veineux et le débit cardiaque (voir Figure 5.85). A : la PEEP (15-20 cm H2O) déplace la courbe normale du retour veineux (en vert, ZEEP) vers la droite et vers le bas (en bleu, PEEP), d’une valeur correspondant à celle de l’augmentation de la pression intrathoracique moyenne (Pitm). B : la PEEP déplace également la courbe de Starling normale (pointillé vert) vers la droite (trait violet) de la même valeur de Pitm. Le point auquel opère le VG (1) est ainsi déplacé sur le plateau de la courbe du retour veineux (2). De ce fait, le débit cardiaque diminue, et ne varie pas avec une augmentation de la contractilité (pointillé violet) (3). Seul un remplissage liquidien supplémentaire (pointillé bleu) permet de retrouver la valeur initiale du débit cardiaque (4) ; à l’inverse, ce dernier est effondré lorsque la PEEP s’ajoute à une hypovolémie. Dans ces données, qui concernent la situation où la fonction cardiaque est normale, la pression intracardiaque est mesurée par rapport à la pression atmosphérique [3,5].
Ces données concernent la situation où la fonction cardiaque est normale. En cas d’insuffisance ventriculaire, la courbe de Starling est aplatie, et la performance du ventricule ne s’améliore pas avec l’augmentation des pressions de remplissage ; seule une intervention inotrope positive permet de redresser la pente de cette courbe. Le ventricule insuffisant est toutefois très sensible à la postcharge : il augmente son volume systolique dès que celle-ci baisse. Or la PEEP a précisément pour effet de diminuer la postcharge effective du VG et augmenter celle du VD ; elle tend donc à améliorer le débit des patients en insuffisance gauche, mais péjore celui des malades en insuffisance droite. Le sevrage du ventilateur augmente la postcharge gauche mais baisse la postcharge droite ; il élève le retour veineux au cœur, ce qui augmente le volume télédiastolique des deux ventricules et peut dilater celui qui est insuffisant.
Facteurs associés
Le retentissement hémodynamique de l’IPPV est tributaire de la valeur du volume courant (6-15 mL/kg) et de celle de la PEEP (5-20 cm H2O). Mais il dépend encore de différents facteurs [9].
- La fonction ventriculaire préexistante ; l’IPPV aggrave une insuffisance ventriculaire droite mais soulage une insuffisance gauche.
- La transmission de la pression par les poumons ; cette transmission est atténuée de l’ordre de 40-70% en cas de pathologie pulmonaire. Plus l’atténuation est importante, plus la postcharge droite et la précharge gauche effectives augmentent. Ce phénomène n’intervient pas en respiration spontanée, puisque les variations de Pit sont dues aux mouvements de la cage thoracique et non aux variations de volume des poumons. En IPPV, c’est l’augmentation du volume pulmonaire et non celle de la pression des voies aériennes qui commande l’élévation de la Pit.
- L’hypovolémie aggrave les effets hémodynamiques de l’IPPV et de la PEEP ; la baisse du volume systolique effectif peut être compensée par du remplissage. Une variation de la PA > 15% en IPPV est un bon marqueur d’hypovolémie (voir ci-dessous) [8].
- L’ouverture de la cage thoracique réduit considérablement l’intensité des interactions cardio-respiratoires.
- Le rapport entre la Pit et la Pabd règle le retour veineux par la VCI.
- Le travail ventilatoire consomme normalement < 5% de la VO2 totale de l’organisme ; en cas de SDRA, cette valeur s’élève jusqu’à 25% ; la ventilation mécanique est souvent nécessaire pour soulager ce travail ventilatoire excessif [13].
| Interactions cardio-respiratoires: ventilation en pression positive (IPPV) |
|
Inspirium:
- ↑ pression intrathoracique (↑ volume pulmonaire)
- 0 pression abdominale
- ↓ pression transmurale des cavités cardiaques
- ↓ précharge du VD
- ↑ postcharge du VD, ↓ flux artère pulmonaire
- ↑ précharge du VG
- ↓ postcharge du VG, flux aortique
Expirium:
- ↓ 0 pression intrathoracique (PEEP: pression intrathoracique > 0)
- ↑ pression transmurale des cavités cardiaques
- ↑ précharge du VD
- ↓ postcharge du VD, ↑ flux artère pulmonaire
- ↓ précharge du VG
- ↑ postcharge du VG, ↓ flux aortique
L'IPPV est une aide à l'éjection du VG; son sevrage peut déclencher une insuffisance gauche.
L'IPPV peut décompenser une défaillance ventriculaire droite. Ces données présupposent que la Ptm de la VCI est > Pcrit (normovolémie). En normovolémie, les ΔPA systémique sont < 12%.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2019
Références
- AEBISCHER N, MALHOTTA R, CONNORS L, et al. Ventricular interdependence during Valsalva maneuver as seen by two-dimensional echocardiography: New insights about an old method. J Am Soc Echocardiogr 1995; 8:536-42
- FAEHRENRICH JA, HILTON AK, HAYWARD KA, et al. Respiratory variations in transmitral flow velocity: Effects of IPPV and changing tidal volume. Anesth Analg 1997; 84:SCA30(abstract)
- FEIHL F, BROCCARD AF. Interactions between respiration and systemic hemodynamics. Part I: basic concepts. Intensive Care Med 2009; 35:45-54
- FEIHL F, BROCCARD AF. Interactions between respiration and systemic hemodynamics. Part II: practical implications in critical care. Intensive Care Med 2009; 35:198-205
- JOHNSTON WE, VINTEN-JOHANSEN J, SANTAMORE WP, et al. Mechanism of reduced cardiac output during positive end-expiratory pressure in the dog. Am Rev Respir Dis 1989; 140:1257-64
- MARINI CE, LODATO RF, GUTTIEREZ G. Cardiopulmonary interactions in the cardiac patient in the Intensive Care Unit. Critical Care Clin 1989; 5:533-49
- MEIJBURG HWJ, VISSER CA, WESENHAGEN H, et al Transesophageal pulsed Doppler echocardiographic evaluation of transmitral and transpulmonary venous flow during ventilation with positive end-expiratory pressure. J Cardiothor Vasc Anesth 1994; 8:386-91
- MICHARD F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103:419-28
- PINSKY MR. Cardiovascular issues in respiratory care. Chest 2005; 128:592S-7S
- POLAERT JIT, VISSER CA, EVERAERT JA, et al. Doppler evaluation of right ventricular outflow impedance during positive-pressure ventilation. J Cardiothor Vasc Anesth 1994; 8:392-97
- ROBOTHAM JL, SCHARF SM. Effects of positive and negative pressure ventilation on cardiac performance. Clinics in Chest Medicine 1983; 4:161-87
- TAKATA M, ROBOTHAM JL. Ventricular external constraint by the lung and pericardium during positive end-expiratory pressure. Am Rev Respir Dis 1991; 143:872-5
- VISTISEN ST, ENEVOLDSEN JN, GREISEN J, JUHL-OLSEN P. What the amaesthesiologist needs to know about heart-lung interactions. Best Pract Res Clin Anaesthesiol 2019; 33:165-77
