Le retentissement cardiaque du clampage de l'aorte descendante et les importantes variations de volume nécessitent un monitorage complexe [11].
- Artère radiale droite (impératif, car la sous-clavière gauche peut être prise dans le clampage proximal): elle mesure le régime de pression entretenu par le VG en amont du clampage. Sphygmomanomètre et saturomètre sont placés au bras gauche.
- Artère fémorale droite (la gauche est occupée par la canule de CEC): elle mesure la pression de perfusion entretenue en dessous du clampage par le circuit de CEC partielle.
- Artère radiale gauche: utile pour vérifier le flux vertébral qui alimente proximalement la moelle.
- Cathéter pulmonaire de Swan-Ganz: PVC, PAPO, débit cardiaque, résistances artérielles périphériques, SvO2.
- Pendant le clampage aortique, les variations respiratoires de la pression de perfusion ou du VS (PiCCO) sont indépendantes du degré de remplissage et ne sont plus un signe interprétable d'hypovolémie [15].
- ETO: évaluation de l'aorte descendante, fonction ventriculaire gauche et droite, surveillance de la volémie et de l’ischémie, détection d’une dilatation ventriculaire sur excès de postcharge, d'un épanchement péricardique ou pleural droit (controlatéral). Vérification de la position de la canule veineuse de CEC (dans l'OD ou dans l'OG).
- Pression du LCR (cathéter intrathécal lombaire) et calcul de la pression de perfusion médullaire (PPm = PAMdist – PLCR). Les contre-indications sont les mêmes que pour toute ALR rachidienne: anticoagulation, antiplaquettaire, etc.
- Potentiels évoqués moteurs (PEM): monitorage de la colonne antérieure de la moelle. La sensibilité est modeste (environ 60%), mais la spécificité est > 98% et la valeur prédictive négative excellente. La curarisation doit être partielle pour pouvoir lire une réponse motrice (voir Protection médullaire, Monitorage) [3,4].
- Potentiels évoqués sensitifs (PES): ils sont sensibles à l'ischémie, mais ils explorent la colonne postérieure; une paraplégie (lésion de la colonne antérieure) peut survenir à leur insu. L'hypothermie et les halogénés en altèrent la lecture [1]. La sensibilité est très faible (< 40%), la valeur prédictive positive faible mais la valeur prédictive négative excellente (> 98%) (Figure 18.43) [10].
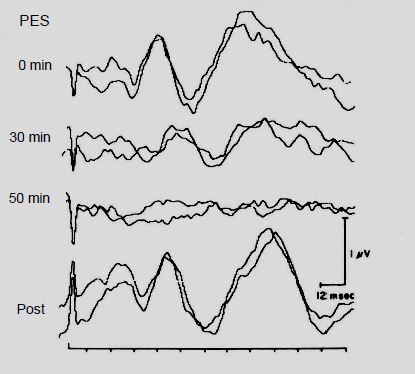
Figure 18.43 : Potentiels évoqués sensitifs (PES) enregistrés pendant un clampage aortique. Les temps correspondent à la durée du clampage [10].
L'utilisation des PEM et/ou des PES implique une adaptation de la technique d'anesthésie. Une anesthésie profonde (propofol, halogénés) perturbe le trafic nerveux sur les voies sensitives et motrices; il faut maintenir une anesthésie balancée minimale (etomidate, propofol, midazolam et fentanyl ou sufentanil) en ne dépassant pas 0.5 MAC d'halogéné. Les curares abolissent la réponse motrice des PEM; la curarisation doit donc être maintenue au maximum à ¼ au train-de-quatre. L'étomidate et la kétamine augmentent la réponse des potentiels évoqués et l'hypothermie les affaiblit [13]
La mise en place du drainage de LCR est réalisée avant d’endormir le malade: ponction lombaire L3-L4 ou L4-L5 avec une aiguille Tuohy 14G et introduction d’un cathéter de type péridural 16-17G en position sous-durale sur environ 10 cm [5,9]. Le cathéter est retiré graduellement en cas de paresthésies. Le cathéter est relié par un robinet 3-voies à un capteur de pression et à un système de drainage par gravité. Le remplissage du système est assuré par le LCR, mais on évite toute fuite externe qui décomprimerait prématurément le système nerveux central. Il est prudent de ne pas connecter au capteur un système de rinçage par flush pour éviter tout risque de surpression accidentelle. Le système n’est pas hépariné et n’est jamais rincé. On prélève du LCR par aliquot de 10-15 mL pour maintenir la pression à 10-12 mmHg, sans dépasser un débit maximal de 15 mL/heure [7,9]. Le niveau du capteur de pression est établi à celui de l’OD (voir Protection médullaire, Drainage du LCR).
Faut-il renvoyer l’intervention en cas de ponction hémorragique ? Si l’on admet que l’hémorragie intrarachidienne se tarit spontanément chez un individu dont la coagulation est normale, il est possible d’opérer après une deuxième ponction à un autre étage. L’héparinisation a lieu après un délai de plus de 2 heures, et l’utilisation de circuits héparinés autorise un dosage d’héparine de seulement 1 mg/kg, le même qu’en chirurgie vasculaire majeure. Mais la ponction est pratiquée avec une aiguille de grande taille, donc la lésion est potentiellement plus importante que dans les situations habituelles. D’autre part, l’opération s’accompagne de variations de pression intrarachidienne (élévation de la pression veineuse, drainage de LCR) qui peuvent favoriser une hémorragie secondaire. En l’absence de données chiffrées propres à cette situation, il est probablement prudent de renvoyer l’intervention de 24 heures en cas de ponction hémorragique lorsque la chirurgie est purement élective [14]. Toutefois, une menace de rupture anévrysmale peut forcer la main. Dans certains centres, on place le cathéter la veille de l'intervention [6,8].
Comme il faut rétracter complètement le poumon gauche, il est important de pouvoir assurer une ventilation monopulmonaire au moyen d'un tube à deux lumières (intubation bronchique gauche). Il est judicieux de placer le tube 2-lumières sous contrôle visuel direct par fibroscopie: un volumineux anévrisme peut comprimer la bronche souche gauche ou la carène et rendre l'intubation sélective gauche difficile, voire impossible. Si tel est le cas, il ne faut ni forcer ni insister; on change de technique et on utilise un tube monolumière avec bloqueur bronchique (Univent®) ou un tube 2-lumières droit, de manière à assurer le collapsus du poumon gauche. A la fin de l'opération, il est habituellement nécessaire de transtuber le patient avant de se rendre aux soins intensifs. L'intervention est fréquemment associée à un oedème de la face et de la glotte à cause du clampage aortique et de la stase veineuse. Il faut donc être très prudent, procéder à une laryngoscopie pour évaluer la situation locale avant de transtuber, et échanger impérativement le tube sur un long mandrin.
L'accès à l'aorte descendante se fait par thoracotomie postéro-latérale gauche (4ème-6ème espace intercostal), éventuellement prolongée en oblique sur l'abdomen (abord de l'aorte rétropéritonéale gauche par phréno-lombotomie). Le malade est installé en décubitus latéral droit partiel: le bras gauche est positionné comme pour une thoracotomie gauche classique, le thorax est tourné de 90° environ, la fesse gauche est surélevée (bassin incliné à 45°), les jambes sont en position neutre. Le chirurgien a ainsi accès au thorax et au pli inguinal gauche pour la canulation de CEC partielle. Les zones d’appui sont généreusement rembourrées.
L'anesthésiste doit être prêt à faire face à plusieurs problèmes peropératoires.
- Hémorragie (artères intercostales, viscère, sutures d'anastomoses);
- Perturbation de la coagulation (dysfonction plaquettaire, polytransfusions, fibrinolyse, ischémie digestive, endotoxémie);
- Dépression de la contractilité myocardique (dilatation du VG, excès de postcharge);
- Ischémie myocardique et arythmies;
- Acidose métabolique (ischémie viscérale);
- Vasoplégie.
La dilatation ventriculaire accompagnée d'une baisse brusque de la fraction d'éjection et de la vélocité de raccourcissement de paroi est une complication du clampage aortique qui est bien mise en évidence par l'ETO, bien plus performant que la Swan-Ganz pour ce monitorage. Sur le cathéter pulmonaire, l'apparition d'une onde "v" importante est pathognomonique mais tardive. Hormis la défaillance du VG, seule une augmentation simultanée et massive des résistances périphériques dans les deux circuits justifie la mise en route d'une perfusion de vasodilatateur. Le contrôle routinier de la pression est assuré par le réglage de la précharge au moyen du réservoir veineux de la CEC partielle (Tableau 18.8). D'une manière générale, il faut viser des valeurs de pression artérielle de 70 mmHg au-dessus du clamp et de ≥ 70 mmHg au-dessous. L’hypotension systémique est une des causes principales des séquelles neurologiques. Une PAM de 80 mmHg est recommandée dès le déclampage et le rétablissement de la normothermie [6].
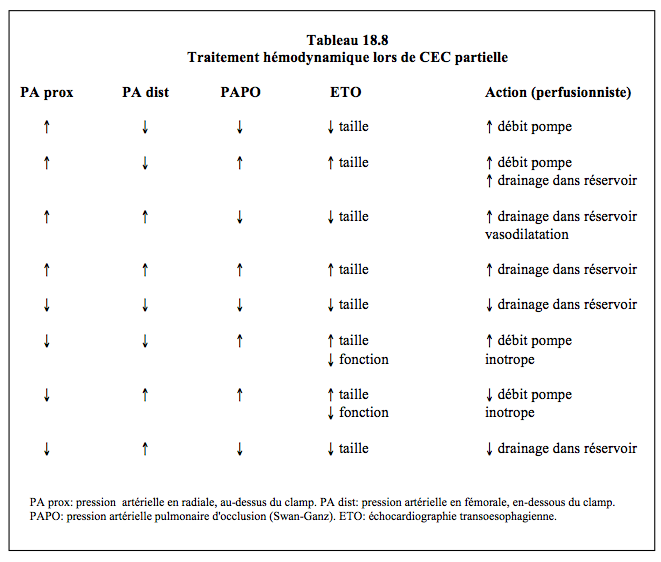
En cas de poussée hypertensive pendant la CEC, la première mesure est de stocker du volume dans le réservoir veineux en l'abaissant et en ouvrant le retour. Si cela ne suffit pas (ce qui est rare) et/ou que surviennent des signe d'ischémie myocardique, une perfusion de nitroglycérine est mise en route. On ne doit jamais utiliser de nitroprussiate. Une poussée hypertensive dans le circuit de la CEC en-dessous du clampage se maîtrise en baissant momentanément le débit de la pompe. En cas d'hypotension en amont, le premier geste est de freiner le retour veineux dans le réservoir de la CEC, ce qui augmente la précharge du coeur. Lors d'hypotension en aval, on augmente le débit de la pompe, au besoin en y rajoutant du perfusat (Tableau 18.9). L'administration de vasoconstricteur est une mesure de deuxième recours. Si la pression de perfusion médullaire baisse en dessous de 40 mmHg ou que la pression du LCR dépasse 15 mmHg, on draine du LCR par le cathéter intrathécal à raison d'aliquots de 10-15 mL jusqu'à normalisation (< 10 mmHg); il faut veiller à ce que la pression de la CEC soit normale (PAM ≥ 70 mmHg) pendant ce temps. Le but est de maintenir une pression de perfusion médullaire d'au moins 60 mmHg et une PLCR de ≤ 10 mmHg [7].

La surveillance régulière de la SvO2 dans la canule veineuse de la CEC et dans le cathéter pulmonaire décèle un bas débit pouvant mener à une acidose métabolique secondaire à l'ischémie viscérale. Avant le déclampage. l'anesthésiste doit se préparer à affronter une hypotension sévère. Pour ce faire, il doit avoir du volume de perfusion à disposition: poches de sang contrôlées et réchauffées, perfuseur rapide de type Level-1™, PFC dégelés, colloïdes, cristalloïdes, le tout déjà branché sur des voies veineuses de gros calibre. Momentanément, la FiO2 du ventilateur est réglée à 0.8-1.0.
La technique d'anesthésie la plus courante est une combinaison de fentanyl ou sufentanil et d'isoflurane, de sevoflurane ou de propofol. Alors que l'isoflurane est un vasodilatateur artériolaire, le propofol baisse essentiellement la précharge; ceci peut compliquer le prise en charge peropératoire de la volémie. Le vaporisateur du ventilateur et celui de la CEC doivent afficher la même concentration inspirée de gaz halogéné, sans quoi celui-ci entre par un circuit et ressort par l'autre. L'anesthésie combinée avec une péridurale est formellement contre-indiquée dans ce type d'intervention: toute adjonction de volume dans l'espace péridural très peu compliant peut induire une dangereuse augmentation de pression et diminuer d'autant la perfusion médullaire déjà compromise. De plus, l'appréciation du status neurologique per- ou post-opératoire est impossible.
Comme dans la chirurgie de la crosse, le maintien d'une stricte normoglycémie est impératif. En cas d'acidose métabolique sévère (ischémie digestive), l'addition de bicarbonate s'impose.
Postopératoire
La fragilité des tissus et des anastomoses oblige à maintenir la pression artérielle dans des valeurs assez basses, mais cependant assez élevées pour assurer une perfusion maximale des tissus qui ont été ischémiés [12]. Cet équilibre est souvent délicat à assurer. La crainte majeure est celle des séquelles neurologiques centrales. Il est important de réveiller et d'extuber les patients assez tôt pour procéder à un status neurologique. A cet effet, une sédation avec de la dexmédétomidine est particulièrement judicieuse. Une paraparésie ou une paraplégie (2-8% des cas) commande un drainage de LCR et une IRM si le résultat n'est pas concluant; les symptômes peuvent apparaître plusieurs jours après l'opération [2,9]. D'autres dysfonctions menacent les malades: insuffisance rénale (5-15%), ischémie mésentérique (2-5%), hémorragie, coagulopathie, tamponnade, hyperthermie, insuffisance respiratoire (30%). Cette dernière peut avoir de multiples causes: ventilation monopulmonaire, polytransfusions (TRALI: transfusion-related lung injury), paralysie diaphragmatique gauche par lésion chirurgicale du nerf phrénique, pneumonie, épanchement pleural. Le chylothorax est une complication rare mais dramatique car elle tend à perdurer et impose une nutrition parentérale à long terme.
| Anesthésie pour la chirurgie de l’aorte descendante |
|
Prise en charge hémodynamique lors de CEC partielle fémoro-fémorale avec clampage aortique:
- PAM proximale : 70 mmHg
- CEC : ≥ 2 L/min, PAM ≥ 70 mmHg
- Pression LCR ≤ 10 mmHg
- Régler l’hémodynamique en modifiant la précharge par ouverture/fermeture du retour veineux vers le réservoir de la CEC
Anesthésie:
- Isoflurane/sevoflurane ou propofol, fentanyl/sufentanil
- Tube 2-lumières (thoracotomie gauche + phréno-lombotomie d’étendue variable)
- Ventilation pulmonaire continue pendant la CEC (Fi halogéné identique sur CEC)
- Drainage de LCR par cathéter sous-dural 16G lombaire (L2-L3 ou L3-L4) mis en place avant l’induction
- Pas de péridurale
Monitorage :
- Cathéter artériel fémoral + radial droit
- Cathéter pulmonaire de Swan-Ganz si dysfonction VG
- ETO
- Pression LCR (cathéter lombaire)
- (Potentiels évoqués sensitifs / moteurs)
- NIRS cérébral et viscéral
Post-CEC :
- Paraplégie (drainage de LCR immédiat)
- Insuffisance rénale, nécrose digestive
- Vasoplégie (RAS basses)
- Hémorragie (coagulopathie)
- Insuffisance VG
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- ACHOUH PE, ESTRERA AL, MILLER CC, et al. Role of somatosensory evoked potentials in predicting outcome during thoracoabdominal aortic repair. Ann Thorac Surg 2007; 84:782-7
- BECKER BK, McGARVEY MI, ROJVIRAT C, et al. Predictors of outcome in patients with spinal cord ischemia after open aortic repair. Neurocrit Care 2012; 18:70-4
- ELMORE JR, GLOVICZKI P, HARPER CM, et al. Failure of motor evoked potentials to predict neurologic outcome in experimental thoracic aortic occlusion. J Vasc Surg 1991; 14:131-9
- ESTRERA AL, SHEINBAUM R, MILLER CC, et al. Neuromonitor-guided repair of thoracoabdominal aortic aneurysms. J Thorac Cardiovasc Surg 2010; 140:S131-5
- ETZ CD, WEIGANG E, HARTERT M, et al. Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular repair: a position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothor Surg 2015; 47:943-57
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FEDOROW CA, MOON MC, MUTCH AC, GROCOTT HP. Lumbar cerebrospinal fluid drainage for thoracoabdominal aortic surgery: Rationale and practical considerations for management. Anesth Analg 2010; 111:46-58
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- KEITH Jr CJ, PASSMAN MA, CARIGNAN MJ, et al. Protocol implementation of selective postoperative lumbar spinal drainage after thoracic aortic endograft. J Vasc Surg 2012; 55:1-8
- McNULTY S, ARKOOSH V, GOLDBERG M. The relevance of somatosensory evoked potentials during thoracic aorta aneurysm repair. J Cardiothorac Vasc Anesth 1991; 5:262-5
- NGUYEN L, BANKS D, MADANI M, et al. Anesthetic implications of partial left-heart bypass for repair of the descending thoracic aorta. J Cardiothorac Vasc Anesth 2009; 23:893-900
- SCHRAAG S. Postoperative management. Best Pract Res Clin Anaesthesiol 2016; 30:381-93
- SLOAN TB, EDMONDS HL, KOHT A. Intraoperative electrophysiologic monitoring in aortic surgery. J Cardiothorac Vasc Anesth 2013; 27:1364-73
- WYNN MM, MITTNACHT A, NORRIS E. Con: Surgery should not proceed when a bloody tap occurs during spinal drain placement for elective thoracoabdominal aortic surgery. J Cardiothorac Vasc Anesth 2006; 20:273-5
- ZAMMERT M, GELMAN S. The pathophysiology of aortic cross-clamping. Best Pract Res Clin Anaesthesiol 2016; 30:257-69
