Hémorragie massive
L’hémorragie massive est définie comme une perte de > 50% du volume circulant en < 3 heures (> 50 mL/min) ou la transfusion de 3-4 poches de sang par heure [12]. Elle s'accompagne le plus souvent de transfusion massive (≥ 10 unités de sang en < 24 heures) [40]. Outre une instabilité hémodynamique, le polytraumatisme s’accompagne d’une coagulopathie caractérisée par plusieurs éléments (voir Chapitre 8 Voie cellulaire) [8,11,34,39].
- Frein à la synthèse de thrombine par les lésions traumatiques.
- Activation de la protéine C, qui inactive irréversiblement les facteurs Va et VIIIa.
- Activation du plasminogène, d'où fibrinolyse intense.
- Hypofibrinogénémie (< 2.0 g/L).
- Consommation des facteurs par activation à partir du facteur tissulaire (FT) et destruction par la protéine C et la fibrinolyse; le fibrinogène est le facteur qui chute le plus rapidement.
- Hémodilution, hypothermie, acidose.
La prise en charge initiale d'une hémorragie massive ou d'un polytraumatisé choqué doit comprendre une évaluation hématologique rapide [4].
- Hb, Ht;
- TP (INR), aPTT, fibrinogène, D-dimères, temps de thrombine (TT), comptage plaquettaire;
- Equilibre acido-basique (excès de base < - 6), lactacidémie, calcémie, SvO2 mixte ou centrale;
- Analyses additionnelles recommandées: thromboélastogramme (TEG™, ROTEM™), test de fonction plaquettaire (VerifyNow™, Multiplate™, etc), facteur V, facteur XIII, activité anti-Xa.
La prolongation du TP suggère la prise d'un anti-vitamine K, celle du TT un anti-IIa et celle du PTT un anti-Xa ou une héparine. La thérapeutique est fondée sur une stratégie visant des cibles précises (goal-directed), qui évite de donner à l’aveugle une quantité de produits sans rapport avec les besoins réels. Un algorithme basé sur l'utilisation du thromboélastogramme et sur un test d’agrégabilité plaquettaire permet de stratifier l'administration des différents facteurs hémostatiques en fonction des lacunes décelées. Cette stratégie est variable selon les situations et les institutions, mais est toujours constituée de la même série d'échelons [4,21,30,34,35,39].
- Hypotension permissive (PAM 60-65 mmHg) ; une pression plus élevée est requise en cas de traumatisme crânio-cérébral (PAM ≥ 80 mmHg).
- Maintien de la volémie (cristalloïdes, colloïdes) en évitant une hémodilution excessive et une surcharge de volume (PVC maintenue basse).
- Correction des altérations physiologiques: maintien du pH > 7.2, de la température > 35°C, du [Ca2+]i > 1 mmol/L, et de l'Ht > 25%; réchauffement rapide des poches de sang (LevelOne™).
- Suivi de la perfusion tissulaire: taux de lactate, déficit de base, SvO2, ScO2.
- Administration de vaso-presseurs, particulièrement en cas d'hémorragie digestive.
- Maintien de l’Hb à 70 - 90 g/L ; le rythme des transfusions doit suivre celui des pertes sanguines, quelles que soient les variations du taux d’Hb.
- Administration d'un antifibrinolytique: acide tranexamique 20-30 mg/kg iv dans les 3 premières heures après le trauma (à répéter après 4-8 heures).
- Maintien des facteurs de coagulation (selon thromboélastogramme, fibrinogénémie, TP, aPTT, TT, thrombocytes) (voir Produits dérivés):
- Fibrinogène > 2.0 g/L et MCF Fibtem > 15 mm (Haemocomplettan® 2-4 g); 4 g); 1 g de fibrinogène augmente le taux plasmatique de 0.3 g. En l'absence de test diagnostic, l'administration à l'aveugle est envisageable.
- Facteurs II, VII, IX et X: complexe prothrombinique (PCC) avec 4 facteurs, (Prothromplex T®, Kanokad®, Beriplex®, Confidex®, Octaplex®), 20-40 UI/kg.
- Facteur XIII (Fibrogammine® 15-30 UI/kg), pour obtenir un taux > 60%; à ne considérer qu'après normalisation du fibrinogène.
- Maintien des plaquettes (selon tests d’agrégométrie): concentrés plaquettaires pour taux > 50'000/mcL (> 100'000/mcL en cas de TCC) ; desmopressine (Minirin®, 0.3 mcg/kg) si dysfonction plaquettaire.
- Hémostase directe rapide: chirurgie de sauvetage (Damage control surgery: matelassage, stabilisation, ligatures vasculaires, etc), embolisation endovasculaire (radiologie interven-tionnelle), endoscopie (hémorragie digestive).
- Restriction des pertes sanguines: récupération des globules rouges (CellSaver™).
- Mesure extrême de sauvetage (risque élevé de thrombose disséminée):
- aPCC: complexe prothrombinique avec 4 facteurs partiellement activés (FEIBA®), 50 UI/kg.
- Facteur rVIIa (NovoSeven® 90 mcg/kg), pour autant que soient normalisés l'Ht (> 25%), le fibrinogène (> 2.0 g/L), la calcémie (> 1 mmol/L) et les plaquettes (> 50'000/mcL). Justifié seulement en cas de mort imminente malgré l’utilisation de tous les moyens hémostatiques, inclus la chirurgie, l'endoscopie et la radiologie interventionnelle.
Dans les situations où l'hémorragie est cataclysmique, la coagulopathie apparaît très tôt dans l'évolution et son développement triple la mortalité [45]. L’administration précoce de composants plasmatiques diminue le risque de cette coagulopathie, restreint le besoin en produit sanguin et améliore le pronostic vital immédiat [33]. Un rapport fixe entre le nombre de flacons de PFC et celui des poches de sang tend à améliorer le pronostic dans les situations de guerre ou de catastrophe (rapport sang/PFC de 1:1 à 2:1) [38]. La majorité des protocoles de transfusion massive opte pour un rapport sang:PFC de 1:1, avec un lot de 4-6 unités de chaque dans un premier temps; certains y ajoutent des plaquettes dans un rapport 1:1:1 [9,40]. D'autres utilisent un rapport sang:plasma:plaquettes de l'ordre de 6:4:1 ou 3:2:1 [7]. La comparaison de l'option sang:plasma:plaquettes 1:1:1 à l'option 2:1:1 ne révèle pas de différence de mortalité chez 680 polytraumatisés, mais une hémostase un peu plus rapide dans le premier groupe [17]. En chirurgie cardiaque, en revanche, un rapport plasma:sang de 1:1 diminue la mortalité (OR 0.36) chez 324 sujets souffrant d'hémorragie massive peropératoire [9]. Le PFC n'est recommandé que lorsque les pertes sanguines sont massives, car il contribue au maintien de la volémie et des constituants plasmatiques [33]. Dans les hémorragies non-massives ou lorsque la situation s'est stabilisée, il est préférable de perfuser les composants du sang (fibrinogène, concentré prothrombinique) de manière sélective en fonction des tests de laboratoire et des thromboélastogrammes, car cette manière de procéder diminue le nombre de transfusions et améliore la morbi-mortalité [18,22,33]. La place du PFC reste encore débattue dans les urgences civiles et dans les hémorragies aiguës non traumatiques, car dans les situations où la perte massive n'est pas catastrophique il augmente l'incidence de détresse respiratoire (TRALI), de sepsis et d'insuffisance polyorganique, mais ne diminue pas la mortalité (voir PFC, Produits dérivés) [8,44].
Obstétrique
L'hémorragie du postpartum est accompagnée d'une coagulation intravasculaire disséminée (CIVD) et d'une baisse du fibrinogène très précoces. Son incidence est d'environ 1% des accouchements. L'origine est en général une atonie utérine (le plus fréquent), un placenta accreta ou une rupture utérine. Les facteurs de risque sont nombreux: grande multiparité, distension utérine, placentation anormale, syndrome HELLP, hypofibrinogénémie, etc [2,19]. L'hémorragie est profuse, puisque le débit des artères utérines en fin de grossesse et de 400-500 mL/min. Le traitement causal consiste en agents utérotoniques, tamponnade utérine, embolisation artérielle, voire hystérectomie. Outre le remplacement de la masse sanguine perdue par des cristalloïdes/colloïdes et du sang, le traitement hématologique vise à maîtriser la coagulopathie [21,23].
- Mesure de la fibrinogénémie (valeur normale en fin de grossesse: 4-6 g/L); un taux < 2 g/L est directement associé à une hémorragie sévère et à un pronostic réservé (OR 11.99) [5]. Thromboélastographie (ROTEM™): l'amplitude du FIBTEM est < 9 mm.
- Administration de fibrinogène pour maintenir un taux > 2.5 g/L [3].
- Administration de complexe prothrombinique (PCC, facteurs II, VII, IX et X), 20-40 UI/kg.
- Administration de PFC si le fibrinogène ou les facteurs ne sont pas disponibles; le nombre élevé de PFC nécessaire (30 mL/kg pour élever le taux de fibrinogène de 1 g/L) augmente le risque de surcharge intravasculaire et de complications immunes, notamment de TRALI. Aucun rapport fixe PFC/sang ne modifie la mortalité [20].
- Administration d'acide tranexamique (20-25 mg/kg iv).
- Maintien des plaquettes > 100'000/mcL.
- Perfusion de facteur VII activé (rFVIIa NovoSeven™): une étude rapporte une diminution de 64% des pertes sanguines dans les 15 minutes qui suivent la première dose [26], mais les risques thrombotiques liés à la substance sont élevés et les gains sur la mortalité aléatoires (voir Produits dérivés). Le rVIIa est n'indiqué que lorsque les autres thérapies ont échoué et après correction du fibrinogène et des plaquettes.
- L'hystérectomie est en général recommandée en cas de placenta accreta ou de déchirure utérine. Lors d'atonie utérine et d'hémorragie persistante malgré le traitement, un essai de rVIIa est raisonnable avant de pratiquer l'hystérectomie [23].
- Risque thrombo-embolique: la CIVD et l'administration de procoagulants induisent un risque considérable de thrombose artérielle et veineuse. Une prophylaxie par compression mécanique et anticoagulant (HBPM) est requise.
Anticoagulants et antiplaquettaires
En plus de la transfusion érythrocytaire en cas d'hémorragie massive, un traitement anticoagulant ou antiplaquettaire en cours réclame des mesures spécifiques pour renverser l'effet du médicament. Malheureusement, tous les anticoagulants ne disposent pas d'un antidote spécifique (voir Chapitre 8 Antagonisme) [10,13].
- Héparine non-fractionnée (HNF): protamine. Un mg de protamine (100 UI) neutralise 1 mg d'héparine (100 UI). Habituellement, on administre une dose de protamine correspondant aux 80% de la dose d'héparine administrée dans les 2 heures précédentes.
- Héparines à bas poids moléculaire (HBPM): la protamine est un antagoniste partiel. Une neutralisation de 60% de l’effet anticoagulant est possible à raison de 1 mg de protamine pour 100 UI d’effet anti-Xa (dose maximale : 50 mg), à la condition d’être à moins de 8 heures après l’administration
- Agents anti-vitamine K: vitamine K (Konakion®) intraveineuse (2.5-5.0 mg, éventuellement 10 mg) administrée en > 20 minutes; effet maximal après 12-24 heures. En cas d'intervention urgente: complexe prothrombinique 4 facteurs (25 UI/kg) (Prothromplex T®, Kanokad®, Beriplex®, Octaplex®).
Parmi les antidotes spécifiques contre les nouveaux anticoagulants anti-Xa et anti-thrombine (andexanet, aripazine, idarucizumab), seul l'idarucizumab (Praxbind®), qui renverse l'effet du dabigatran, est actuellement sur le marché. Dans l'attente, on ne peut que recourir à un renversement non-spécifique dont l'efficacité est partielle et dont le degré d'évidence est faible (voir Figure 8.14) [10,13,21].
- L’acide tranexamique (2 gm iv) ; cet antifibrinolytique peut freiner la production de plasmine et l'activation excessive de la fibrinolyse. Il s'est montré relativement efficace dans des situations telles que l'hémorragie traumatique majeure, la CEC ou le syndrome inflammatoire postopératoire [27].
- La desmopressine (0.3 mcg/kg iv) stimule la production de facteur VIII et de facteur von Willebrand par l’endothélium et améliore l’adhésion plaquettaire [42].
- Complexe prothrombinique (PCC prothrombin complex concentrate); contient les facteurs II, IX, X (préparations à 3 facteurs) et du facteur VII (préparations à 4 facteurs), ainsi que de la protéine C et de la protéine S. Dosage: 25-50 UI/kg. Permet le renversement partiel de l’effet des xabans sur les tests de coagulation in vitro, mais inefficace sur le dabigatran [46]. Les préparations à 4 facteurs sont préférables ; la dose efficace est 50 UI/kg. Les demi-vies des différents facteurs ne sont pas identiques et s’étalent de 5 heures pour le FVII à 60 heures pour le FII.
- Complexe prothrombinique activé (aPCC) ou FEIBA® (Factor eight inhibitor bypass activity), contient les facteurs II, IX, X et VII dont une bonne partie sous forme activée. Dosage: 30-50 UI/kg. Bonne alternative contre l’effet du dabigatran, il est aussi plus efficace que les PCC pour le renversement in vitro du rivaroxaban, mais il présente un risque significatif de thrombose secondaire [25].
- Facteur VII activé (rFVIIa, Novo-Seven®), 90 mcg/kg; le rFVIIa active le facteur X en Xa, ce qui génère davantage de thrombine. Il peut être indiqué pour contrecarrer les anti-Xa. Bien qu’il normalise les tests de coagulation, le rFVIIa ne diminue pas significativement les pertes sanguines. Il présente un risque élevé de thrombose [1]. Bien qu’aucune étude clinique n’ait démontré de succès clair dans le renversement de l’effet des NACO, le rVIIa pourrait être utile en cas d’hémorragie sur fondaparinux [21].
- L’ordre d’efficacité croissant pour renverser l’effet des xabans sur les tests de coagulation est : PCC < rFVIIa < aPCC; toutefois l’effet est limité et ne dépasse pas 50% de correction [25].
- Transfusion de plaquettes en cas de thrombocytopénie ou de traitement antiplaquettaire associé.
Les antiplaquettaires n'ont pas non plus d'antidote; seul le renouvellement spontané des thrombocytes (10%/jour) ou une transfusion de thrombocytes frais peut rétablir la coagulabilité sanguine. La demi-vie plasmatique du clopidogrel est de 6-8 heures; celle du prasugrel est de 3.7 heures. Comme le taux circulant d’une substance est négligeable après 3 demi-vies, on peut estimer que 24 heures après la dernière prise de clopidogrel ou 12 heures après celle de prasugrel, les thrombocytes transfusés ne seront plus inhibés, alors que les plaquettes du patient sont encore complètement bloquées par la liaison irréversible. La liaison avec le récepteur immobilise la molécule sur la plaquette et l’empêche de diffuser vers les nouvelles plaquettes.
La situation est différente pour un inhibiteur réversible comme le ticagrelor, qui ne paralyse pas la plaquette pour toute sa durée de vie. La demi-vie du ticagrelor est de 7 heures, mais celle de son métabolite actif est de 10-13 heures. Le taux plasmatique n’est donc négligeable qu’après 38 heures. Mais à cause de sa liaison réversible avec le récepteur, le ticagrelor a la capacité de diffuser entre les plaquettes en fonction de l’équilibre de masse, de se lier aux nouvelles plaquettes mises en circulation, et de migrer sur les plaquettes fraîchement transfusées. La transfusion plaquettaire perd son efficacité pendant les 36 heures qui suivent la dernière prise du médicament (voir Chapitre 8 Figure 8.23 et Chapitre 29 Transfusion plaquettaire) [15,21].
Parmi les anti-GP IIb/IIIa, le tirofiban et l’eptifibatide, inhibiteurs compétitifs, ont des demi-vies brèves (2 et 2.5 heures respectivement), alors que celle de l’abciximab, bloqueur irréversible, est de 23 heures. Les plaquettes transfusées restent donc fonctionnelles 6-8 heures après l’administration de tirofiban ou d’eptifibatide, mais seulement 72 heures après l’arrêt de la perfusion d’abciximab. Bien que son efficacité ne soit pas prouvée cliniquement en cas d’inhibition par des antiplaquettaires, la desmopressine (0.3 mcg/kg en 20 minutes) antagonise leurs effets in vitro [29].
Vu le risque thrombotique en cas de renversement total, ces traitements sont basés sur le jugement clinique et sur les altérations des tests de coagulation (TP/INR, aPTT, ACT, effet anti-Xa calibré pour la substance, thromboélastographie, agrégométrie) (voir Tableau 8.4). L'agrégométrie (VerifyNow™, Multiplate™, etc) est utile chez les patients sous antiplaquettaires. L'éventuelle normalisation des tests par le traitement antagoniste n’assure malheureusement pas que l’hémostase soit normale en cours d’opération [36]. D’autre part, l’administration de facteurs de coagulation peut améliorer le bilan hémorragique sans que les tests de laboratoire ne soient significativement modifiés.
Protocoles
Un protocole institutionnel pour la prise en charge des hémorragies massives améliore certainement le pronostic vital des patients [6,16,40,41]. Ce protocole présente plusieurs avantages [8,34,40].
- Accélérer la logistique des éléments sanguins depuis la banque de sang jusqu'au bloc opératoire, aux soins intensifs ou au déchoquage, et gérer les stocks de produits d'urgence comme les poches de sang O Rh négatif ou de PFC AB+.
- Faciliter la communication, simplifier les commandes et coordonner les activités des différents intervenants dans les situations aiguës (laborants, soignants transporteurs).
- Diminuer les pertes de produits sanguins non transfusés et améliorer la sécurité par la clarté d'une routine bien codifiée.
- Adopter une stratégie commune dans la prise en charge au déchoquage, en salle d'opération et aux soins intensifs.
- Administration d'acide tranexamique (20-25 mg/kg);
- Prise de sang pour déterminer le groupe sanguin ABO/Rhésus avant toute administration de sang (risque de chimérisme);
- Réanimation transfusionnelle: paquets comprenant 4-6 unités de sang et une proportion fixe de PFC et de plaquettes (2:1:1 ou 1:1:1);
- Indications interventionnelles: damage control surgery, chirurgie hémostatique, matelassage, embolisation, endoscopie;
- Hématologie: tests de laboratoire, thromboélastogramme;
- Pharmacothérapie: antifibrinolytiques, vasopresseurs, desmopressine, etc.
- Etablir des critères partagés par tout le personnel pour les seuils de transfusions et les indications au PFC (rapport sang:PFC), aux plaquettes ou aux facteurs de coagulation.
- Baser les indications sélectives aux différents composants (goal-directed therapy) sur une évaluation hématologique immédiate: TP, aPTT, fibrinogène, thrombocytes, thrombo-élastogramme (ROTEM™), agrégométrie en cas de traitement antiplaquettaire.
- Lutter contre l'hypothermie, l'acidose et l'hypoxémie.
Le déclenchement du protocole de transfusion massive (PTM) est basé sur le status clinique (pertes sanguines actives), sur le mécanisme étiologique (rupture vasculaire, traumatisme pénétrant) et sur certains indices: pression artérielle systolique < 90 mmHg, fréquence cardiaque > 120 b/min, Hb < 90 g/L, excès de base < - 6 [12,31]. Le PTM achemine sur place plusieurs éléments de composition pré-établie, fournis par le centre de transfusion de l'hôpital.
- Paquet initial comprenant 4-6 concentrés érythrocytaires O nég, du PFC (AB+) et des plaquettes, en proportion fixe (idéalement 1:1:1); on y adjoint 2 gm de fibrinogène, 2 ampoules de CaCl2 et 2 gm d'acide tranexamique.
- Paquets suivants (fournis toutes les 20 minutes): 4 concentrés érythrocytaires isogroupe, 4 U PFC (selon groupe) et 4-5 U plaquettes, avec du CaCl2.
- La situation est ré-évaluée après 4 paquets: état clinique, formule sanguine, gazométrie, thromboélastographie; ces examens sont déjà réalisés entre les premiers paquets, si cela est possible.
- Un code de couleur permet de différencier les paquets contenant des éléments universels (sang O+, PFC AB-), des poches isogroupe mais sans tests d'anticorps, et des unités entièrement compatibles pour le patient.
Le PTM est interrompu lorsque l'hémorragie est contrôlée, l'hémodynamique stabilisée et le besoin en vasopresseurs en reduction [12].
Ce mode de prise en charge des hémorragies massives est décrit sous forme d’algorithmes. La Figure 28.11 est l’exemple de celui utilisé à l’Hôpital Universitaire de Zürich (USZ) dans le cadre des urgences et du bloc opératoire. La Figure 28.12 illustre la cascade décisionnelle basée sur le ROTEM™ telle qu'elle est utilisée au CHUV, principalement en chirurgie cardiaque (d'où l'importance accordée à l'évaluation de l'effet de l'héparine et à son renversement par la protamine) (voir Chapitre 8 Tests peropératoires) [35,39].
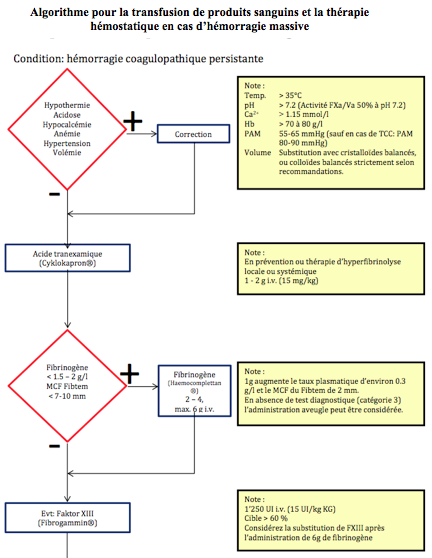
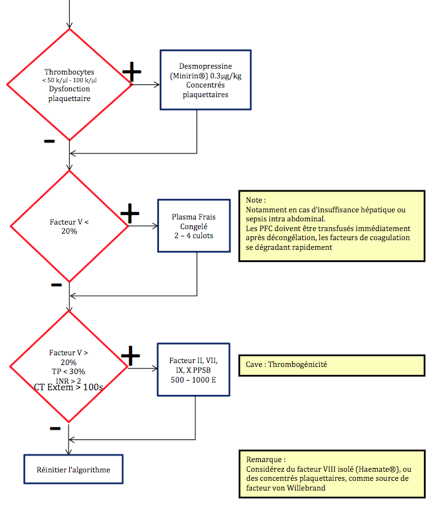


Figure 28.11 : Exemple d’algorithme de prise en charge pour la transfusion et l’administration de produits dérivés du sang dans le cadre des urgences, du bloc opératoire, du polytraumatisme et de l’hémorragie massive (Société Suisse d'Anesthésie et de Réanimation, d'après document de l'Institut d'Anesthésiologie - USZ, Zürich, Suisse) [37].
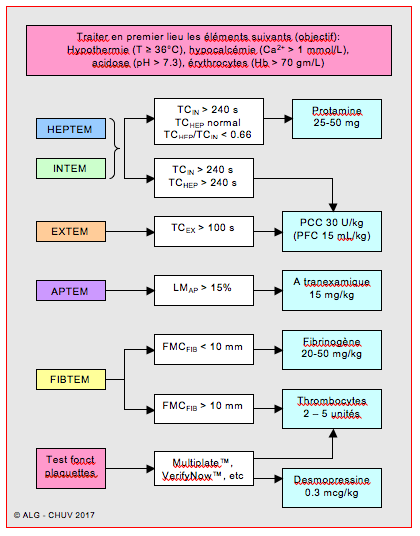

Figure 28.12 : Exemple d’algorithme basé sur l’utilisation du ROTEM™ en chirurgie cardiaque et complété par un test de fonction plaquettaire (CHUV). TC: temps de coagulation (secondes). ML: lyse maximale du caillot à 60 minutes (%). MCF: fermeté maximale du caillot (mm).
La possibilité de déterminer le status coagulatoire du patient en salle d’opération ou aux soins intensifs (Point-of-care testing) par thromboélastographie et agrégométrie est une avancée considérable dans la gestion globale des produits sanguins, car elle offre plusieurs avantages [24].
- Remplacement spécifique du ou des facteur(s) déficients(s) ;
- Identification des patients qui peuvent bénéficier d’un traitement pharmacologique ;
- Confirmation d’une perte sanguine de nature chirurgicale lorsque le test est normal ;
- Abandon de l’attitude indiscriminée qui consistait à administrer un maximum de produits (PFC, thrombocytes, facteurs sous plusieurs formes) en ignorant lequel était efficace ;
- Diminution de la consommation de concentrés érythrocytaires par une meilleure gestion de l’hémostase.
En chirurgie cardiaque, par exemple, l'utilisation de protocoles basés sur la thromboélastographie (ROTEM™) pour gérer une administration sélective de fibrinogène, de complexe prothrombinique et de facteur XIII permet de réduire le taux de transfusion érythrocytaire, les coûts hospitaliers et, dans certaines études, la morbidité postopératoire; l'administration de facteur rVIIa est quasiment éliminée (Figure 28.13) [14,43].
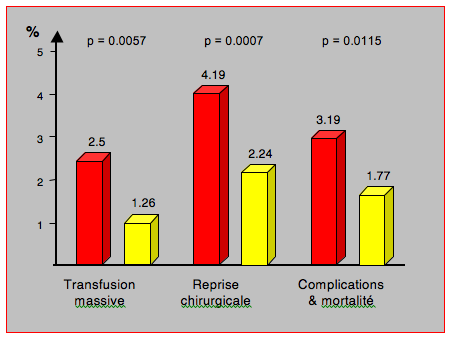

Figure 28.13 : Comparaison des résultats avant (en rouge) et après (en jaune) la mise en place d’un protocole utilisant le thromboélastogramme et un test d’agrégabilité plaquettaire au déclampage de l’aorte en chirurgie cardiaque sous CEC. Le taux de transfusion massive, de reprise chirurgicale pour hémsostase et de complications combinées est diminué de près de moitié [14].
Dans les situations où la thromboélastographie n'est pas disponible, les tests de coagulation habituels peuvent guider l'administration des produits sanguins (voir Figure 23.23) [33].
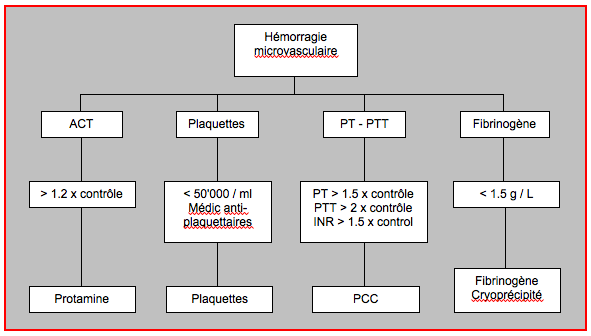
Figure 23.23 : Algorithme d'utilisation des facteurs de coagulation basé sur les tests de coagulation habituels [d'après réf 33]. Une déficience en facteurs de coagulation n'apparaît en général qu'après la transfusion de plus d'un volume circulant. Le PCC (complexe prothrombinique) est nécessaire pour renverser en urgence l'effet des dicoumarines et en cas de résistance à l'héparine par manque d'antithrombine III; il est indiqué en cas de déficience multiple en facteurs de la coagulation; il contient 2-4 mg/ml de fibrinogène. Le PCC (Prothromplex® ) contient les facteurs II, VII, IX, X et de l'antithrombine III. Le saignement dans une cavité fermée comme le péricarde ou le crâne présente un risque catastrophique; de ce fait, les critères pour administrer les différents facteurs doivent être plus généreux dans cette situation.
© CHASSOT PG, MARCUCCI C, SPAHN DR. Juin 2011; dernière mise à jour, Novembre 2019
Dans les situations où la thromboélastographie n'est pas disponible, les tests de coagulation habituels peuvent guider l'administration des produits sanguins (voir Figure 23.23) [33].
- Hb < 70 g/L: transfusion érythrocytaire;
- Thrombocytes < 50'000/mcL: transfusion plaquettaire;
- INR > 1.5: complexe prothrombinique, éventuellement PFC;
- Fibrinogène < 1.5 g/L: concentré de fibrinogène, cryoprécipité;
- ACT > 100 sec: protamine (post-héparinisation).

Figure 23.23 : Algorithme d'utilisation des facteurs de coagulation basé sur les tests de coagulation habituels [d'après réf 33]. Une déficience en facteurs de coagulation n'apparaît en général qu'après la transfusion de plus d'un volume circulant. Le PCC (complexe prothrombinique) est nécessaire pour renverser en urgence l'effet des dicoumarines et en cas de résistance à l'héparine par manque d'antithrombine III; il est indiqué en cas de déficience multiple en facteurs de la coagulation; il contient 2-4 mg/ml de fibrinogène. Le PCC (Prothromplex® ) contient les facteurs II, VII, IX, X et de l'antithrombine III. Le saignement dans une cavité fermée comme le péricarde ou le crâne présente un risque catastrophique; de ce fait, les critères pour administrer les différents facteurs doivent être plus généreux dans cette situation.
| Transfusion massive (> 10 flacons en < 24 h) |
|
L'hémorragie massive (perte de > 50% du volume circulant en < 3 h) s'accompagne d'une coagulopathie précoce (↓ fibrinogène, ↓ FVa et VIIIa, ↑ fibrinolyse, dilution, acidose), qui doit être évaluée par des tests (TP, aPTT, fibrinogène, thrombocytes, thromboélastogramme). Prise en charge:
- Maintien de l'hémodynamique (cristalloïdes/colloïdes, catécholamines, etc)
- Maintien pH > 7.2, T° > 35°C, Ca2+ > 1 mmol/L, fibrinogène > 2 g/L
- Acide tranexamique (25 mg/kg)
- Transfusions selon rythme des pertes pour maintien Hb 70 – 90 g/L
- Administration de fibrinogène et de complexe prothrombinique selon les tests
- Rapport sang:PFC 1:1 à 2:1 si impossibilité de perfuser des facteurs sélectifs
- Administration de plaquettes pour maintien > 50'000/mcL
- Hémostase directe: chirurgie de sauvetage, embolisation endovasculaire, endoscopie
- Mesure extrême en cas d'échec et menace vitale: aPCC (50UI/kg), rFVIIa (90 mcg/kg)
Bien qu'il améliore le pronostic en situation de guerre et de catastrophe, le PFC en rapport fixe avec le sang élève le risque de détresse respiratoire, de sepsis et d'insuffisance multiorganique. Il n'améliore pas la mortalité dans les urgences civiles.
Hémorragie du postpartum: accompagnée de CIVD et d'hypofibrinogénémie très précoces. Prise en charge:
- Agents utérotoniques, tamponnade, embolisation artérielle, hystérectomie si nécessaire
- Maintenir fibrinogène > 2.5 g/L et plaquettes > 100'000/mcL
- Acide tranexamique (25 mg/kg)
- Transfusions selon rythme des pertes pour maintien Hb 70 – 90 g/L
- rFVIIa: seulement si échec des autres thérapies et survie menacée
Hémorragie sur anticoagulants: administration de l'antagoniste (protamine, vitamine K). Il n'y a pas d'antidote pour les xabans, mais pour le dabigatran.
- Héparines: protamine
- Agents antivitamine K: vitamine K, complexe prothrombinique 4 facteurs
- Xabans: complexe prothrombinique 4 facteurs
- Dabigatran: idarucizumab (Praxbind®)
- Fondaparinux: aPCC, rFVIIa (?)
Hémorragie sur antiplaquettaires: perfusion de plaquettes, desmopressine.
|
© CHASSOT PG, MARCUCCI C, SPAHN DR. Juin 2011; dernière mise à jour, Novembre 2019
Références
- AKOWUAH E, SHRIVASTAVA V, JAMNADAS B, et al. Comparison of two strategies for the management of antiplatelet therapy during urgent surgery. Ann Thorac Surg 2005; 80:149-52
- AL-ZIRQI I, VANGEN S, FORSEN L, et al. Prevalence and risk factors of severe obstetric haemorrhage. Br J Obst Gynecol 2008; 115:1265-72
- BOLLIGER D, GÖRLINGER K, TANAKA KA. Pathophysiology and treatment of coagulopathy in massive hemorrhage and hemodilution. Anesthesiology 2010; 113:1205-19
- BRÜESCH M, Commission pour la gestion périopératoire de la coagulation et des produits sanguins. Bulletin Soc Suisse Anesth Réanim 2017; 33:5-8
- CORTET M, DENEUX-THARAUX C, DUPONT C, et al. Association between fibrinogen level and severity of postpartum haemorrhage: secondary analysis of a prospective trial. Br J Anaesth 2012; 108:984-9
- COTTON BA, AU BK, NUNEZ TC, et al. Predefined massive transfusion protocols are associated with a reduction in organ failure and postinjury complications. J Trauma 2009; 66:41-9
- COTTON BA, GUNTER OL, ISBELL J, et al. Damage control hematology: the impact of a trauma exsanguination protocol on survival and blood product utilization. J Trauma 2008; 64:1177-83
- CURRY N, DAVIS PW. What's new in resuscitation strategies for the patient with multiple trauma? Injury Int J Care Injured 2012; 43:1021-8
- DELANEY M, STARK PC, SUH M, et al. Massive transfusion in cardiac surgery: The impact of bood component ratios on clinical outcomes and survival. Anesth Analg 2017; 124:1777-82
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy :Antit-hrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ;141(2 suppl) : e326S-50S
- ENGELBRECHT S, WOOD EM, COLE-SINCLAIR MF. Clinical transfusion practice update: haemovigilance, complications, patient blood management and national standards. Med J Aust 2013; 199:397-401
- FOSTER JC, SAPPENFIELD JW, SMITH RS, et al. Initiation and termination of massive transfusion protocols: current strategies and future prospects. Anesth Analg 2017; 125:2045-55
- GARCIA DA, BAGLIN TP, WEITZ JI, et al. Parenteral anticoagulants: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e24S-e43S
- GÖRLINGER K, DIRKMANN D, HANKE AA, et al. First-line therapy with coagulation factor concentrates combined with point-of-care coagulation testing is associated with decreased allogeneic blood transfusion in cardiovascular surgery: a retrospective, single-center cohort study. Anesthesiology 2011; 115:1179-91
- HALL R, MAZER CD. Antiplatelet drugs: A review of their pharmacology and management in the perioperative period. Anesth Analg 2011; 112:292-318
- HOLCOMB JB, GUMBERT S. Potential value of protocols in substantially bleeding trauma patients. Curr Opin Anaesthesiol 2013; 26:215-20
- HOLCOMB JB, TILLEY BC, BARANIUK S, et al. Transfusion of plasma, platelets and red blood cells in a 1:1:1: vs a 1:1:2 ratio and mortality in patients with severe trauma. JAMA 2015; 313:471-82
- INNERHOFER P, WESTERMANN I, TAUBER H, et al. The exclusive use of coagulation factor concentrates enables reversal of coagulopathy and decreases transfusion rates in patients with major blunt trauma. Injury 2013; 44:209-16
- JAMES AH, PAGLIA MJ, GERNSHEIMER T, et al. Blood component therapy in postpartum hemorrhage. Transfusion 2009; 49:2430-3
- KASHUK JL, MOORE EE, JOHNSON JL, et al. Postinjury lifethreatening coagulopathy: is 1:1 fresh frozen plasma:packed red blood cells the answer? J Trauma 2008; 65:261-70
- KOZEK-LANGENECKER SA, AHMED AB, AFSHARI A, ALBALADEJO P, et al. Management of severe perioperative bleeding : Guidelines from the European Society of Anaesthesiology. First update 2016. Eur J Anaesthesiol 2017; 34: 332-95
- KOZEK-LANGENECKER S, SORENSEN B, HESS JR, SPAHN DR. Clinical effectiveness of fresh-frozen plasma compared with fibrinogen concentrate: a systematic review. Crit Care 2011; 15:R239
- McLINTOCK C, JAMES AH. Obstetric hemorrhage. J Thromb Haemost 2011; 9:1441-51200a TREMI AB, GORLIN JB, DUTTON RP, et al. Massive transfusion protocols: a survey of academic medical centers in the United States. Anesth Analg 2017; 124:277-81
- NALLA BP, FREEDMAN J, HARE GMT, MAZER CD. Update on blood conservation for cardiac surgery. J Cardiothorac Vasc Anesth 2012; 26:117-33
- PERZBORN E, HEITMEIER S, LAUX V, BUCHMULLER A. Reversal of rivaroxaban-induced anticoaguéation with prothrombin complex concentrate, activated prothrombin complex concentrate and recombinant activated factor VII in vitro. Thrombos Res 2014 ; 133 :671-81
- PHILLIPS LE, McLINTOCK C, POLLOCK W, et al. Recombinant activated factor VII in obstetric hemorrhage: expériences from the Australian and New Zealand Haemostasis Registry. Anesth Analg 2009; 109:1908-15
- RAMIREZ RJ, SPINELLA PC, BOCHICCHIO GV. Tranexamin acid update in trauma. Crit Care Clin 2017; 33:85-99
- RAPHAEL J, MAZER CD, SUBRAMANI S, et al. Society of Cardiovascular Anesthesiologists Clinical Practice Improvement Advisory for management of perioperative bleeding and hemostasis in cardiac surgery patients. J Cardiothorac Vasc Anesth 2019; 33:2887-99
- REITER RA, MAYR F, BLAZICEK H, et al. Desmopressin antagonizes the in vitre platelet dysfunction induced by GPIIb/IIIa inhibitors and aspirin. Blood 2003; 102:4594-9
- ROBACK JD, CALDWELL S, CARSON J, et al. Evidence-based practice guidelines for plasma transfusion. Transfusion 2010; 50:1227-39
- ROSSAINT R, BOUILLON B, CERNY V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit Care 2016; 20:100
- SCHÖCHL H, NIENABER U, MAEGELE M, et al. Transfusion in trauma: thromboelastograpy-guided coagulation factor concentrate-based therapy versus standard fresh-frozen plasma-based therapy. Crit Care 2011; 15:R83
- SHORE-LESSERSON L, MANSPEIZER HE, DEPERIO M, et al. Thrombo-elastography-guided transfusion algorithm reduces transfusions in complex cardiac surgery. Anesth Analg 1999; 88:312-9
- SPAHN DR, BOUILLON B, CERNY V, et al. Management of bleeding and coagulopathy following major trauma: an updated European guideline. Crit Care 2013; 17:R76
- SPAHN DR, GANTER MT. Towards early individual goal-directed coagulation management in trauma patients. Brit J Anaesth 2010; 105:103-5
- SPAHN DR, KORTE W. Novel oral anticoagulants. New challenges for anesthesiologists in bleeding patients. Anesthesiology 2012; 116 :9-11
- SSAR - Société Suisse d'Anesthésie et de Réanimation. Algorithme pour la transfusion de produits sanguins et la thérapie hémostatique en cas d'hémorragie massive, 2017 (voir Directives: Algorithme Transfusion USZ.pdf)
- TEIXIERA PGR, INABA k, SHULMAN I, et al. Impact of plasma transfusion in massively transfused trauma patients. J Trauma 2009; 66:693-7
- THEUSINGER OM, SPAHN DR, GANTER MT. Transfusion in trauma: why and how should we change our current practice ? Curr Opin Anaesthesiol 2009; 22:305-12
- TREMI AB, GORLIN JB, DUTTON RP, et al. Massive transfusion protocols: a survey of academic medical centers in the United States. Anesth Analg 2017; 124:277-81
- VOGT KN, VAN KOUGHNETT JA, DUBOIS L, et al. The use of trauma transfusion pathways for blood component transfusion in the civilian population: a systematic review and meta-analysis. Transf Med 2012; 22:156-66
- WEBER CF, DIETRICH W, SPANNAGL M, et al. A point-of-care assessment of the effects of desmopressin on impaired platelet function using Multiple Electrode whole-blood Aggregometry in patients after cardiac surgery. Anesth Analg 2010 ; 110 :702-7
- WEBER CF, GÖRLINGER K, MEININGER D. Point-of-care testing : a prospective randomized clinical trial of efficacy in coagulopathic cardiac surgery patients. Anesthesiology 2012 ; 117 : 531-47
- YANG L, STANWORTH S, HOPEWELL S, et al. Is fresh-frozen plasma clinically effective? An update of a systematic review of randomized controlled trials. Transfusion 2012; 52:1673-86
- YOUNG PP, COTTON BA, GOODNOUGH LT. Massive transfusion protocols for patients with substantial hemorrhage. Transf Med Rev 2011; 25:293-303
- ZAHIR H, BROWN KS, VANDELL AG, et al. Edoxaban effects on bleeding following punch biopsy and reversal by 4-factor prothrombin complex concentrate. Circulation 2015 ; 131:82-90
