Il se pratique environ 4'500 greffes cardiaques par an à travers le monde [11]. La cardiomyopathie est la principale étiologie menant à la transplantation (53% des cas), suivie par l’ischémie myocardique (38%), les cardiopathies congénitales (3%) et les valvulopathies (3%). Près de la moitié des patients ont déjà subi une intervention cardiaque et 40% sont sous assistance circulatoire au moment de leur transplantation [7,8]. L'indication à la greffe est une insuffisance cardiaque terminale devenue réfractaire au traitement médical et aux thérapeutiques invasives [15].
L’ETO apporte une contribution capitale à la gestion de la transplantation cardiaque. Avant la CEC, elle permet la surveillance d’un coeur qui doit assurer la perfusion des organes alors qu’il est en phase terminale. Après la CEC, elle évalue de manière immédiate la fonction ventriculaire doite et gauche du greffon et contrôle la qualité des anastomoses. Ultérieurement, elle permet une prise en charge optimale de l’hémodynamique et un suivi du fonctionnement de l’allogreffe (fonction, rejet).
ETO du donneur
Les malades en mort cérébrale sont la meilleure source de greffon cardiaque garantissant une fonction optimale, mais leur nombre est très insuffisant par rapport à la demande d’organe, puisque environ trois quarts des patients en liste d’attente décède sans avoir pu bénéficier d’une greffe [Office Fédéral de la Santé Publique, Berne, 2016]. Pour pallier ce manque, on a élargi les critères de sélection en reculant l’âge au-delà de 50 ans, en acceptant des donneurs hypertendus, diabétiques (dans la mesure où ces affections sont stables et contrôlées), souffrant de tumeur cérébrale, d’hypertrophie ventriculaire (épaisseur jusqu'à 14 mm), de valvulopathie mineure (bicuspidie, fuite mitrale) ou de coronaropathie modérée, et en utilisant des coeurs dont la fonction est abaissée (FE 0.4) ou souffrant de cardiopathie de stress [9,21]. En effet, la mort cérébrale s’accompagne souvent d’une décharge catécholaminergique extrême ("tempête sympathique") conduisant à une surcharge de calcium libre intra-sarcoplasmique (↑ [Ca2+]i). Ce phénomène se traduit par une dysfonction globale (FE < 0.5) chez 67% des donneurs et par des altérations de la cinétique segmentaire (ACS) chez 36% d’entre eux [5]. Ces ACS touchent de manière prépondérante les segments basaux et antérieurs mais épargnent le plus souvent l’apex; elles ne respectent pas l'arborisation coronarienne. Elles sont plus fréquentes lors d’hémorragie intracrânienne que lors de mort cérébrale traumatique [24]. Lorsqu’elles sont modérées, les altérations de la fonction ventriculaire segmentaire et globale sont en général réversibles après transplantation [2]. Toutefois cette attitude n’est pas sans risque, puisque les ACS du donneur correspondant à une distribution coronarienne sont un prédicteur indépendant de la dysfonction du greffon (OR 1.7) [5,23].
Il est donc recommandé de respecter les valeurs suivantes comme critères de sélection [2,19].
L’ETO apporte une contribution capitale à la gestion de la transplantation cardiaque. Avant la CEC, elle permet la surveillance d’un coeur qui doit assurer la perfusion des organes alors qu’il est en phase terminale. Après la CEC, elle évalue de manière immédiate la fonction ventriculaire doite et gauche du greffon et contrôle la qualité des anastomoses. Ultérieurement, elle permet une prise en charge optimale de l’hémodynamique et un suivi du fonctionnement de l’allogreffe (fonction, rejet).
ETO du donneur
Les malades en mort cérébrale sont la meilleure source de greffon cardiaque garantissant une fonction optimale, mais leur nombre est très insuffisant par rapport à la demande d’organe, puisque environ trois quarts des patients en liste d’attente décède sans avoir pu bénéficier d’une greffe [Office Fédéral de la Santé Publique, Berne, 2016]. Pour pallier ce manque, on a élargi les critères de sélection en reculant l’âge au-delà de 50 ans, en acceptant des donneurs hypertendus, diabétiques (dans la mesure où ces affections sont stables et contrôlées), souffrant de tumeur cérébrale, d’hypertrophie ventriculaire (épaisseur jusqu'à 14 mm), de valvulopathie mineure (bicuspidie, fuite mitrale) ou de coronaropathie modérée, et en utilisant des coeurs dont la fonction est abaissée (FE 0.4) ou souffrant de cardiopathie de stress [9,21]. En effet, la mort cérébrale s’accompagne souvent d’une décharge catécholaminergique extrême ("tempête sympathique") conduisant à une surcharge de calcium libre intra-sarcoplasmique (↑ [Ca2+]i). Ce phénomène se traduit par une dysfonction globale (FE < 0.5) chez 67% des donneurs et par des altérations de la cinétique segmentaire (ACS) chez 36% d’entre eux [5]. Ces ACS touchent de manière prépondérante les segments basaux et antérieurs mais épargnent le plus souvent l’apex; elles ne respectent pas l'arborisation coronarienne. Elles sont plus fréquentes lors d’hémorragie intracrânienne que lors de mort cérébrale traumatique [24]. Lorsqu’elles sont modérées, les altérations de la fonction ventriculaire segmentaire et globale sont en général réversibles après transplantation [2]. Toutefois cette attitude n’est pas sans risque, puisque les ACS du donneur correspondant à une distribution coronarienne sont un prédicteur indépendant de la dysfonction du greffon (OR 1.7) [5,23].
Il est donc recommandé de respecter les valeurs suivantes comme critères de sélection [2,19].
- Fraction d’éjection (FE) > 40%;
- Raccourcissement de surface (FAC) > 30%;
- Altérations de la cinétique segmentaire mineures (hypokinésie);
- Hypertrophie ventriculaire gauche avec épaisseur de paroi postérieure < 15 mm;
- Valvulopathie mineure (bicuspidie aortique, insuffisance ou sténose mitrale < modérée);
- Cardiopathie congénitale réparable in situ: FOP, CIA, veine cave supérieure gauche, etc).
Il est prudent de considérer l’akinésie de territoires majeurs (parois antérieure et latérale) comme une contre-indication. Il est également important d’identifier la présence de valvulopathies. Alors qu’une affection évolutive (maladie de Barlow, RAA) est une contre-indication, une insuffisance mineure (degré I-II) ou une biscuspidie aortique sont acceptables. On recherche la présence de FOP ou de CIA à cause du risque de shunt D → G chez le receveur en cas de dysfonction droite; ces anomalies sont réparées en passant et ne contre-indiquent pas l’utilisation du greffon. La taille des cavités cardiaques et des gros vaisseaux fait l’objet de mesures précises pour s’assurer d’une discordance < 20% avec les structures du receveur.
Examen pré CEC
L’examen ETO réalisé avant la CEC a deux buts:
Examen pré CEC
L’examen ETO réalisé avant la CEC a deux buts:
- Surveillance hémodynamique;
- Recherche de pathologies ayant une incidence chirurgicale.
La cardiopathie terminale dont souffre le patient transplanté est en général caractérisée par plusieurs éléments bien surveillés par l’ETO.
- Dysfonction systolique et dilatation ventriculaire, IM restrictive (Vidéo) (Figure 27.35 et Figure 27.50); comme des vasopresseurs sont souvent nécessaires pour maintenir la pression de perfusion, l’image ETO permet de contrôler la tolérance du VG à cette augmentation de postcharge.
- Dysfonction diastolique; le volume systolique est très dépendant de la précharge; cette dernière n’est pas évaluable par la PVC ou la PAPO pour trois raisons: la compliance est anormale, l’IT et l’IM sont courantes et le malade est ventilé en pression positive.
- Dysfonction du VD; s’il est introduit avant la CEC, le cathéter pulmonaire de Swan-Ganz doit être retiré assez tôt dans sa housse de protection pour éviter de se retrouver dans le champ opératoire. L’ETO offre alors la seule technique de surveillance continue du VD et de mesure de la PAPsyst par la Vmax de l’insuffisance tricuspidienne: PAPs = 4 (VmaxIT)2 + POD. Il est rare qu’une dysfonction ventriculaire droite ne s’accompagne pas d’IT.
- La présence d’une hypertrophie ventriculaire droite suggère celle d’une hypertension pulmonaire chez le receveur, qui va occasionner une décompensation droite du greffon.
- L’ETO peut pallier à l’absence de Swan-Ganz pour la mesure du débit cardiaque; le volume systolique (VS) est calculé par le produit de la surface (S) de la valve aortique ou de la CCVG et de l’intégrale des vélocités (ITV) à cet endroit: VS (mL) = S (cm2) • ITV (cm). La surface de la CCVG est calculée à partir du diamètre (D): S = 0.785 D2. Celle de la valve aortique est mesurée en mésosystole (forme triangulaire). L’ITV est mesurée au Doppler pulsé dans la CCVG et au Doppler continu à travers la valve aortique. Le débit cardiaque est donc:
Q = 0.785 D2 • ITV • FC (CCVG)
Q = SAo • ITV • FC (valve aortique)
où: FC fréquence cardiaque
Vidéo: défaillance biventriculaire.
Quelques découvertes pathologiques ont une influence sur la stratégie chirurgicale.
- Athéromatose de l’aorte ascendante: modification des sites de canulation et d'anastomose.
- Calcifications massives ou pendulaires de l’aorte descendante: contre-indication à la contre-pulsion intra-aortique.
- Thrombus intracardiaque lié au bas débit ou à une akinésie pariétale: dans l’appendice auriculaire gauche (fréquent en cas de fibrillation auriculaire), à l’apex du VG (à rechercher en cas d’akinésie apicale). Dans ces cas, les manipulations du coeur doivent être réduites au strict minimum jusqu’au clampage de l’aorte.
- Assistance ventriculaire: la décanulation d’une assistance ventriculaire préalable peut entraîner des embolies gazeuses que l’ETO peut repérer en vue long-axe de l’aorte ascendante (120°).
- Cardiopathies congénitales: identification de la position et de la taille de l’aorte, de l’artère pulmonaire et des veines caves; recherche de veine cave supérieure gauche.
Examen post-CEC
La technique chirurgicale originale de la greffe cardiaque établie par N. Shumway (1967) laissait en place la paroi postéro-latérale des deux oreillettes, de manière à anastomoser la partie antérieure des oreillettes du donneur à la partie postérieure de celles du receveur, qui comprend l’implantation des veines caves et des veines pulmonaires. Il s’ensuit une désynchronisation de la contraction et une dysfonction mécanique atriale, souvent caractérisée par un contraste spontané dans les oreillettes malgé un débit cardiaque satisfaisant, et un risque accru de thrombose auriculaire. Bien qu’elle facilite la fermeture d’un FOP, cette technique augmente considérablement la taille des oreilllettes : outre les thromboses, les arythmies, les blocs de conduction et l’insuffisance tricuspidienne ou mitrale sont fréquents [3]. C’est la raison pour laquelle on résèque maintenant la totalité de l’OD et on ne laisse en place que la paroi postérieure de l’OG comprenant l’abouchement des quatre veines pulmonaires (Figure 27.199). Les veines caves du receveur sont anastomosées à la partie proximale de celles du donneur, qui fait corps avec l’OD du greffon (technique bi-cave de Sievers). L’intervention commence par la suture de l’OG, suivie de celle de l’aorte. On peut alors déclamper cette dernière, ce qui réduit la durée de l’ischémie, et réaliser les anastomoses des veines caves et de l’artère pulmonaire à cœur battant en CEC, pour autant qu'il n'y ait pas de FOP [1]. La reperfusion de cardioplégie toutes les 20 minutes ou après chaque anastomose diminue l'incidence de dysfonction précoce du greffon [6].
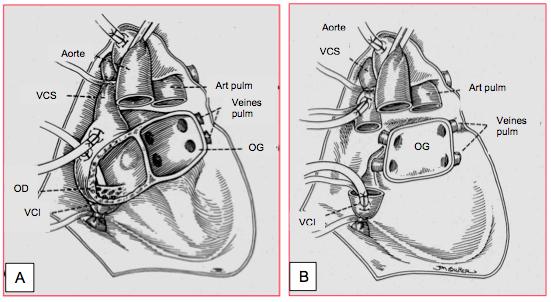
Figure 27.199 : Technique chirurgicale de la transplantation cardiaque orthotopique. A: méthode originale de Shumway; le corps des oreillettes du receveur est conservé; les oreillettes du donneur sont greffées par-dessus, aboutissant à un excès de tissu et de très grandes cavités auriculaires. B: méthode bi-cave de Sievers; seule la paroi postérieure de l'OG est laissée en place avec les quatre veines pulmonaires; le corps de l'OD et de l'OG est complètement réséqué; l'oreillette droite du greffon est anastomosée par ses veines caves aux veines caves supérieure et inférieure du receveur [Source: Kaplan JA, ed. Cardiac Anesthesia, 4th edition. Philadelphia:WB Saunders Co, 1999, p 993].
Avant la mise en charge, un premier examen permet de contrôler les manoeuvres de débullage et la présence éventuelle d’air dans le territoire coronarien droit (voir Figure 25.237). Il faut attendre le rétablissement du débit cardiaque pour que le retour par les veines pulmonaires ait totalement vidangé l’air qui peut s’y être accumulé lors de la reconstruction de l’OG. Le coeur du donneur, qui est de taille normale, se retrouve dans un sac péricardique en général très agrandi par la dilatation du coeur explanté. Il tend à se placer dans une position plus médiane que le coeur normal, avec une certaine rotation dans le sens horaire. Les plans de coupe seront donc sensiblement modifiés par rapport aux vues habituelles. Un épanchement non-compressif est fréquent dans le vaste espace libre péricardique. Dès la mise en charge, on surveille attentivement la reprise fonctionnelle des deux ventricules.
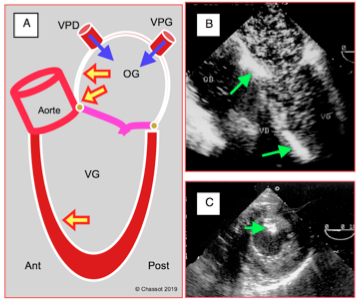
Figure 25.237 : Accumulation d’air dans le cœur gauche en fin de CEC. A : l’air provient de la cardiotomie gauche et des veines pulmonaires droite (VPD) et gauches (VPG) ; il s’accumule aux endroits les plus suré-levés : angle entre le septum interauriculaire et le toit de l’OG, angle mitro-aortique, septum interventriculaire antéro-apical en position de Trendelenburg. B : vue 4 cavités avec d’innonbrables bulles dans l’OG et le VG, ainsi que deux zones d’accumulation contre le septum inter-auriculaire et dans les trabéculations du septum interventriculaire. C : embolisation d’ait dans le muscle papillaire postérieur (territoire de la coronaire droite).
Dès sa reperfusion, le VG du coeur greffé présente certaines caractéristiques [6,18].
La technique chirurgicale originale de la greffe cardiaque établie par N. Shumway (1967) laissait en place la paroi postéro-latérale des deux oreillettes, de manière à anastomoser la partie antérieure des oreillettes du donneur à la partie postérieure de celles du receveur, qui comprend l’implantation des veines caves et des veines pulmonaires. Il s’ensuit une désynchronisation de la contraction et une dysfonction mécanique atriale, souvent caractérisée par un contraste spontané dans les oreillettes malgé un débit cardiaque satisfaisant, et un risque accru de thrombose auriculaire. Bien qu’elle facilite la fermeture d’un FOP, cette technique augmente considérablement la taille des oreilllettes : outre les thromboses, les arythmies, les blocs de conduction et l’insuffisance tricuspidienne ou mitrale sont fréquents [3]. C’est la raison pour laquelle on résèque maintenant la totalité de l’OD et on ne laisse en place que la paroi postérieure de l’OG comprenant l’abouchement des quatre veines pulmonaires (Figure 27.199). Les veines caves du receveur sont anastomosées à la partie proximale de celles du donneur, qui fait corps avec l’OD du greffon (technique bi-cave de Sievers). L’intervention commence par la suture de l’OG, suivie de celle de l’aorte. On peut alors déclamper cette dernière, ce qui réduit la durée de l’ischémie, et réaliser les anastomoses des veines caves et de l’artère pulmonaire à cœur battant en CEC, pour autant qu'il n'y ait pas de FOP [1]. La reperfusion de cardioplégie toutes les 20 minutes ou après chaque anastomose diminue l'incidence de dysfonction précoce du greffon [6].

Figure 27.199 : Technique chirurgicale de la transplantation cardiaque orthotopique. A: méthode originale de Shumway; le corps des oreillettes du receveur est conservé; les oreillettes du donneur sont greffées par-dessus, aboutissant à un excès de tissu et de très grandes cavités auriculaires. B: méthode bi-cave de Sievers; seule la paroi postérieure de l'OG est laissée en place avec les quatre veines pulmonaires; le corps de l'OD et de l'OG est complètement réséqué; l'oreillette droite du greffon est anastomosée par ses veines caves aux veines caves supérieure et inférieure du receveur [Source: Kaplan JA, ed. Cardiac Anesthesia, 4th edition. Philadelphia:WB Saunders Co, 1999, p 993].
Avant la mise en charge, un premier examen permet de contrôler les manoeuvres de débullage et la présence éventuelle d’air dans le territoire coronarien droit (voir Figure 25.237). Il faut attendre le rétablissement du débit cardiaque pour que le retour par les veines pulmonaires ait totalement vidangé l’air qui peut s’y être accumulé lors de la reconstruction de l’OG. Le coeur du donneur, qui est de taille normale, se retrouve dans un sac péricardique en général très agrandi par la dilatation du coeur explanté. Il tend à se placer dans une position plus médiane que le coeur normal, avec une certaine rotation dans le sens horaire. Les plans de coupe seront donc sensiblement modifiés par rapport aux vues habituelles. Un épanchement non-compressif est fréquent dans le vaste espace libre péricardique. Dès la mise en charge, on surveille attentivement la reprise fonctionnelle des deux ventricules.

Figure 25.237 : Accumulation d’air dans le cœur gauche en fin de CEC. A : l’air provient de la cardiotomie gauche et des veines pulmonaires droite (VPD) et gauches (VPG) ; il s’accumule aux endroits les plus suré-levés : angle entre le septum interauriculaire et le toit de l’OG, angle mitro-aortique, septum interventriculaire antéro-apical en position de Trendelenburg. B : vue 4 cavités avec d’innonbrables bulles dans l’OG et le VG, ainsi que deux zones d’accumulation contre le septum inter-auriculaire et dans les trabéculations du septum interventriculaire. C : embolisation d’ait dans le muscle papillaire postérieur (territoire de la coronaire droite).
Dès sa reperfusion, le VG du coeur greffé présente certaines caractéristiques [6,18].
- Démarrage plus ou moins lent de la reprise fonctionnelle systolique; elle varie selon la fonction du greffon avant prélèvement, la durée d’ischémie du greffon (en principe ≤ 4 heures), les conditions de préservation, les lésions de reperfusion, la discordance de taille donneur-receveur, les résistances artérielles du receveur.
- Dysfonction droite aiguë; les résistances artérielles pulmonaires (RAP) du receveur sont plus élevées que celles du donneur à cause de l'insuffisance gauche ou de la valvulopathie mitrale, alors que le donneur avait en principe une hémodynamique saine ou peu compromise. Face à cette soudaine augmentation de sa postcharge, le VD se dilate et défaille. Il nécessite un soutien inotrope majeur et un traitement vasodilatateur pulmonaire (voir Tableau 17.4).
- Augmentation de l’épaisseur de paroi due à l’oedème (solution de préservation, cardioplégie, ischémie, manipulations); la masse ventriculaire gauche est augmentée.
- Aplatissement du septum interventriculaire et mouvement paradoxal du septum, accentué en cas de dysfonction droite.
- Dysfonction diastolique de type restrictif; le flux mitral montre un raccourcissement de la phase de relaxation isovolumétrique, une élévation de la Vmax E, une accélération de la pente de décélération E et une nette diminution de la Vmax du flux auriculaire A. Le flux veineux pulmonaire affiche une baisse de la composante systolique et une élévation de la composante diastolique. Ces caractéristiques ne sont malheureusement pas dissociables de la baisse de la contractilité auriculaire et de la désynchronisation des oreillettes qui surviennent après la transplantation [14].

| Caractéristiques échocardiographiques du coeur transplanté |
| Rotation horaire par rapport aux plans de coupe habituels Oreillettes agrandies (bourrelet anastomotique) et dysfonctionnelles Image Doppler de dysfonction diastolique restrictive Dysfonction VD aiguë fréquente, aplatissement ou mouvement paradoxal du septum interventriculaire Epaisseur de paroi et masse ventriculaire augmentées Epanchement péricardique non compressif (coeur de petite taille par rapport au péricarde) |
Examen du cœur transplanté
Après implantation selon Shumway, on voit nettement le bourrelet échodense provoqué par les lignes de suture auriculaire droite et gauche en vue 4-cavités 0° (Figure 27.200). Il semble que le septum ait deux fosses ovales. Il peut arriver que la suture auriculaire gauche provoque un rétrécissement médio-auriculaire en sablier (cor triatriatum acquis). Si le flux au niveau du rétrécissement présente une accélération importante (turbulences au Doppler couleur), la sténose est significative et impose une révision immédiate de l’anastomose auriculaire, car il se développera une hémodynamique de sténose mitrale ou tricuspidienne [13]. Il est rare que le flux soit perturbé dans les veines pulmonaires puisque la paroi postérieure de l’OG du donneur est restée en place; toutefois, ce flux peut présenter une Vmax élevée en cas de torsion des veines si la suture auriculaire est très déséquilibrée. Une Vmax > 1.5 m/s n’est pas acceptable. Le recherche de FOP doit être systématique même si elle a été pratiquée sur le donneur. En effet, les conditions hémodynamiques sont modifiées, et un passage D → G cyanogène peut apparaître à la faveur de la dysfonction du VD.
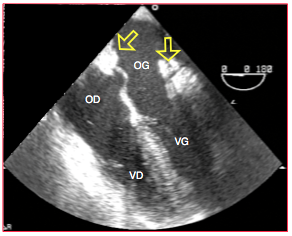
Figure 27.200 : Image 4-cavités 0° d’un coeur transplanté. Les oreillettes paraissent plus grandes que sur un coeur normal. Les lignes de sutures auriculaires sont bien visibles au niveau de l’OG (flèches) ; elles forment des bourrelets. Le septum interauriculaire bombé dans l’OG signale une dysfonction droite.
Avec la technique bi-cave de Sievers, les anastomoses des veines caves peuvent donner lieu à des rétrécissements significatifs; elles doivent être systématiquement investiguées dès le sevrage de la CEC (Figure 27.201) [16,22].
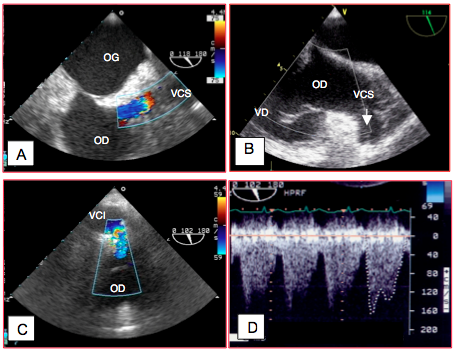
Figure 27.201 : Sutures caves restrictives après greffe cardiaque. A: flux turbulent dans la veine cave supérieure (VCS); vu l’échelle de couleur (limite de Nyquist 0.75 m/s), la Vmax du flux est > 1 m/s. B : la seule vue ETO dans laquelle on puisse mesurer adéquatement la Vmax du flux veineux cave supérieur est une vue transgastrique admission du VD à 70-120° avec rotation horaire de la sonde. Elle met en évidence la VCS à 6 heures par rapport à l’OD, avec l’axe du Doppler parallèle au flux de la veine. C : flux turbulent à la jonction entre la veine cave inférieure (VCI) et l’OD en vue bi-cave 100° basse (sonde au niveau du diaphragme). On voit une zone d’accélération concentrique en amont de la sténose (Vmax > 1.2 m/s d’après l’échelle couleur). Le Doppler est bien aligné avec le flux. D : image spectrale du flux de la vue précédente ; le flux ne revient jamais à la ligne de base; la Vmax est 1.6 m/s ; le gradient de pression maximal est de 11 mmHg et le gradient moyen de 7 mmHg. Ces valeurs sont excessives et justifient une reprise chirurgicale de l’anastomose.
Dans une veine centrale, la vélocité du flux est en moyenne de 0.3 à 0.7 m/s. Une Vmax de 1.0 – 1.5 m/s est anormale mais encore tolérée; elle représente un gradient de pression maximal de 4 – 9 mmHg. Une Vmax > 1.5 m/s est considérée comme pathologique et commande une révision immédiate de l’anastomose.
Les flux artériels doivent être contrôlés au même titre que les flux veineux. Bien que moins délicates à réaliser, les anastomoses artérielles peuvent être sujettes à des sténoses, des torsions, des coudures ou des dissections [16,22].
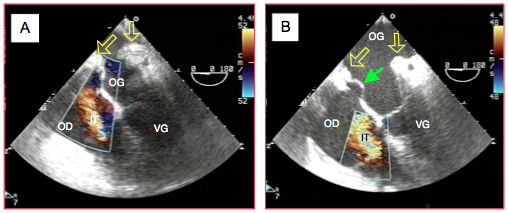
Figure 27.202 : Evolution d’une dysfonction droite après transplantation cardiaque. A: insuffisance tricuspidienne (IT) mineure-à-modérée juste après la mise en charge. B: onze minutes plus tard, l’IT a augmenté à un degré sévère ; le septum interauriculaire est clairement bombé dans l’OG (flèche verte), bien que le VD ne soit pas encore dilaté. Les flèches jaunes indiquent les lignes de suture de l’OG.
La fonction systolique du VG est en général conservée, pour autant qu'il n'y ait pas eu de dysfonction chez le donneur, ni de prolongement de la durée d'ischémie, ni de problème de préservation à froid (Vidéo) [12]. Il souffre par contre d'une dysfunction diastolique; couplée à la diminution de la contractilité auriculaire, celle-ci donne une image de flux mitral pseudo-restrictif [14]. Toutefois, des points d'hémostase secondaire sur l'anastomose aortique peuvent léser l'origine d'une artère coronaire.
Vidéo: fonction satisfaisante et homogène du VG en vue court-axe transgastrique.
Après la mise en charge, on découvre une IM mineure dans le 60% des cas et une IT mineure-à-modérée dans le 85% des cas [2,4]. Elles sont dues en bonne partie aux modifications géométriques des oreillettes et à la tension exercée sur la partie musculaire de l’anneau atrio-ventriculaire par les sutures auriculaires. Elles sont plus fréquentes quand la taille du greffon est très différente de celle du receveur et que l'espace péricardique est excessif pour les dimensions du greffon. Le cas échéant, elles sont évidemment liées à la défaillance du ventricule sous-jacent.
La dysfonction primaire du greffon est une défaillance biventriculaire qui survient dans les premières 24 heures sans cause apparente [6,8]. Comme la définition en est assez vague, l'incidence et la mortalité de cet événement restent très variables selon les séries (moyenne 7.5% et 7-20% respectivement) [6,17]. Cliniquement, la situation est une décompensation congestive du VG et du VD avec FE < 0.4, PAPO > 20 mmHg, PVC > 15 mmHg et DC < 2.0 L/min/m2. Une fois la crise passée, la survie à long terme est identique à la moyenne [10].
Examen ultérieur
Outre la surveillance fonctionnelle, la recherche de thrombus et l’observation d’un épanchement péricardique (20% des patients), l’échocardiographie présente un intérêt majeur pour suspecter un rejet de l’allogreffe [2].
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
Après implantation selon Shumway, on voit nettement le bourrelet échodense provoqué par les lignes de suture auriculaire droite et gauche en vue 4-cavités 0° (Figure 27.200). Il semble que le septum ait deux fosses ovales. Il peut arriver que la suture auriculaire gauche provoque un rétrécissement médio-auriculaire en sablier (cor triatriatum acquis). Si le flux au niveau du rétrécissement présente une accélération importante (turbulences au Doppler couleur), la sténose est significative et impose une révision immédiate de l’anastomose auriculaire, car il se développera une hémodynamique de sténose mitrale ou tricuspidienne [13]. Il est rare que le flux soit perturbé dans les veines pulmonaires puisque la paroi postérieure de l’OG du donneur est restée en place; toutefois, ce flux peut présenter une Vmax élevée en cas de torsion des veines si la suture auriculaire est très déséquilibrée. Une Vmax > 1.5 m/s n’est pas acceptable. Le recherche de FOP doit être systématique même si elle a été pratiquée sur le donneur. En effet, les conditions hémodynamiques sont modifiées, et un passage D → G cyanogène peut apparaître à la faveur de la dysfonction du VD.

Figure 27.200 : Image 4-cavités 0° d’un coeur transplanté. Les oreillettes paraissent plus grandes que sur un coeur normal. Les lignes de sutures auriculaires sont bien visibles au niveau de l’OG (flèches) ; elles forment des bourrelets. Le septum interauriculaire bombé dans l’OG signale une dysfonction droite.
Avec la technique bi-cave de Sievers, les anastomoses des veines caves peuvent donner lieu à des rétrécissements significatifs; elles doivent être systématiquement investiguées dès le sevrage de la CEC (Figure 27.201) [16,22].
- Anastomose de la veine cave supérieure (VCS): en vue bicave 100°, le Doppler couleur (limite de Nyquist 0.5 m/s) met en évidence un flux tourbillonnaire, mais ne permet pas de mesurer la vélocité (Vidéo). Comme l’oesophage et la VCS sont parallèles, il n’existe aucune vue transoesophagienne qui permette d’être dans l’axe du flux avec le faisceau Doppler. La seule vue qui offre cet alignement est une vue transgastrique à 60 – 120° dérivée de la vue chambre d’admission du VD avec rotation de sonde dans le sens horaire; on voit alors la VCS au bas de l’écran, à 6 heures par rapport à l’OD (Figure 27.201B).
- Anastomose de la veine cave inférieure (VCI): en vue bicave 100° profonde (sonde au niveau du diaphragme), on voit l’abouchement de la VCI dans l’OD et la zone de l’anastomose (Vidéo). Dans cette position, le flux est dans l’axe du capteur Doppler et la mesure de la Vmax est aisée.
Vidéo: flux accéléré à la jonction entre la VCS et l'OD, traduisant une restriction au niveau de l'anastomose; l'angle entre la direction du flux et l'axe des ultrasons est toutefois excessif pour permettre une quantification par le Doppler.
Vidéo: flux accéléré (environ 1.6 m/s) à la jonction entre la VCI et l'OD, traduisant une restriction au niveau de l'anastomose.

Figure 27.201 : Sutures caves restrictives après greffe cardiaque. A: flux turbulent dans la veine cave supérieure (VCS); vu l’échelle de couleur (limite de Nyquist 0.75 m/s), la Vmax du flux est > 1 m/s. B : la seule vue ETO dans laquelle on puisse mesurer adéquatement la Vmax du flux veineux cave supérieur est une vue transgastrique admission du VD à 70-120° avec rotation horaire de la sonde. Elle met en évidence la VCS à 6 heures par rapport à l’OD, avec l’axe du Doppler parallèle au flux de la veine. C : flux turbulent à la jonction entre la veine cave inférieure (VCI) et l’OD en vue bi-cave 100° basse (sonde au niveau du diaphragme). On voit une zone d’accélération concentrique en amont de la sténose (Vmax > 1.2 m/s d’après l’échelle couleur). Le Doppler est bien aligné avec le flux. D : image spectrale du flux de la vue précédente ; le flux ne revient jamais à la ligne de base; la Vmax est 1.6 m/s ; le gradient de pression maximal est de 11 mmHg et le gradient moyen de 7 mmHg. Ces valeurs sont excessives et justifient une reprise chirurgicale de l’anastomose.
Dans une veine centrale, la vélocité du flux est en moyenne de 0.3 à 0.7 m/s. Une Vmax de 1.0 – 1.5 m/s est anormale mais encore tolérée; elle représente un gradient de pression maximal de 4 – 9 mmHg. Une Vmax > 1.5 m/s est considérée comme pathologique et commande une révision immédiate de l’anastomose.
Les flux artériels doivent être contrôlés au même titre que les flux veineux. Bien que moins délicates à réaliser, les anastomoses artérielles peuvent être sujettes à des sténoses, des torsions, des coudures ou des dissections [16,22].
- Anastomose aortique; elle est visible en vue long-axe de l’aorte ascendante à 120°; la Vmax du flux est mesurée en vue transgastrique profonde 0° ou long-axe 120° au Doppler continu, pour autant qu’on puisse avoir un bon déroulement de la racine de l’aorte. Le flux doit être laminaire au Doppler couleur et la Vmax < 1.7 m/s. Il est exceptionnel de rencontrer un problème de sténose à ce niveau, sauf dans les cas de cardiopathies congénitales présentant des anomalies de la jonction ventriculo-artérielle, mais une dissection sur poussée hypertensive ou érosion de plaque est possible.
- Anastomose pulmonaire; elle est visible en vue court-axe de l’aorte ascendante 0° (long-axe du tronc de l’AP qui permet un bon alignement entre le flux et l’axe Doppler), en vue admission-chasse du VD 60-90° et en vue court-axe de la crosse 90°. Le flux couleur doit être laminaire et la Vmax < 1.5 m/s. En cas de rétrécissement, le gradient maximal tolérable par un VD normal est 15-20 mmHg (Vmax 1.9 – 2.3 m/s). Une Vmax > 2.3 m/s commande une révision de l’anastomose, d'autant plus que le VD souffre déjà des RAP élevées.
- Excès de postcharge du receveur (hypertension pulmonaire);
- Tempête sympathique du donneur;
- Lésion de préservation, ischémie prolongée;
- Lésion de reperfusion;
- Embolie gazeuse de la coronair droite, qui draine facilement les bulles parce qu'elle est implantée au zénith de la racine aortique;
- Sténose ou coudure de l’anatomose de l’artère pulmonaire.
Vidéo: basculement du septum interauriculaire dans l'OG traduisant une dysfonction droite et une insuffisance tricuspidienne.
Vidéo: insuffisance tricuspidienne modérés après transplantation cardiaque.

Figure 27.202 : Evolution d’une dysfonction droite après transplantation cardiaque. A: insuffisance tricuspidienne (IT) mineure-à-modérée juste après la mise en charge. B: onze minutes plus tard, l’IT a augmenté à un degré sévère ; le septum interauriculaire est clairement bombé dans l’OG (flèche verte), bien que le VD ne soit pas encore dilaté. Les flèches jaunes indiquent les lignes de suture de l’OG.
La fonction systolique du VG est en général conservée, pour autant qu'il n'y ait pas eu de dysfonction chez le donneur, ni de prolongement de la durée d'ischémie, ni de problème de préservation à froid (Vidéo) [12]. Il souffre par contre d'une dysfunction diastolique; couplée à la diminution de la contractilité auriculaire, celle-ci donne une image de flux mitral pseudo-restrictif [14]. Toutefois, des points d'hémostase secondaire sur l'anastomose aortique peuvent léser l'origine d'une artère coronaire.
Vidéo: fonction satisfaisante et homogène du VG en vue court-axe transgastrique.
Après la mise en charge, on découvre une IM mineure dans le 60% des cas et une IT mineure-à-modérée dans le 85% des cas [2,4]. Elles sont dues en bonne partie aux modifications géométriques des oreillettes et à la tension exercée sur la partie musculaire de l’anneau atrio-ventriculaire par les sutures auriculaires. Elles sont plus fréquentes quand la taille du greffon est très différente de celle du receveur et que l'espace péricardique est excessif pour les dimensions du greffon. Le cas échéant, elles sont évidemment liées à la défaillance du ventricule sous-jacent.
La dysfonction primaire du greffon est une défaillance biventriculaire qui survient dans les premières 24 heures sans cause apparente [6,8]. Comme la définition en est assez vague, l'incidence et la mortalité de cet événement restent très variables selon les séries (moyenne 7.5% et 7-20% respectivement) [6,17]. Cliniquement, la situation est une décompensation congestive du VG et du VD avec FE < 0.4, PAPO > 20 mmHg, PVC > 15 mmHg et DC < 2.0 L/min/m2. Une fois la crise passée, la survie à long terme est identique à la moyenne [10].
Examen ultérieur
Outre la surveillance fonctionnelle, la recherche de thrombus et l’observation d’un épanchement péricardique (20% des patients), l’échocardiographie présente un intérêt majeur pour suspecter un rejet de l’allogreffe [2].
- Augmentation de l’épaisseur de paroi et de la masse du VG;
- Augmentation de l’échogénicité myocardique;
- Epanchement péricardique nouveau;
- Baisse de la FE de > 10%;
- Dysfonction diastolique restrictive;
- Apparition ou aggravation d’une insuffisance mitrale.
| ETO et transplantation cardiaque |
| Critères de sélection du donneur - FE > 0.40, FAC > 0.30 - Altérations mineures de la cinétique segmentaire acceptables - Absence de valvulopathie (IM et IT mineures acceptable) - Recherche de FOP Examen pré-CEC - Surveillance hémodynamique - Recherche de modifications anatomiques, athéromatose aortique, thrombus intracavitaire Examen post-CEC - Fonction VG (dysfonction diastolique) - Défaillance VD fréquente (dilatation hypokinésie de la paroi libre, IT, bascule septale) - Contrôle des sutures auriculaires ou des anastomoses caves, Vmax veines caves < 1.0 m/s - Contrôle de l’anastomose de l’AP (Vmax < 1.5 m/s) et de l'aorte (Vmax < 2.0 m/s) |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- AUGUSTIDES JG, RIHA H. Recent progress in heart failure treatment and heart transplantation. J Cardiothorac Vasc Anesth 2009; 23:738-48
- COSTANZO MR, DIPCHAND A; STARLING R, et al. The International Society of Hear and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010; 29:914-56
- DERUMEAUX D, MOUTON-SCHLEIFER D, SOYER R, et al. High incidence of left atrial thrombus detected by transesophageal echocardiography in heart transplant recipients. Eur Heart J 1995; 16:120-5
- DE SIMONE R, LANGE R, SACK FU, et al. Atrioventricular valve insufficiency and atrial geometry after orthotopic heart transplantation. Ann Thorac Surg 1995; 60:1686-93
- KHUSH KK, MENZA R, NGUYEN J, et al. Donor predictors of allograft use and recipient outcomes after heart transplantation. Circ Heart Fail 2013; 6:300-9
- KOBASHIGAWA J, ZUCKERMANN A, MACDONALD P, et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant 2014; 33: 327-40
- LUND LH, EDWARDS LB, DIPCHAND AI, et al. The Registry of the International Society for Heart and Lung Transplantation: thirty-third official adult transplant report – 2016: focus theme: primary diagnostic indications for transplant. J Heart Lung Transplant 2016; 35:1158-69
- LUND LH, EDWARDS LB, KUCHERYAVAYA AY, et al. The Registry of the International Society for Heart and Lung Transplantation: thirty-second official adult transplant report – 2015: focus theme: early graft failure. J Heart Lung Transplant 2015; 34:1244-54
- MANCINI D, LIETZ K. Selection of cardiac transplanation candidates in 2010. Circulation 2010; 122:173-83
- McCARTNEY SL, PATEL C, DEL RIO JM. Long-term outcomes and management of the heart transplant recipient. Best Pract Res Clin Anesthesiol 2017; 31:237-48
- MEHRA MR, CANTER CE, HANNAN MM, et al. The 2016 International Society for Heart and Lung Transplantation listing criteria for heart transplantation: a 10-year update. J Heart Lung Transplant 2016; 35:1-23
- NGUYEN L, BANKS DA. Anesthetic management of the patient undergoing heart transplantation. Best Pract Res Clin Anesthesiol 2017; 31:189-200
- OAKS TE, RAYBURN BK, BROWN ME, et al. Acquired cor triatriatum after orthotopic cardiac transplantation. Ann Thorac Surg 1995; 59:751-3
- PASCALE P, MONNEY P, JEANRENAUD X, et al. Reduced atrial emptying after orthotopic heart transplantation masquerading as restrictive transmitral Doppler flow pattern ? Echocardiography 2011; 28:168-74
- PONIKOWSKI P, VOORS AA, ANKER SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37:2129-200
- ROMANO P, MANGION JM. The role of intraoperative transesophageal echocardiography in heart transplantation. Echocardiography 2002; 19 (7 Pr 1):599-604
- SQUIERS JJ, SARACINO G, CHAMOGEORGAKIS T, et al. Application on the International Society for Heart and Lung Transplantation criteria for primary graft dysfunction after cardiac transplantation: outcomes from a high-volume centre. Eur J Cardiothorac Surg 2017; 51:263-70
- SURIANI RJ. Transesophageal echocardiographic study during organ transplantation. J Cardiothorac Vasc Anesth 1998; 12: 686-94
- VEDRINNE JM, VEDRINNE C, CORONEL B, et al. Transesophageal echocardiographic assessment of left ventricular function in brain-dead patients: are marginally acceptable hearts suitable for transplantation ? J Cardiothorac Vasc Anesth 1996; 10:708-14
- VEGA E, SCHRODER J, NICOARA A. Postoperative management of heart transplantation patients. Best Pract Res Clin Anesthesiol 2017; 31:201-13
- WEVER PINZON O, STODDARD G, DRAKOS SG, et al. Impact of donor left ventricular hypertrophy on survival after heart transplant. Am J Transpl 2011; 11:2755-61
- WOLFSOHN AL, AL, WALLEY VM, MASTERS RG, et al. The surgical anastomoses after orthotopic heart transplantation: clinical complications and morphologic observations. J Heart Lung Transplant 1994; 13:455-65
- YOUNG JB, HAUPTMAN PJ, NAFTEL DC, et al. Determinants of early graft failure following cardiac transplantation: A 10-year multi-institutional, multi-variable analysis. J Heart Lung Transplant 2001; 20:212-21
- ZAROFF JG, RORDORF GA, OGILVY CS, et al. Regional patterns of left systolic dysfunction after subarachnoid hemorrhage: evidemce for neurally mediated cardiac injury. J am Soc Echocardiogr 2000; 13:774-81
