Chirurgie de remodelage
Plusieurs techniques chirurgicales sont basées sur la réduction du stress de paroi en diminuant la dilatation du VG; elles sont souvent accompagnées d’une plastie mitrale pour réduire l’importance de l’IM.
Plusieurs techniques chirurgicales sont basées sur la réduction du stress de paroi en diminuant la dilatation du VG; elles sont souvent accompagnées d’une plastie mitrale pour réduire l’importance de l’IM.
- Ventriculectomie partielle de la paroi latérale selon Batista (opération abandonnée).
- Anévrysectomie et patch endocavitaire circulaire selon Dor; la zone infarcie est excisée, la géométrie ventriculaire est reconstruite par un patch cousu à l’intérieur de la cavité.
- Emballage externe avec un filet (Acorn CorCap™); un sac de forme conique entoure les 2 ventricules de l’apex jusqu’au sillon auriculo-ventriculaire où il est cousu; il réduit la dilatation ventriculaire de 5-10% sans causer de restriction diastolique.
- Tenseurs transventriculaires amarrées à des attelles épicardiques (Myosplint™, Coapsys™); 3 tiges souples traversent le VG dans le court-axe au niveau basal, médian et apical pour réduire la dilatation ventriculaire.
- Cardiomyoplastie externe au moyen du muscle grand dorsal emballant les ventricules; sa contraction est réglée par un pace-maker.
Le succès des assistance ventriculaires mécaniques a relégué ces interventions au second plan. Toutefois, l’ETO y tient un rôle essentiel pour évaluer la situation avant l’opération et pour contrôler le résultat après la reconstruction, ce qui justifie qu'on les mentionne ici. L’examen préopératoire doit viser certains points particuliers [3].
- Dimensions et forme du VG, épaisseur de paroi; recherche de zones anévrysmales.
- Etendue de l’akinésie et évaluation de la viabilité des zones ischémiques; les régions viables présentent une image myocardique normale, alors que les cicatrices d’infarctus sont minces et hyperéchogènes. Un test à la dobutamine (10 mcg/kg/min) sous surveillance ETO permet d’évaluer le potentiel contractile; les zones viables augmentent leur contractilité dans un premier temps et la baissent à haute dose de dobutamine; cette réponse définit les régions qui méritent une revascularisation. Les zones qui restent akinétiques peuvent être excisées. Ce test est particulièrement important pour définir le potentiel de récupération de la zone bordante et l’étendue de la résection. Actuellement, il tend à être supplanté par l’angio-IRM qui est très performante pour évaluer la viabilité tissuaire.
- Calcul du volume ventriculaire prévisible après résection de la zone infarcie et évaluation de la fonction du myocarde restant. Les sutures de la zone réséquée doivent être implantées dans du myocarde sain et renforcées par des patches; ce matelassage fait perdre davantage de volume ventriculaire que ce qui est apparant par les dimensions du territoire akinétique ou anévrysmal.
- Présence d’une IM; définition de son importance et de son mécanisme: dilatation de l’anneau (> 3.5 cm), restriction sur ischémie pariétale ou sur dilatation globale, pathologie propre des feuillets (maladie de Barlow). La définition de ce mécanisme oriente la procédure chirurgicale: plastie de réduction par un anneau restrictif, reconstruction pariétale ventriculaire, résection de feuillet. D’une manière générale, la chirurgie ne se justifie que si l’IM est modérée-à-sévère ou sévère.
- Recherche de thrombus intracavitaire.
- Evaluation de la taille, de l’hypertrophie et de la fonction du VD; position du septum interventriculaire traduisant une surcharge de volume (bombement diastolique dans le VG) ou de pression (bombement systolique dans le VG) du VD. Lorsque le VG est décomprimé, le VD perd une partie de son assistance à l’éjection.
- Evaluation de l’IT, de son étiologie et de la pression systolique pulmonaire.
- La présence d’une IT significative biaise le calcul du débit cardiaque par thermodilution pulmonaire. Le calcul du volume systolique par l’échocardiogrpahie à travers la CCVG ou la valve aortique est alors utile: VS = 0.785 • D2 • ITV (D: diamètre, ITV: intégrale des vélocités).
- Recherche de FOP: passage spontané, test aux microbulles; l’amélioration fonctionelle du VG peut induire un passage droit – gauche cyanogène en cas de dysfonction droite car la POG baisse alors que la POD reste élevée. Comme son jet est en général dirigé vers le septum interauriculaire, l’IT peut aggraver dangereusement ce passage droit – gauche.
- Recherche d’une valvulopathie modifiant significativement l’hémodynamique: sténose aortique ou mitrale, insuffisance aortique.
Après la correction chirurgicale, l’ETO est necessaire pour contrôler certains points et pour identifier les situations où un retour en CEC est nécessaire (Vidéos et Figure 27.53).
- Instabilité hémodynamique: fonction ventriculaire systolique et diastolique, nouvelles altérations de la cinétique segmentaire, volémie, vasoplégie, tamponnade.
- Volume télédiastolique du VG après résection, mesuré par la règle de Simpson; calcul du volume systolique.
- Fonction diastolique, éventuelle restriction au remplissage par un emballement trop serré.
- Fonction ventriculaire droite: dilatation, défaillance, empiètement du septum sur le VG, IT; contrôle de l’efficacité du traitement de l’insuffisance droite, décision éventuelle en faveur d’une assistance ventriculaire droite.
- Shunt droit – gauche cyanogène par réouverture du FOP.
- IM résiduelle et mécanisme, fuite paravalvulaire ou para-annulaire.
- IM ou IT nouvelles dues à une modification de la géométrie des piliers lors de la résection ventriculaire.
Vidéo: vue court-axe transgastrique du patch de correction après résection d'un anévrysme latéral du VG; le patch a un mouvement dyskinétique.
Vidéo: vue 4-cavités du patch de correction du même anévrysme latéral du VG; le rétrécissement de la cavité ventriculaire effective est évident.
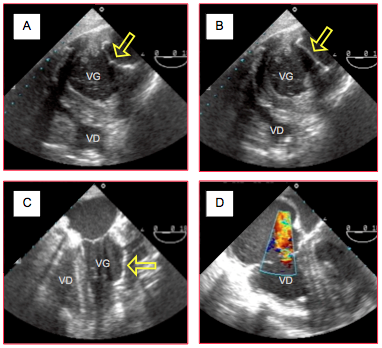
Figure 27.53 : Résection d’anévrysme ventriculaire gauche et pose de patch. A : vue du patch de la paroi latérale du VG en court-axe transgastrique ; en diastole, le patch s’invagine légèrement. B : même image en systole ; le patch bombe vers l’extérieur ; il se comporte donc comme une zone dyskinétique. C : vue 4-cavités d'un patch de la paroi latérale épargnant le pilier antérieur. D : apparition d’une IT sévère après patch d’une CIV par traction excessive sur l’appareil sous-valvulaire de la tricuspide.
Contrepulsion intra-aortique
Le mode d’assistance le plus simple est la contre-pulsion intra-aortique (CPIA). L’ETO a son rôle dans la mise en place de celle-ci [4,6].
- Contrôle de l’absence d’IA ; une IA > mineure est une contre-indication absolue à la CPIA.
- Evaluation de l’aorte descendante : athéromatose, athérome mobile, tortuosité, anévrysme, dissection; des lésions majeures ou mobiles sont une contre-indication à la CPIA.
- Lors de l’implantation du système, contrôle de l’arrivée du guide dans l’aorte descendante ; il peut se fourvoyer dans un anévrysme abdominal ou disséquer la paroi vasculaire.
- Contrôle de la position du cathéter de CPIA ; l’extrémité doit se trouver 1-2 cm en dessous du départ de l’artère sous-clavière gauche (vue long-axe de l'aorte descendante), au niveau du bord inférieur de la crosse aortique, dans laquelle elle ne doit pas apparaître. Le guide, très échogène, doit être retiré pour pouvoir distinguer le cathéter lui-même. Le ballon apparaît dans l'aorte descendante comme une série de traits éparpillés et oscillants lorsqu'il est gonflé, et comme un trait coaxial très échogène lorsqu'il est dégonflé.
Vidéo: athérome protrudant dans la lumière de l'aorte thoracique descendante; il est situé au niveau d'un éventuel ballon de contrapulsion.
Vidéo: athérome mobile de l'aorte thoracique descendante; cette lésion est très emboligène.
ECMO (extra-corporeal membrane oxygenation)
Dans le cas de l’ECMO, l’échocardiographie possède également un rôle capital pour assurer le bon fonctionnement du système [4,5]. Avant l'installation du dispositif, elle doit repérer les contre-indications et les écueils potentiels.
Dans le cas de l’ECMO, l’échocardiographie possède également un rôle capital pour assurer le bon fonctionnement du système [4,5]. Avant l'installation du dispositif, elle doit repérer les contre-indications et les écueils potentiels.
- Absence d’insuffisance aortique; la valve aortique doit être étanche en diastole et s’ouvrir en systole (pression pulsée recherchée: 10-15 mmHg). Une IA > mineure est une contre-indication absolue.
- Absence de dissection aortique, qui est une contre-indication absolue. La présence de lésions athéromateuses importantes dans l'aorte thoracique oblige à modifier le site de canulation.
- Absence de thrombus intracavitaire (apex du VG, appendice auriculaire gauche); le VG doit conserver une pulsatilité suffisante pour éviter la stase.
- La présence d'un FOP peut entraîner une désaturation artérielle par un shunt D-G en cas de décompression des cavités gauches. La présence d'une membrane d'Eustache, d'un réseau de Chiari ou d'un anévrysme du septum interauriculaire peut gêner l'influx dans la canule veineuse.
L'ETO est un outil exceptionnel pour le contrôle de la mise en place des canules et pour la surveillance de l'hémodynamique en cours de fonctionnement.
- Position de la canule veineuse au milieu de l’OD en cas de canulation centrale, 1-2 cm dans la VCS en cas de canulation fémorale. Elle ne doit pas aboutir à travers la valve tricuspide, contre le septum interauriculaire ou dans le sinus coronaire.
- Fonction du VG; en cas de canulation artérielle périphérique, celui-ci assure la perfusion des coronaires et du cerveau et requiert un soutien inotrope.
- Décharge du VG; le retour par la circulation bronchique, la défaillance droite et la mauvaise performance du VG conduisent à une dilatation du ventricule, qui mène à sont tour à l’oedème pulmonaire.
- Volémie; la taille des cavités cardiaques renseigne sur l'état de remplissage.
- Lors de canulation fémorale, la zone de confluence des flux aortiques antérograde (VG) et rétrograde (ECMO) est visible dans l’aorte descendante; il est nécessaire de maintenir une ventilation minimale pour assurer l’oxygénation du coeur et du cerveau.
- Recherche de thrombus (anticoagulation insuffisante) et de tamponnade (anticoagulation excessive).
Le sevrage est toujours un moment délicat. Son succès dépend d'un rétablissement satisfaisant de la fonction ventriculaire, testé par une période de support minimal [1,2,5].
- Absence de dilatation du VD ou du VG;
- Fraction d'éjection du VG 0.35-0.4;
- ITV dans la CCVG > 10 cm;
- Vmax de S' (descente systolique de l'anneau mitral latéral) > 6.0 cm/s;
- Absence de complication (tanponnade, thrombus, etc).
| ETO et chirurgie d'assistance ventriculaire |
| L'ETO est nécessaire pour établir certains éléments-clefs dans la stratégie chirurgicale: - Taille, remodelage et fonction des ventricules - Présence et mécanisme d'une IM et/ou d'une IT - Présence de thrombus intracavitaire et/ou de FOP - Evaluation de la zone akinétique - Evaluation du volume et de la fonction résiduels après résection/plicature Contre-pulsion intra-aortique: - Contrôle de la localization du guide - Positionnement du catheter 2 cm distalement par rapport à l'artère sous-clavière gauche - Contrôle de l'absence d'IA - Evaluation de l'éventuelle athéromatose aortique ECMO: - Absence d'IA et de dissection aortique - Positionnement de la canule veineuse - Fonction du VG, volémie - Présence de thrombus (anticoagulation inefficace) - Tamponnade (anticoagulation excessive) |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- AISSAOUI N, GUEROT E, COMBES A, et al. Two-dimensional strain rate and Doppler tissue myocardial velocities: analysis by echocardiography of hemodynamic and functional changes of the failed left ventricle during different degrees of extracorporeal life support. J Am Soc Echocardiogr 2012; 25:632-40
- CAVAROCCHI NC, PITCHER HT, YANG Q, et al. Weaning from extracorporeal membrane oxygenation using continuous hemodynamic transesophageal echocardiography. J Thorac Cardiovasc Surg 2013; 146:1474-9
- GRIGORE AM, JOE RR, SAVAGE RM, SMEDIRA NJ. Assessment in surgical procedures for congestive heart failure. In: SAVAGE RM, ed. Comprehensive textbook of intraoperative transesophageal echocardiography. Philadelphia: Lippincott, Williams & Wilkins, 2005, 615-42
- KLOPMAN MA, CHEN EP, SNIECINSKI RM. Positioning an intraaortic balloon pump using intraoperative transesophageal echocardiogram guidance. Anesth Analg 2011; 113:40-3
- PLATTS DG, SEDGWICK JF, BURSTOW DJ, et al. The role of echocardiography in the management of patients supported by extracorporeal membrane oxygenation. J Am Soc Echocardiogr 2012; 25:131-41
- SHANEWISE JS, SADEL SM. Intraoperative transesophageal echocardiography to assist the insertion and positioning of the intraaortic balloon pump. Anesth Analg 1994; 79:577-80
