Le choix de la technique est moins important que la bonne compréhension de l'hémodynamique particulière du patient. Celle-ci commence par une connaissance adéquate des données de l'échocardiographie, de l'IRM et, le cas échéant, du cathétérisme. Une recherche des données sur des opérations précédentes ou d'éventuelles malformations associées est importante. Il est capital de connaître la SpO2 à l'air ambiant en préopératoire, indépendamment des effets de tout médicament. Les cardiopathies congénitales doivent être considérées comme des affections systémiques qui touchent potentiellement tous les systèmes. Ainsi certaines malformations s’acompagnent de déformation du tissu conjonctif et du squelette qui peuvent occasionner des difficultés d'intubation ; il est judicieux de les reconnaître à l'avance.
Examens préopératoires
L’ECG, la radiographie du thorax et les examens de laboratoire habituels, y compris la crase sanguine, font partie de la routine. L’élément qui apporte le renseignement le plus essentiel est la saturométrie artérielle (SaO2, SpO2), car elle traduit la diminution du débit pulmonaire et le degré de shunt D-G. Plusieurs examens spécifiques complètent ces données (voir Tableau 15.2) [3,4,10].
- Echocardiographie: c’est l’élément primordial. Elle fournit des renseignements sur l’anatomie de base, sur la morphologie des chambres cardiaques, des valves et de leur fonction; le Doppler mesure les flux, les gradients, les shunts et, de manière indirecte, la pression du VD et/ou de l’AP (voir Calcul des pressions droites). Pour davantage de précision sur des structures fines ou postérieures, elle peut être complétée par une échocardiographie transoesophagienne. L’échocardiographie est moins performante pour l’évaluation du VD et inadéquate pour celle des vaisseaux extra-cardiaques.
- IRM: elle permet une reconstruction tridimensionnelle très fine de l’anatomie et surpasse l’écho pour l’évaluation du VD, de la fonction bi-ventriculaire, du volume des cavités, des caractéristiques tissulaires et des vaisseaux extracardiaques (veines pulmonaires, aorte, collatérales). L’IRM permet également la mesure des flux et le calcul des shunts, des gradients ou de la fraction de régurgitation.
- CT-scan: plus disponible et plus rapide que l’IRM, il offre également une excellente définition anatomique des structures, notamment extracardiaques, mais présente l’inconvénent d’utiliser des radiations ionisantes et des produits de contraste. L'angio-CT multibarrettes permet un dépistage des lésions coronariennes.
- Angio-cathétérisme: il est réservé aux situations peu claires, à la définition des vaisseaux extracardiaques, et à la mesure précise des pressions droites (PAP, RAP) et de la réactivité vasculaire pulmonaire (test au NO). En chirurgie cardiaque, la coronarographie est indiquée chez les hommes de > 40 ans et chez les femmes ménopausées.
La tolérance à l’effort est jugée par l’anamnèse du patient et par une ergométrie avec mesure de la consommation maximale d’O2. La capacité fonctionnelle est l’élément le plus important pour décider à quel moment intervenir.
Prémédication
Chez les malades qui ont un bas débit pulmonaire ou un shunt cyanogène, l'hypoventilation et l'hypoxie sont catastrophiques. La prémédication doit donc être légère et éviter les opiacés. Le jeûne préopératoire peut entraîner une déshydratation chez les patients cyanosés dont l'Ht est élevé et dont l'hyperviscosité sanguine est un facteur de risque supplémentaire. Lorsqu'ils sont opérés en deuxième partie de journée ou lorsqu'il fait très chaud, ces malades doivent bénéficier d'une perfusion liquidienne. Les congénitaux adultes sont très dépendants de leur entourage familial et médical; ils paniquent facilement dans un milieu inconnu ou ressenti comme hostile et anxiogène. Ce phénomène est particulièrement marqué chez les trisomiques. Il est donc important d’avoir beaucoup d’empathie à leur égard et de ne pas laisser percevoir le stress que leur pathologie impose à l’équipe soignante.
Equipement
Les accès vasculaires sont souvent limités par les opérations précédentes et par les contraintes anatomiques. Par exemple, la pression artérielle n'est pas mesurable au bras situé du côté d'un shunt de Blalock-Taussig, il n'y a pas d'accès veineux au coeur droit après un Fontan, la VCI est souvent interrompue lors de syndrome hétérotaxique. Chez tout malade porteur d'un shunt, il faut prendre des précautions compulsives contre l'injection accidentelle d'air dans les voies veineuses: aspiration de sang avant injection, robinet 3-voies sur toutes les tubulures, vidange de l'air résiduel des seringues, injection avec la seringue verticale pour que les bulles restent collées au piston (Vidéo CD 3.0 Fig 15-58).
Monitorage
La SpO2 est un indice extrêmement précieux chez les congénitaux; il faut donc rechercher un signal de qualité, et positionner le capteur en fonction de la pathologie. Les variations de RAS et de RAP, le débit pulmonaire effectif et le rapport Qp/Qs sont bien traduits par les variations de la saturation artérielle (SaO2, SpO2) ou tissulaire (ScO2, saturation cérébrale mesurée par spectroscopie infrarouge). Mais celles-ci ne renseignent pas sur le transport d'O2 en présence d'un gros shunt G-D (Qp/Qs ≥ 3:1). En cas de shunt D-G, la PetCO2 sous-estime la PaCO2 à cause de l'effet espace-mort du volume sanguin évitant les poumons.
Une mesure invasive de la pression artérielle est le deuxième monitorage le plus important [5]. Il renseigne instantanément sur les RAS, la volémie et la fonction systolique. En outre, il permet de faire fréquemment des gazométries et de détecter rapidement une acidose métabolique. Il est impératif de l’installer avant l’induction.
L'accès veineux central peut être problématique en cas de veine cave supérieure gauche ou de switch auriculaire après TGV. Après une opération de Glenn, le cathéter placé en jugulaire ou sous-clavière mesure la pression de l'artère pulmonaire droite; la PVC est obtenue par voie fémorale. Après détournement du retour veineux dans l'AP selon une procédure de Fontan, un cathéter veineux central mesure en réalité la pression d'amont de la circulation pulmonaire, qui doit être d'au moins 15 mmHg. Dans ces situations très thrombogènes, le cathéter doit être laissé en place le moins longtemps possible. D'autre part, les conditions hémodynamiques très spéciales des congénitaux ne permettent pas d'interpréter les pressions de remplissage en terme de volémie; la PVC ou la PAPO ne sont pas utiles pour déterminer si le patient est hypo- ou hypervolémique.
Le cathéter pulmonaire de Swan-Ganz n'est pas l'élément le plus important, et son apport est plutôt décevant chez les congénitaux car il n'évalue que la circulation pulmonaire; or le débit pulmonaire peut être différent du débit systémique (Qp/Qs ≠ 1). Bien que la mesure de la PAP soit rassurante, elle est rarement indiquée en dehors des cas de chirurgie cardiaque souffrant d'hypertension pulmonaire. Les pressions de remplissage sont des critères de volémie encore moins bons chez les congénitaux que chez les individus normaux, parce qu’elles dépendent en premier lieu des conditions anatomo-pathologiques. Le positionnement du cathéter peut être impossible ou dangereux dans de nombreux cas: switch auriculaire (opération de Mustard ou de Senning), sténose pulmonaire serrée (tétralogie de Fallot), circulation de Fontan (pas de VD). Lors de CIA ou de shunt D-G, le cathéter risque de passer à gauche. D’autre part, la présence d'un shunt ou d'une insuffisance de la valve auriculo-ventriculaire biaise les calculs du débit cardiaque et des résistances. En présence d'une insuffisance tricuspidienne (IT) significative, la situation n'est pas claire. Il est habituellement admis que la thermodilution pulmonaire sous-estime le débit cardiaque réel en cas d'IT, mais ceci ne semble vrai que dans les situations de haut débit, car l’IT conduit à une surestimation du DC en cas de bas débit [9]. Le DC est également surestimé par la thermodilution en cas de shunt G-D. Comme l'hypertension pulmonaire s'accompagne en général d'une IT, la Swan-Ganz sous-estime le DC lorsque la PAP est élevée.
Le système PiCCO évite les pièges du cathéter pulmonaire en évaluant le débit systémique, mais son étalonnage demande une thermnodilution transpulmonaire et son calcul du débit cardiaque est également faussé en présence de shunts. Il est particulièrement utile pour le postopératoire de chirurgie cardiaque, c’est-à-dire après la correction des shunts. En présence de shunt, le rapport Qp/Qs, qui s'apprécie par la SaO2 et l'équilibre acido-basique, est plus important que la valeur absolue du débit.
L'échocardiographie transoeosophagienne (ETO) peropératoire est certainement un monitorage moins invasif et beaucoup plus performant. Elle apporte de multiples renseignements sur l'anatomie, le remodelage, la physiopathologie, la fonction ventriculaire et la volémie des patients, d'autant plus que les mesures de pression de remplissage sont peu fiables pour évaluer la volémie chez les congénitaux (voir Impact de l'ETO).
Les techniques de surveillance cérébrale comme l'EEG, le BIS, le Doppler transcrânien et la saturation cérébrale en O2 (ScO2, NIRS Near-infrared spectroscopy) sont importantes lorsque la chirurgie nécessite une hypothermie profonde ou un arrêt circulatoire total. Elles sont détaillées dans le Chapitre 18 (voir Anesthésie pour la chirurgie de la crosse, Monitorage) et ne sont pas reprises ici.
Induction
Il est bon de faire précéder l'induction par une manoeuvre de Valsalva pour tester la répercussion de la ventilation en pression positive sur la pression artérielle (cathéter en place avant l’induction). Le passage direct du retour veineux systémique vers la voie artérielle en présence d'un shunt D-G accélère l'induction par des agents intraveineux; par contre, l'induction et l'élimination des agents halogénés est ralentie à cause du faible débit pulmonaire [11]. Lors de shunt G-D, l'induction avec des agents intraveineux est quelque peu ralentie; l'effet sur l'induction aux halogénés est négligeable [12]. Dans la pratique, ces notions n'ont que peu d'impact sur le déroulement de l'anesthésie.
Le choix des agents d'induction est fonction des conséquences hémodynamiques de la pathologie, mais beaucoup ont des effets qui rendent leur utilisation problématique chez les congénitaux: baisse de la précharge et des RAS (propofol, midazolam), effet inotrope négatif (thiopental, propofol), tachycardie (thiopental) [1]. La substance qui a le moins d'effet délétère est certainement l'étomidate, recommandé pour toute l'anesthésie cardiaque complexe, mais l’association fentanyl - midazolam est une bonne alternative. Toutefois, le midazolam retarde considérablement l'extubation, sauf lorsqu'il est utilisé comme simple sédation (1-3 mg). Le fentanyl et le sufentanil sont les opiacés les plus stables et les mieux maîtrisés; ils bloquent la réaction de stress de manière dose-dépendante et freinent les poussées d’HTAP. Le rémifentanil est pratique pour les cas de courte durée, mais la bradycardie qu’il induit peut être rédibitoire. La kétamine est utile chez les enfants, mais elle est inadaptée aux conditions hémodynamiques de l'adulte, parce qu'elle augmente les RAP et la consommation d'O2 myocardique, et parce qu’elle possède un effet cardiodépresseur direct important masqué par sa stimulation sympathique [13].
Conduite de l'anesthésie (Tableau 15.8)
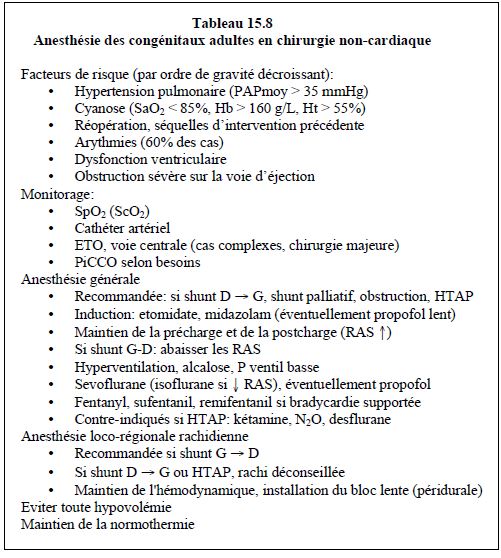
Le maintien de l'anesthésie est le plus simple avec un halogéné. Le sevoflurane présente le plus de stabilité; l'isoflurane est indiqué si l'on cherche à baisser les RAS. Le desflurane est contre-indiqué à cause de sa stimulation sympathique et de sa particularité de provoquer une hausse des RAP lorsqu'on modifie la concentration inspirée [6,7]. La kétamine et le N2O ont un effet hypertenseur pulmonaire chez l’adulte. Une anesthésie et une curarisation profondes sont en général recommandées pour abaisser la consommation d'O2 et améliorer la saturation artérielle.
Un point capital dans la conduite de l'anesthésie est le maintien de la normothermie: salle chauffée, couverture isolante et chauffante, etc. Ceci est particulièrement important pour diminuer le risque de poussée hypertensive pulmonaire et de troubles de la coagulation [8].
Anesthésie loco-régionale versus générale (chirurgie non-cardiaque)
Dans une situation hémodynamiquement complexe, on a souvent tendance à croire qu'une anesthésie loco-régionale est moins risquée qu'une anesthésie générale. Si cela est vrai pour les blocs distaux des membres, ce n'est certainement pas le cas pour l'anesthésie rachidienne, et particulièrement pour la rachi-anesthésie. En effet, celle-ci présente trois inconvénients majeurs: elle provoque une vasodilatation artérielle systémique, abaisse la précharge et ne permet pas d'hyperventiler le patient.
La baisse des résistances artérielles systémiques aggrave un shunt D-G (Figure 15.61), un shunt bi-directionnel avec HTAP ou sténose pulmonaire, et un shunt correctif G-D pour bas débit pulmonaire (Figure 15.63). Par contre, elle diminue un shunt G-D, comme dans les CIA ou les CIV (Figure 15.62). L'anesthésie loco-régionale rachidienne est donc recommandée en cas de shunt G-D, mais non dans les shunts D-G, sauf si l'on procède à une péridurale avec une installation très lente du bloc. La rachianesthésie est vivement déconseilléée dans les shunts D-G et dans les obstructions sévères de la voie d'éjection gauche [2]. La péridurale thoracique haute (C7-D5) ne diminue pas les RAP car les vaisseaux pulmonaires sont très pauvres en récepteurs α1; comme la stimulation sympathique provoque une vasodilatation pulmonaire, son inhibition tend donc à augmenter la PAP. De plus, la péridurale induit une sympathicolyse cardiaque qui baisse le débit et la fréquence. La formation de méthémoglobine par la prilocaïne peut être extrêmement dangereuse chez les malades cyanosés [2].
Lors d'hypertension pulmonaire ou de situations où il est souhaitable de baisser les RAP, une anesthésie générale est préférable, car elle permet l'hyperventilation. Ceci compense largement le risque d'augmenter la postcharge du VD, car les RAP sont déjà tellement élevées (PAPmoy 30-50 mmHg) que l'IPPV n'augmente proportionnellement que très peu l'impédance à l'éjection droite (voir Ventilation et HTAP).
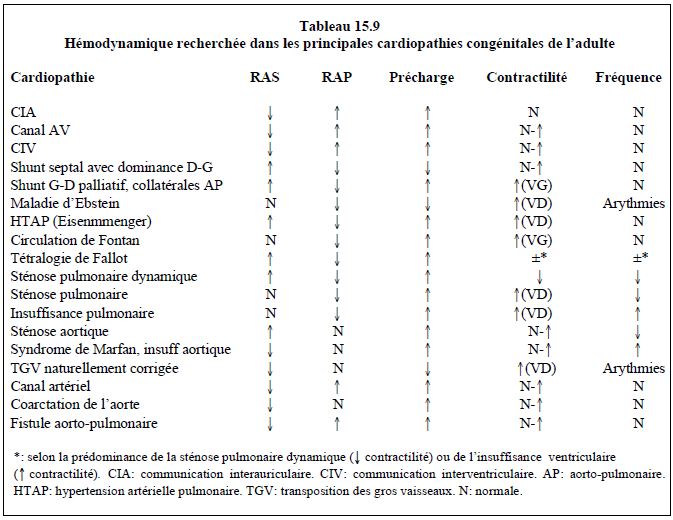
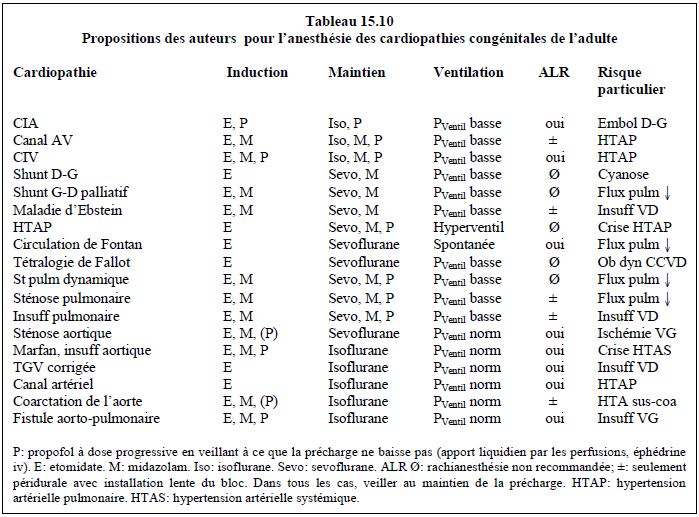
Les conditions hémodynamiques recherchées et les recomandations proposées par les auteurs pour l’anesthésie chez les congénitaux adultes sont résumées dans les Tableaux 15.9 et 15.10.
| Anesthésie des congénitaux adultes |
|
Facteurs de risque peropératoire (par ordre de gravité)
- HTAP (PAPmoy > 25 mmHg)
- Cyanose (SaO2 < 85%)
- Réopération, séquelles d’intervention précédente
- Arythmies
- Dysfonction ventriculaire
- Obstruction sévère sur la voie d’éjection
Monitorage essentiel
- ECG, SpO2, si possible ScO2
- Cathéter artériel (position selon la pathologie) en place avant l’induction
- Echocardiographie transoesophagienne
Anesthésie générale
- Technique préférentielle pour la chirurgie non-cardiaque
- Indications particulières: shunt D-G, shunt palliatif, HTAP, obstruction
- Hyperventilation, alcalose, P ventilation basse
- Induction: etomidate, midazolam, propofol lent si cardiopathie stable
- Maintien: sevoflurane (isoflurane pour baisser RAS), propofol
- Fentanyl ou sufentanil, remifentanil si bradycardie tolérée
- Contre-indiqués si HTAP : kétamine, N2O, desflurane
- Maintien rigoureux de la précharge et de la normothermie
Anesthésie loco-régionale rachidienne
- Maintien de la précharge
- Indication particulière: shunt G-D
- Shunt D-G: rachi déconseillée, péridurale possible avec installation du bloc très lente
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Janvier 2018
Références
- ANDROPOULOS DB. Anesthetic agents and their cardiovascular effects, In: ANDROPOULOS DB, STAYER SA, RUSSEL IA. Anesthesia for congenital heart disease. Oxford: Blackwell Publishing, 2005, 49-63
- BAEHNER T, ELLERKMANN RK. Anesthesia in adults with congenital heart disease. Curr Opin Anaesthesiol 2017; 30:418-25
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital hesart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- CHASSOT PG, BETTEX DA. Anesthesia and adult congenital heart disease. J Cardiothorac Vasc Anesth 2006; 20:414-37
- CIOFOLO M, REIZ S. Circulatory effects of volatile anesthetic agents. Minerva Anaesthesiol 1999; 65:232-8
- EBERT TJ, MUZI M. Sympathetic hyperactivity during desflurane anesthesia in healthy volunteers: a comparison with isoflurane. Anesthesiology 1993; 79:444-53
- FRANK SM, FLEISHER LA, BRESLOW MJ, et al. Perioperative maintenance of normothermia reduces the incidence of morbid cardiac events. A randomized clinical trial. JAMA 1997; 277: 1127-34
- HEERDT PM, BLESSIOS GA, BEACH ML, et al. Flow dependency of error in thermodilution measurement of cardiac output during acute tricuspid regurgitation. J Cardiothorac Vasc Anesth 2001; 15:183-7
- HO VB. Radiologic evaluation of suspected congenital heart disease in adults. Am Fam Physician 2009; 80:597-602
- HUNTINGTON JH, MALVIYA S, VOEPEL-LEWIS T, et al. The effect of a right-to-left intracardiac shunt on the rate of rise of arterial and end-tidal halothane in children. Anesth Analg 1999; 88:759-62
- LAIRD TH, STAYER SA, RIVENES SM, et al. Pulmonary-to-systemic blood flow ratio effects of sevoflurane, isoflurane, halothane and fentanyl/midazolam with 100% oxygen in children with congenital heart disease. Anesth Analg 2002; 95:1200-6
- LOVELL AT. Anaesthetic implications of grown-up congenital heart disease. Br J Anaesth 2004; 93:129-39
