Un examen fonctionnel complet est essentiel en début d’intervention, car ses données vont servir de valeurs de référence auxquelles comparer les données ultérieures. Cet examen modifie la stratégie chirurgicale dans 7-10% des cas en moyenne [1,2,5,6,8,12]. En plus des problèmes spécifiques à la cardiopathie pour laquelle le patient est opéré, on doit rechercher systématiquement un certain nombre de pathologies qui interfèrent avec la conduite de la CEC ou de la chirurgie (Figure 25.232).
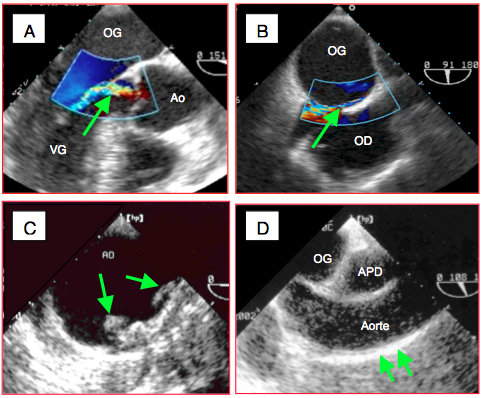
Figure 25.232 : Diagnostics ETO avant la CEC. A: insuffisance aortique en vue long-axe; même modeste, une IA peut provoquer une dilatation aiguë du VG au cours de la cardioplégie. B: foramen ovale perméable; passage G-D au flux couleur. C: athérome stade IV de l'aorte descendante. D: aorte ascendante "porcelaine" avec une large infiltration calcifiée linéaire sur sa face antérieure, à l'endroit de la canulation de CEC (flèches).

Figure 25.232 : Diagnostics ETO avant la CEC. A: insuffisance aortique en vue long-axe; même modeste, une IA peut provoquer une dilatation aiguë du VG au cours de la cardioplégie. B: foramen ovale perméable; passage G-D au flux couleur. C: athérome stade IV de l'aorte descendante. D: aorte ascendante "porcelaine" avec une large infiltration calcifiée linéaire sur sa face antérieure, à l'endroit de la canulation de CEC (flèches).
- Ventricule droit: la fonction droite est un des déterminants majeurs des complications postopératoires; la taille et la performance systolique du VD doivent être connues avant la CEC pour juger des éventuelles altérations postopératoires (Vidéo). Le VD est susceptible d'être insuffisamment cardioplégié, notamment avec la cardioplégie rétrograde, et d'être la cible d'embolie gazeuse parce que la CD émerge sur la face antérieure de la racine aortique.
Vidéo: vue admission-chasse 60° du VD en cas de dysfonction droite. La chambre de chasse conserve une contractilité évidente, et la paroi libre est entraînée par la contraction de la chambre d'admission, elle-même liée à celle du VG. Cependant, l'inspection attentive de la paroi libre montre qu'elle ne s'épaissit pas en systole.
- Fonction et taille du VG: elles sont systématiquement quantifiées (FE, règle de Simpson, Doppler tissulaire, etc). Le volume systolique (VS) est le produit de la surface d'ouverture de la valve aortique et de l'intégrale des vélovités (ITV) au même endroit; comme cette surface ne se modifie pas pendant les quelques heures de l'intervention, il suffit de mesurer l'ITV (20-25 cm) pour suivre l'évolution du VS et du débit cardiaque. La mesure peut aussi se faire de la même manière au niveau de la chambre de chasse. L'homogénéité de la contraction est soigneusement observée, à la recherche d'anomalies de la contraction segmentaire.
- Insuffisance aortique (IA) : même minime, elle peut provoquer une dilatation du VG pendant l’administration de la cardioplégie dans la racine de l’aorte. La présence d'une IA est une contre-indication à la contrepulsation intra-aortique, à la chirurgie minimalement invasive (port-access system HeartPort™) ou à une assistance ventriculaire (Vidéo).
Vidéo: insuffisance aortique modérée en vue long-axe de la racine aortique.
- Insuffisance tricuspidienne (IT) : évaluation de la PAP systolique. La modeste corrélation de cette mesure avec la PAPs mesurée par cathétérisme ne permet que de classer le malade dans une des trois catégories "PAP normale", PAP "modérément élevée" ou "hypertension pulmonaire" [7,13].
- Insuffisance mitrale (IM) : quantification et mécanisme ; une réparation mitrale imprévue est nécessaire dans 4% des pontages aorto-coronariens.
- Foramen ovale perméable (FOP) : sa présence dans 17% des cas peut occasionner un passage d’air dans les cavités gauches (ouverture de l’OD, canules veineuses, embols depuis la périphérie, assistance gauche) [10]. En cas d’association à un anévrysme du septum interauriculaire (débattement > 1.5 cm) ou à une anamnèse d’accident vasculaire cérébral (AVC), il faut discuter de son éventuelle fermeture en passant (nécessite une double canulation veineuse), pour autant que l'intervention comprennne une cardiotomie.
- Rétrécissement de la CCVG (< 1.8 cm), éperon septal, distance réduite entre le point de coaptation mitral et le septum (< 2.5 cm): risque de sténose sous-aortique dynamique (Vmax CCVG ≥ 2.5 m/s) en cas d’hypovolémie, de stimulation béta ou de postcharge basse (vasoplégie, résection de sténose aortique) ; discuter d’une résection de l’éperon septal.
- Aorte thoracique : présence d’athérome dans l’aorte ascendante (Vidéo). La fréquence des AVC est directement proportionnelle à la sévérité de l’athéromatose aortique. La présence d’athérome dans l’aorte descendante (bien visible en ETO) est associée dans 35% des cas au même degré d’athérome dans l’ascendante [9]. Cet examen permet d’adapter la canulation artérielle de CEC. Au niveau de la zone aveugle de l’ETO (interposition de la bronche souche droite), on peut procéder à une échographie épiaortique (voir Chapitre 27, Echographie épiaortique).
Vidéo: vue long-axe de l'aorte ascendante présentant une zone antérieure hyperéchogène calcifiée à l'endroit de la canulation de CEC. - Dilatation de l’OG et/ou FA : recherche de thrombus dans l’appendice auriculaire gauche (AAG).
- Akinésie apicale du VG : recherche d’un thrombus apical (2-cavités et long axe mi-oesophage, long axe transgastrique).
- Altérations de la cinétique segmentaire (ACS), anévrysme (recherche de thrombus, dimension du collet, implication des piliers).
- Rapport des surfaces endocavitaires du VD et du VG en 4 cavités (SVD ≤ 0.6 SVG), position du septum interventriculaire.
- Dilatation du sinus coronaire (Ø > 10 mm) : présence éventuelle d’une VCSG (0.5% de la population) rendant la cardioplégie rétrograde impossible (Figure 25.233).
- Aide à la canulation des voies veineuses: contrôle de l'arrivée du mandrin de voie centrale dans l'OD. S'il n'est pas visible dans l'OD dès 20 cm depuis le point de ponction, il faut rechercher sa localisation du côté artériel; une ponction carotidienne le conduit habituellement dans l'aorte ascendante où on le trouve au-dessus de la valve aortique, mais sa forme en "J" peut le faire bifurquer dans la crosse et on le voit alors dans la partie proximale de l'aorte descendante, au sortir de la crosse (Figure 25.234).
- Aide au passage du cathéter pulmonaire: l'imagerie ETO en vue bi-cave 100°, admissison-chasse du VD 60° et court-axe de l'aorte ascendante 0° permet de guider la progression du cathéter; dans la moitié des cas, elle permet à elle seule de diriger les manipulations pour faire entrer le cathéter dans l'artère pulmonaire droite [3,4].
- Aide à la canulation chirurgicale: guidage des canules artérielles dans l’aorte, des canules veineuses dans l’OD et les veines caves, de la canule de cardioplégie dans le sinus coronaire; contrôle d’implantation de canules d’assistance ventriculaire, recherche de dissection par la canule aortique (dissection type A) ou artérielle fémorale (dissection rétrograde de type B) (Figure 25.235).
- Chirurgie minimalement invasive : guidage de l’intervention lors d’endoprothèse aortique (TAVI), de plastie mitrale percutanée (Mitraclip), etc (voir Chapitre 10).
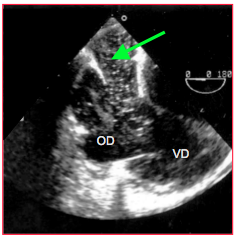
Figure 25.233 : Dilatation du sinus coronaire associé à une veine cave supérieure gauche en vue 4-cavités basse. Des microbulles introduites par une voie veineuse au bras gauche arrivent dans l'OD via le sinus coronaire (flèche).
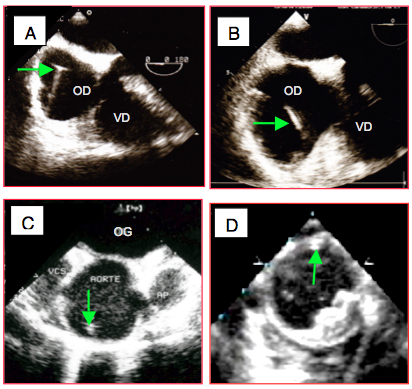
Figure 25.234 : Mise en place de voie centrale. A : mandrin de voie veineuse centrale en place dans l’OD. B : sonde de pace-maker dans l’OD ; elle se reconnaît à son aspect annelé et plus épais. C : cathéter de voie centrale malencontreusement introduit dans l'aorte ascendante. D: cathéter de voie centrale ayant bifurqué de la carotide vers la crosse; on le voit dans la partie proximale de l'aorte descendante. Un cathéter donne une image double car les ultrasons repèrent les deux parois qui leur sont perpendiculaires.
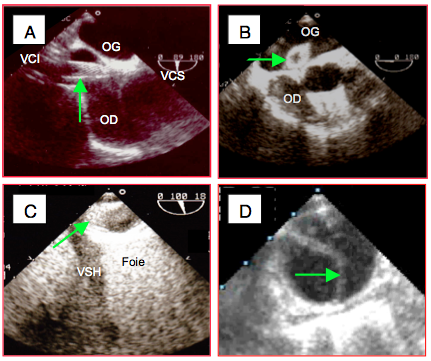
Figure 25.235 : Canules de CEC. A: canule veineuse de CEC introduite par voie fémorale jusque dans l’OD. B: canule de CEC traversant malencontreusement un FOP, elle se retrouve dans l’OG. C: Canule veineuse descendue depuis l'OD dans la veine cave inférieure en vue trasngastrique long-axe de celle-ci; la canule s'est malencontreusement retournée sur elle-même. VSH: veine sus-hépatique. D: dissection aiguë de type B provoquée par le flux rétrograde dans l'aorte thoracique descendante depuis une canulation de CEC par l'artère fémorale.
L’anesthésie générale et la ventilation en pression positive modifient considérablement les conditions hémodynamiques, au point de réduire significativement l’importance des insuffisances valvulaires et le gradient des sténoses. Il est donc de la plus haute importance de rétablir des paramètres cardiovsaculaires dans la limite de l’état éveillé pour pouvoir quantifier les valvulopathies [11]. Il en est de même de la fonction ventriculaire : une FE de 50% ne représente pas la même contractilité si la pression artérielle systolique est de 80 ou de 160 mmHg.
| Examen ETO pré-CEC |
| L'examen complet des structures cardiaques est de rigueur avant la CEC: - Taille et fonction quantifiée des deux ventricules - Recherche d'insuffisance aortique - Présence d'une insuffisance mitrale ou tricuspidienne - Recherche de FOP - Conditions pour une obstruction dynamique de la CCVG - Athéromes de l'aorte ascendante - Altérations de la cinétique segmentaire - Contrôle des canulations |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- BERGQUIST BD, LEUNG JM, BELLOWS WH. Transesophageal echocardiography in myocardial revascularisation: I Accuracy of intraoperative real-time interpretation. Anesth Analg 1996 ; 82:1132-8
- BETTEX DA, PRETRE R, JENNI R, SCHMID ER: Cost effectiveness of routine intraoperative transesophageal echocardiography in pediatric cardiac surgery: a ten-year experience. Anesth Analg 2005; 100:1271-5
- CRONIN B, KOLOTINIUK N, YOUSSEFZADEH K, et al. Pulmonary artery catheter placement aided by transesophageal echocardiography versus pressure waveform transduction. J Cardiothorac Vasc Anesth 2018; 32:2578-82
- CRONIN B, ROBBINS R, MAUS T. Pulmonary artery catheter placement using transesophageal echocardiography. J Cardiothorac Vasc Anesth 2017; 31:178-83
- DESJARDINS G, CAHALAN M. The impact of routine trans-oesophageal echocardiography (TOE) in cardiac surgery. Best Pract Res Clin Anaesthesiol 2009; 23:263-71
- ELTZSCHIG HK, ROSENBERGER P, LÖFFLER M, et al. Impact of intraoperative transesophageal echocardiography on surgical decisions in 12,566 patients undergoing cardiac surgery. Ann Thorac Surg 2008;85 :845-53
- JANDA S, SHAHIDI N, GIN K, SWISTON J. Diagnostic accuracy of echocardiography for pulmonary hypertension: a systematic review and meta-analysis. Heart 2011; 97:612-22
- KLEIN AA, SNELL A, NASHEF SAM, et al. The impact of intra-operative transoesophageal echocardiography on cardiac surgical practice. Anaesthesia 2009; 64:947-52
- KONSTADT SN, REICH DL, KAHN R, et al. Transesophageal echocardiography can be used to screen for ascending aortic atherosclerosis. Anesth Analg 1995; 81:225-8
- LO TTH, JARRAL OA, SHIPOLINI AR, et al. Should a patent foramen ovale found incidentally during isolated coronary surgery be closed ? Interact Cardiovasc Thorac Surg 2011; 12:794-8
- MAHMOOD F, LERNER AB, MAYTAL R, et al. Dobutamine stress echocardiography and intraoperative assessment of mitral valve. J Cardiothorac Vasc Anesth 2006; 20:867-71
- MICHEL-CHERQUI M, FISCHLER M. Echocardiographie peropératoire en chirurgie cardiaque. In: VIGNON P et al, éd. Echocardiographie Doppler chez le patient en état critique. Paris: Elsevier-Masson, 2008, 433-80
- SOLIMAN D, BOLLIGER D, SKARVAN K, et al. Intra-operative assessment of pulmonary artery pressure by transoesophageal echocardiography. Anaesthesia 2015; 70:264-71
