Ponter un anévrysme de manière non invasive avec une prothèse endovasculaire est une idée qui remonte aux années cinquante, mais dont la réalisation pratique date de 1990 [14]. Comparée au remplacement aortique à ciel ouvert, cette technique diminue les pertes sanguines, la morbidité et la durée du séjour hospitalier; elle améliore la stabilité hémodynamique, évite le clampage aortique et autorise l’anesthésie locale ou loco-régionale [1]. La prothèse est un tube de Dacron™ armé imperméable prévu pour durer 10 ans (Figure 18.47).
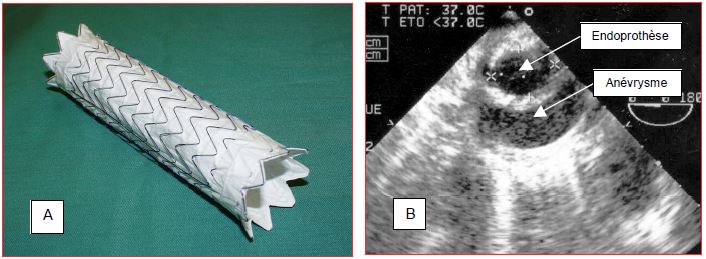
Figure 18.47 : Endoprothèse aortique. A. Endoprothèse dépliée telle qu'elle se positionne dans l'aorte. B: Image ETO d'une coupe transversale de l'aorte thoracique descendante montrant une endoprothèse en place dans un anévrysme; dans ce cas, elle a pris une forme elliptique (1.75 cm x 2.40 cm).
L'endoprothèse est introduite pliée autour d'un guide par voie artérielle fémorale sous contrôle fluoroscopique, et se fixe à la paroi de l'aorte par de petits crochets ou par simple friction lorsqu'elle s'expand (Vidéo). Ceci requiert une certaine longueur de vaisseau sain pour que la partie proximale et la partie distale soient correctement amarrées: le collet supérieur doit mesurer au minimum 15 mm de long et ne doit pas dépasser 40 mm de diamètre, l’alignement entre le collet et l’anévrysme doit être satisfaisant (angulation < 60°), et la prothèse doit être surdimensionnée de 10-15% par rapporte à l'aorte native [8,12]. Entre 20 et 50% des patients remplissent ces critères [10]. De nouvelles prothèses bifurquées, fenestrées et munies d'embranchements permettent de maintenir un débit normal dans les artères viscérales.
Vidéo: Déploiement d'une endoprothèse dans l'aorte thoracique (vue long-axe de l'aorte descendante).
Vidéo: Déploiement d'une endoprothèse dans l'aorte thoracique (vue long-axe de l'aorte descendante).
Il persiste souvent de petites communications entre l'intérieur de la prothèse et l'anévrysme, appelées endofuites: elles peuvent survenir par défaut d’accolement aux extrémités de la prothèse, ou être dues à des déchirures du matériel. Ces fuites surviennent dans 17% des cas en salle d'opération, et dans 9% des cas à 30 jours [17]. Elles se répartissent en 4 catégories (Vidéo et Figure 18.48) [9].
- Type I: fuite au niveau d'un ou des collet(s), avec reperfusion distale ou proximale du sac anévrysmal;
- Type II: perfusion rétrograde du sac par des branches artérielles;
- Type III: déconnexion et fuite entre endoprothèses embouties ou orifices dans la prothèse;
- Type IV: porosité de la prothèse.
Vidéo: Endofuite au niveau du collet distal d'une endoprothèse de l'aorte thoracique descendante.
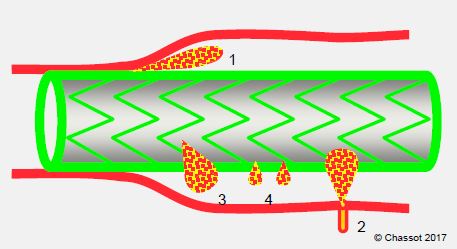
Figure 18.48 : Schéma des différents types d’endofuites caractéristiques de l’endoprothèse. 1 : fuite au niveau du collet. 2 : fuite de branches vasculaires. 3 : défauts dans la prothèse ou dans la jonction entre deux prothèses. 4 : porosité de la prothèse.
Les types I et III sont considérés comme des échecs de la procédure et requièrent un traitement endovasculaire immédiat. Les fuites de type II sont surveillées s'il s'agit de petits vaisseaux mais peuvent être embolisées ou ligaturées chirurgicalement s'il s'agit de vaisseaux importants. La porosité n'est plus un problème avec les nouvelles prothèses. Il existe une cinquième type consistant en une expansion continue du sac anévrysmal sans fuite clairement visible [7]. Autour de la prothèse, l'anévrysme, exclu de la circulation, se thrombose et diminue progressivement de diamètre.
Passée la courbe d'apprentissage de l'équipe chirurgicale, le taux de succès immédiat est de plus de 98% [17]. Le taux de conversion en tomie immédiate est de 0.7-3%, et à long terme de 7% [6]. La mortalité opératoire est de 1-2% et le taux de rupture secondaire de 1-1.7% / année [13]. Par rapport à la chirurgie à ciel ouvert, l’endoprothèse réduit la mortalité opératoire de 2 à 3 fois, mais n’offre pas d’avantage en terme de survie au-delà de 2 ans; de ce fait, elle plus indiquée chez les personnes âgées que chez les jeunes [4]. Outre l’anévrysme, l’endoprothèse est indiquée dans les dissections B, les déchirures traumatiques localisées (< 1/3 de la circonférence), les athéromes ulcérés. Le syndrome de Marfan est une contre-indication car le vaisseaux continue à se dilater autour de la prothèse.
Par rapport à une intervention conventionnelle par thoracotomie ou laparotomie, l'endoprothèse présente un certain nombre de caractéristiques.
- Opération peu invasive et peu douloureuse; elle consiste en une ou deux incisions inguinales; elle dure 1-3 heures dans les cas simples, > 5 heures dans les prothèses multiples.
- Grande stabilité hémodynamique et neuro-humorale; les sécrétions d'adrénaline et d'hormones de stress sont significativement plus basses que dans la cure chirurgicale à ciel ouvert [15].
- Pertes sanguines de 300 à 1000 mL, moyennes de 630 mL [2].
- Pas de clampage aortique; le largage de l'endoprothèse se fait sous hypotension contrôlée (PAsyst ≤ 80 mmHg). Les nouvelles prothèses disposent d'un système de rétention proximal qui évite l'effet voile et ne nécessite plus un arrêt hémodynamique par de l'adénosine ou par un ballon gonflé proximalement.
- Possibilité d'envisager l'intervention chez des malades en mauvais état général.
- Possibilité de traitement immédiat lors de rupture aortique chez des polytraumatisés.
- Un axe ilio- fémoral au moins doit avoir un diamètre supérieur à 7.5 mm pour accepter le passage de la prothèse pliée dans sa gaine, mais la tendance vers la miniaturisation diminue cette exigence.
- Contrôles radioscopiques répétés, impliquant un taux d'irradiation significatif (durée moyenne 23 minutes) pour le malade (une fois) et pour le personnel (fréquemment). L’utilisation d’ultrasons intravasculaires (IVUS) diminue le taux d’irradiation [16]. Toutefois, l'IVUS ne dispose pas de Doppler couleur, et l'ETO est nécessaire pour confirmer l'exclusion du sac anévrysmal et déceler la présence d'endofuite; en son absence, on recourt à l'angiographie avec produit de contraste.
- Héparinisation systémique réduite (héparine 100 U/kg iv, soit 5'000 – 10'000 UI pour un adulte).
- Pas de séjour en soins intensifs; reprise de l'alimentation per os 6 heures après l’intervention.
- Diminution du séjour hospitalier (2-3 jours).
- Baisse significative des coûts hospitaliers, mais coût total peu modifié vu le prix des prothèses (€ 6'000 – 15'000.- ) [3,5,10].
- Résultats à long terme (> 12 ans) inconnus [4,11].
Les patients sont extubés en fin d’intervention et placés sous aspirine (75-150 mg/j) et/ou stéroïdes. Le clopidogrel n’est nécessaire que pour les endoprothèses carotidiennes. Les endoprothèses contenant du polyesthène suscitent une réaction inflammatoire systémique importante (syndrome post-implantatoire), qui se caractérise par de la fièvre, une élévation de la CRP, une coagulopathie et une leucocytose apparaissant entre le 2ème et le 10ème jour postopératoire [18]; ce phénomène a pratiquement disparu avec les nouveaux dispositifs dans la composition desquels cette substance n'entre plus. Les endoprothèses sont homologuées par l’ISO pour une durabilité de 10-12 ans; le taux de réintervention à 8 ans est de 30% [4]. Bien que la chirurgie par thoracotomie ou laparotomie ait considérablement régressé, on ne connaît pas le sort des endoprothèses à long terme chez les patients jeunes.
| Endoprothèses aortiques |
|
Par rapport à la chirurgie à ciel ouvert, la voie endovasculaire diminue la morbi-mortalité, évite le clampage aortique et raccourcit le séjour hospitalier. Mais elle ne semble pas modifier la survie à long terme. Elle requière certaines conditions anatomiques pour assurer sa stabilité aux deux extrémités de l'anévrysme ou de la lésion aortique (dissection, traumatisme, déchirure). De nouvelles prothèses bifurquées, fenestrées et munies d'embranchements permettent de maintenir un débit normal dans les artères viscérales. Dans moins de 10% des cas, il subsiste de petites endofuites entre la prothèse et l'anévrysme.
L'intervention peut se dérouler sous anesthésie générale, loco-régionale ou locale avec sédation.
Dans le postopératoire, la prothèse induit une réaction inflammatoire systémique importante (syndrome post-implantatoire).
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- BETTEX DA. New techniques in endovascular surgery: challenges for the anaesthetist ? Anaesthesia Intern 2012; 6:28-33
- BETTEX DA, LACHAT M, PFAMMATER T, et al. To compare general, epidural and local anaesthesia for endovascular aneurysm repair. Eur J Vasc Endovasc Surg 2001; 21:179-84
- CEELEN W, SONNEVILLE T, RANDON C, et al. Cost-benefit analysis of endovascular versus open abdominal aortic aneurysm treatment. Acta Chir Belg 1999; 99:64-7
- COADY MA, IKONOMIDIS JS, CHEUNG AT, et al. Surgical management of descending thoracic aortic disease: open and endovascular approaches. Circulation 2010; 121:2780-804
- CRUZ CP, DROUILHET JC, SOUTHERN FN, et al. Abdominal aortic aneurysm repair. J Vasc Surg 2001; 35: 335-444
- CUYPERS PW, LAHEIJ RJ, BUTH J. Which factors increase the risk of conversion to open surgery following endovascular abdominal aortic aneurysm repair ? Eur J Vasc Endovasc Surg 2000; 20:183-9
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FORT ACP, RUBIN LA, MELTZER AJ, et al. Perioperative management of endovascular thoracoabdominal aortic aneurysm repair. J Cardiothorac Vasc Anesth 2017; 31:1440-59
- GRABENWÖGER M, ALFONSO F, BACHET J, et al. Thoracic endovascular aortic repair (TEVAR) for the treatment of aortic diseases: a position statement from the EACTS and the ESC, in collaboration with the EAPCI. Eur Heart J 2012; 33:1558-63
- GREENHALGH RM, POWELL JT. Endovascular repair of abdominal aortic aneurysm. N Engl J Med 2008; 358:494-501
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- KAHN RA, MOSKOWITZ DM. Endovascular aortic repair. J Cardiothorac Vasc Anesth 2002; 16:218-33
- KUCHTA KF. Endovascular abdominal aortic aneurysm repair. Semin Cardiothorac Vasc Anesth 2003; 7:205-11
- PARODI JC, PALMAZ JC, BARONE HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991; 5:491-9
- SALARTASH K, STERNBERGH WC, YORK JW, et al. Comparison of open tarnsabdominal AAA repair with endovascular AAA repair in reduction of postoperative stress response. Ann Vasc Surg 2001; 15:53-9
- SMAKA TJ, COBAS M, VELAZQUES OC, et al. Perioperative management of endovascular abdominal aortic aneuvrysm repair: update 2010. J Cardiothorac Vasc Anesth 2011; 25:166-76
- VALLABHANENI SR, HARRIS PL. Lessons learned from the EU-ROSTAR registry on endovascular repair of abdominal aortic aneurysm repair. Eur J Radiol 2001; 39:34-41
- VELAZQUEZ OC, CARPENTER JC, BAUM RA, et al. Perigraft air, fever, and leucocytosis after endovascular repair of abdominal aortic aneurysms. Am J Surg 1999; 178:185-9
