La sténose valvulaire aortique est la valvulopathie la plus courante de l'adulte ; sa prévalence est d'environ 5% à partir de 65 ans [3,5,6,10]. Elle relève de plusieurs étiologies.
- La cause la plus fréquente est la dégénérescence calcifiante d'une valve normale à trois cuspides, rencontrée en général chez le patient de plus de 65 ans. Des dépôts calcifiés en forme d’excroissances nodulaires sans fusion commissurale rigidifient les valvules et les bloquent en position semi-fermée. Cette calcification valvulaire est fréquemment associée à une calcification de l’anneau mitral et à une athéromatose artérielle systémique, chez des malades qui présentent une hypercholestérolémie, une hypertension artérielle, un diabète et un tabagisme ; la présence de processus inflammatoire dans les lésions calcifiantes traduit la parenté entre la sténose aortique et l’athérosclérose (Vidéos) (Figure 11.100 et Figure 11.101) [13].
Vidéo: Sténose aortique serrée en vue court-axe 50°; la valve est tricuspide et fortement calcifiée.
Vidéo: Vue tridimensionnelle long-axe d'une sténose aortique serrée.
- La bicuspidie aortique congénitale (prévalence : 1-2% de la population, dont 2% développe une sténose) est identifiée par une ouverture ellipsoïde et par deux cuspides de tailles inégales, dont la plus grande contient souvent un raphé médian (Vidéos et Figure 11.102) [6].
Vidéo: Vue tridimensionnelle court-axe d'une bicuspidie aortique.
Vidéo: Vue tridimensionnelle court-axe ("en face" vue de l'aorte) d'une sténose aortique serrée sur bicuspidie.
Ne pouvant pas s’ouvrir pleinement en systole pour être parallèles au flux, les bords libres des deux feuillets sont soumis aux vibrations du flux rendu turbulent par le léger rétrécissement de la surface aortique ; ce stress conduit à une fibrose et à une calcification dystrophique qui survient entre 30 et 60 ans (60% des cas de bicuspidie). Les calcifications ont un aspect en chou-fleur envahissant les cuspides et le raphé médian. L’ouverture résiduelle prend la forme d’une fente. La bicuspidie peut être associée à une coarctation et à un anévrysme de l’aorte thoracique. - La lésion secondaire au RAA est plus rare actuellement dans les pays industrialisés (< 10 % des cas). Caractérisée par une fusion commissurale, une fibrose et une néovascularisation des cuspides, elle présente un épaississement faiblement calcifié des feuillets qui prédomine au niveau des commissures (voir Figure 11.100B); elle est fréquemment associée à une maladie mitrale de même origine. Elle évolue plus lentement que la dégénérescence calcifiante.
- La sclérose aortique est un épaississement irrégulier des feuillets sans sténose ni augmentation du gradient de pression ; elle est présente chez 25% des personnes âgées de > 65 ans. Elle est associée à l’hypertension artérielle, à l’hypercholestérolémie, au diabète, au tabagisme et à un risque accru d’infarctus myocardique [12].
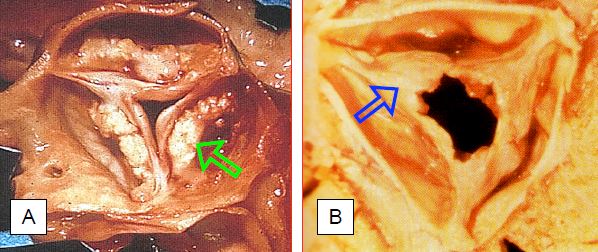
Figure 11.100 : Images anatomo-pathologiques de sténose aortique acquise de valves aortiques tricuspides. A : dégénérescence calcifiée de la personne âgée ; les calcifications sont situées dans le corps des feuillets. B : sténose après RAA ; les calcifications sont moins importantes et sont situées dans les commissures qui sont fusionnées [Extrait de : Braunwald E. Valvular heart disease. In: Braunwald E. ed. Heart disease. Philadelphia, WB Saunders Co, 1997, 1007-76].
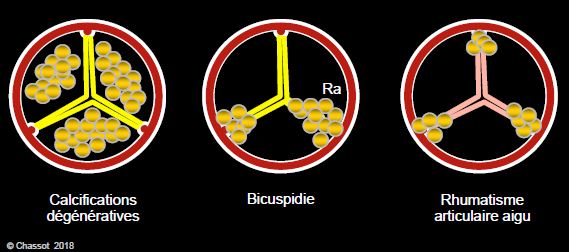
Figure 11.101 : Aspect anatomopathologique des calcifications dans la sténose aortique. Les calcifications sont situées dans le corps des cuspides lors de dégénérescence, sur le raphé (Ra) et aux commissures dans la bicuspidie, et aux 3 commissures dans le RAA.
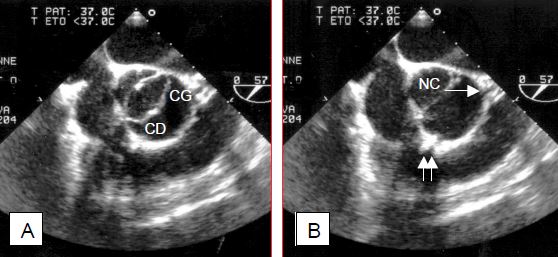
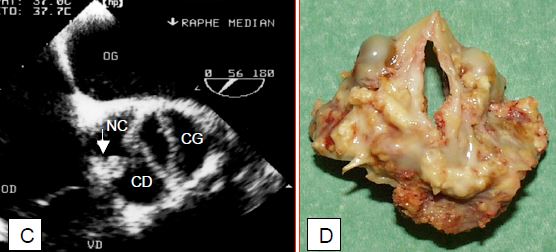
Figure 11.102 : Bicuspidie aortique. A: Image échocardiographique transoesophagienne en systole; l'ouverture de la valve est une ellipse; les feuillets coronariens droit (CD) et gauche (CG) sont fusionnés. B: image en diastole; on aperçoit le départ du tronc commun (→) et de la coronaire droite (↑↑); NC: feuillet non coronarien. C: la flèche indique la présence d'un raphé à l'emplacement de la fusion entre le feuillet coronarien droit et le feuillet non-coronarien; l'ouverture qui subsite est elliptique, en forme de banane (verticale sur l'image en court-axe de la valve). D: pièce opératoire du cas illustré en C.
En-dessous de 65 ans, la répartition des étiologies est habituellement: bicuspidie 50%, RAA 25% et dégénérescence 18%. Au-delà de 70 ans, cette répartition se modifie : dégénérescence 48%, bicuspidie 27%, RAA 23% [5]. La sténose sur bicuspidie devient cliniquement symptomatique environ 20 ans plus tôt que la sténose sur une valve tricuspide. Au sens anatomo-pathologique du terme, on distingue traditionnellement deux formes de bicuspidie (Figure 11.103).
- Bicuspidie "vraie" : il n’existe que 2 bourgeons embryonnaires de cuspides ; les deux feuillets de la valve sont de taille et de proportion variables, en général légèrement inégaux. La fente d’ouverture est ovale et son orientation est droite/gauche ou antérieure/postérieure (Vidéo).
Vidéo: Vue court-axe d'une bicuspidie "vraie" chez un jeune adulte; il n'existe que deux cuspides en position antéro-postérieure; l'ouverture systolique est incomplète.
Vidéo: Flux systolique à travers une valve aortique bicuspide; l'ouverture prend une allure ovale entre deux cuspides droite et gauche.
- Bicuspidie acquise : comme il existe primitivement 3 bourgeons dont deux fusionnent ultérieurement, on retrouve 3 commissures dans leur position normale, mais une cuspide est le double de la taille de l’autre ; elle présente en général un raphé fibreux en son milieu, qui marque la position de la commissure fusionnée. L’ouverture est en forme de banane. La bicuspidie acquise sur calcifications secondaires fait partie de cette catégorie (Vidéos).
Vidéo: Valve aortique bicuspide calcifiée et sténosée; l'ouverture est rétrécie; elle a lieu entre la cuspide non-coronaire et les cuspides coronariennes droite et gauche qui sont fusionnées (bicuspidie acquise). On voit clairement 3 commissures.
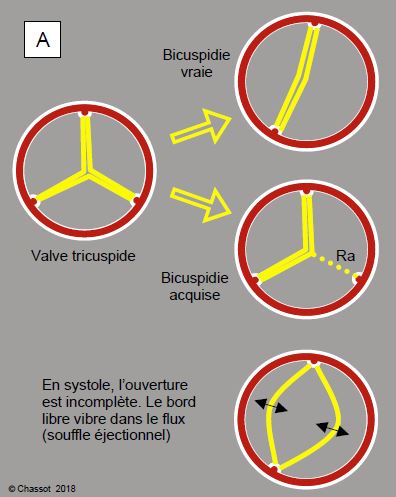
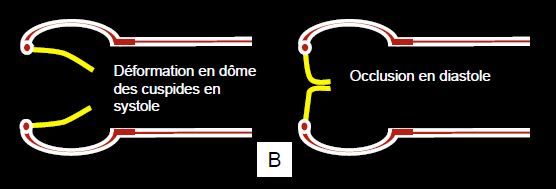
Figure 11.103 : Formes de bicuspidie. Dans la bicuspidie vraie, il n’existe embryologiquement que deux bourgeons de valvules et deux commissures ; la position de ces dernières est variable, de même que la taille respective de chaque cuspide. Dans la bicuspidie acquise, la valve a demarré dans l’embryon avec trois feuillets et trois commissures, positionnées à équidistance en triangle équilatéral ; secondairement, deux de ces feuillets ont fusionné, ne laissant qu’une trace de l’ancienne commissure sous la forme d’un raphé (Ra). Comme le diamètre d’un cercle est plus petit que la moitié de sa circonférence, les bords libres des cuspides ne peuvent pas être correctement alignés parallèlement au flux lorsque la valve est ouverte en systole ; ils opèrent une relative sténose et vibrent dans le flux, ce qui crée un souffle systolique sans relation avec une sténose car leur surface d’ouverture est encore normale. B : bicuspidie aortique ; configuration en dôme (doming) systolique des feuillets ; les bords libres ne peuvent pas être normalement positionnés par rapport à la paroi aortique.
Cette répartition est actuellement remplacée par une classification basée sur le nombre de raphés: aucun, un ou deux (voir Bicuspidie aortique) [14].
Bien qu'anatomiquement bien distinctes les unes des autres, les différentes étiologies de la sténose aortique sont souvent difficiles à différencier à un stade avancé de la maladie. Il n’est pas rare que les déformations anatomiques décrites empèchent la valve d’être étanche en diastole; une insuffisance aortique (IA) d’accompagnement est fréquente, mais hémodynamiquement peu significative (Vidéo).
Vidéo: Sténose aortique en vue long-axe; la sténose est serrée, le flux systolique est accéléré et étroit dans l'aorte ascendante; présence d'une petite insuffisance diastolique.
Parmi les cas congénitaux, on peut également rencontrer des valves unicuspides et des sténoses membranaires sus- ou sous-valvulaires. L’obstruction peut en effet se situer parfois en-dessous de la valve, dans la chambre de chasse du VG (CCVG). Cette sténose sous-aortique comprend deux catégories.
Vidéo: Sténose aortique en vue long-axe; la sténose est serrée, le flux systolique est accéléré et étroit dans l'aorte ascendante; présence d'une petite insuffisance diastolique.
Parmi les cas congénitaux, on peut également rencontrer des valves unicuspides et des sténoses membranaires sus- ou sous-valvulaires. L’obstruction peut en effet se situer parfois en-dessous de la valve, dans la chambre de chasse du VG (CCVG). Cette sténose sous-aortique comprend deux catégories.
- Sténose fixe : membrane fibro-musculaire sous-aortique qui obstrue partiellement la CCVG ; c’est une lésion congénitale qui s’accompagne d’une hypotrophie de la valve aortique (Figure 11.104) (Vidéo).
Vidéo: Sténose sous-aortique fixe sous forme d'un croissant fibreux dans la chambre de chasse, que l'on aperçoit sur le côté septal de la CCVG.
- Sténose musculaire dynamique : elle est occasionnée par une cardiomyopathie obstructive (CMO) ou par une hypertrophie concentrique dans une constellation particulière d’hypovolémie, d’excès inotrope et de basse postcharge (voir Sténose sous-aortique dynamique).
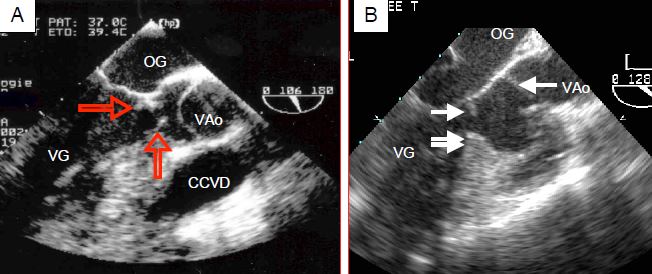
Figure 11.104 : Sténose sous-aortique congénitale. A: ne membrane circulaire (flèches) rétrécit la chambre de chasse en amont de la valve aortique ; elle est fixée au septum interventriculaire, au feuillet antérieur de la valve mitrale et à la paroi postérieure du VG. B: combinaison d'une membrane sous-aortique (flèche blanche) et d'un éperon septal musculaire (double flèche). La valve aortique (VAo) est souvent hypotrophique en aval de la sténose infundibulaire. CCVD : chambre de chasse droite.
La surface valvulaire aortique normale est de 2.5 – 4.0 cm2 (index: 2 cm2/m2). La sténose est quantifiée en trois degrés (Tableau 11.12) [2,9,15].
- Sténose mineure: Surface 1.5 cm2 ΔPmoy < 20 mmHg Vmax < 3 m/s
- Sténose modérée: Surface 1.0 - 1.5 cm2 ΔPmoy 20-40 mmHg Vmax 3 – 4 m/s
- Sténose sévère: Surface ≤ 1.0 cm2 ΔPmoy ≥ 40 mmHg Vmax ≥ 4 m/s
Sindexée ≤ 0.6 cm2/m2

Ces valeurs s’entendent pour une fonction normale du VG et un alignement correct de l’axe Doppler avec le flux systolique. Le débit ventriculaire gauche est généralement maintenu jusqu'à une obstruction critique déterminée par une surface valvulaire < 0.4 cm2/m2. En moyenne, la surface valvulaire aortique diminue de 0.05 - 0.1 cm2 par an, et le gradient moyen augmente de 7 mmHg par an [11]. La sténose sévère est définie par les critères suivants [2,9].
- Surface aortique ≤ 1.0 cm2 (≤ 0.6 cm2/m2);
- Gradient de pression (ΔP) moyen ≥ 40 mmHg (ΔPmax ≥ 100 mmHg);
- Vélocité du flux aortique ≥ 4.0 m/s;
- Rapport Vmax CCVG / Vmax VAo < 0.25;
- Intégrale des vélocités (ITV) > 100 cm;
- Hypertrophie concentrique du VG (épaisseur paroi postérieure en diastole > 1.2 cm), cavité du VG diminuée de taille;
- Fonction systolique conservée;
- Dysfonction diastolique avec agrandissement de l’OG.
Le gradient moyen diminue à < 30 mmHg lorsqu'une défaillance ventriculaire (FE < 0.50) abaisse le volume systolique, même si la surface valvulaire est inférieure à 1.0 cm2 (low flow/low gradient). Mais il se peut aussi que la faible éjection ventriculaire ne puisse pas ouvrir correctement une valve aortique simplement sclérosée, ce qui donne l’impression que l’ouverture est plus faible qu’elle ne l’est en réalité (pseudosténose). Un écho de stress à la dobutamine (2.5-10 mcg/kg/min) permet de différencier ces deux situations [2,9].
- Lors de sténose aortique serrée, le gradient de pression augmente sous dobutamine (élévation de > 20 mmHg) mais non la surface valvulaire qui reste fixe à cause des calcifications. Le rapport entre la vélocité dans la CCVG (ITVCCVG) et la vélocité à travers la valve aortique (ITVVAo) est < 0.25 dans la sténose aortique serrée (normal : > 0.8). Sous dobutamine, ce rapport se creuse encore dans la sténose serrée parce que l'ITVAo augmente davantage que l'TVCCVG.
- En cas de cardiomyopathie, au contraire, la surface valvulaire mesurée augmente parce que l’amélioration fonctionnelle du VG permet d’augmenter le volume systolique et d’ouvrir davantage la valve, mais le gradient ne se modifie pas [7,9]. En cas de cardiomyopathie et de sténose fonctionnelle, le rapport ITVCCVG/ITVVAo augmente parce que l’accélération est bien plus importante dans la CCVG qu’à travers la valve ; en effet, cette dernière augmente son ouverture et s’adapte à l’augmentation de volume systolique sans modifier son gradient [4].
Enfin, on peut rencontrer une situation paradoxale de bas gradient (ΔPmoy < 40 mmHg) et de sténose serrée bien que la fonction ventriculaire soit normale (FE > 50%) lorsque la cavité ventriculaire est particulièrement restrictive et le volume systolique < 35 mL/m2 [9]; mais des investigations plus fines comme la mesure du raccourcissement longitudinal du VG montrent en fait une dégradation de la fonction contractile [1]. Ces différentes inconsistances entre le gradient, la vélocité et la surface surviennent dans 30% des cas de sténose aortique serrée [8]. Dans ces cas difficiles, le CT-scan multi-barrettes permet de quantifier le degré de calcification de la valve aortique, dont l'importance est un élément pronostic important [2].
La morphologie globale du coeur est modifiée: le long axe du coeur s’horizontalise sur le diaphragme (morphologie "en sabot") et l’aorte ascendante, qui est sensiblement dilatée, est déroulée vers la droite. A l'ETO, elle sort du plan défini par le long-axe 120-140°.
| Sténose de la valve aortique |
|
Trois étiologies : dégénérescence calcifiée (la plus fréquente > 65 ans), bicuspidie (la moitié des cas < 60 ans), RAA (plus rare dans les pays industrialisés).
Définition des degrés de sténose (fonction VG conservée) :
- Sténose mineure surface 1.5 cm2 ΔPmoy < 20 mmHg
- Sténose modérée surface 1.0 – 1.5 cm2 ΔPmoy 20 – 40 mmHg
- Sténose serrée surface ≤ 1.0 cm2 (0.6 cm2/m2) ΔPmoy ≥ 40 mmHg
La sténose serrée est en outre caractérisée par :
- Vmax flux aortique ≥ 4 m/s
- Intégrale des vélocités aortique (ITVVAo) > 100 cm
- Rapport ITVCCVG / ITVVAo < 0.25
- HVG concentrique (fonction systolique conservée mais dyfonction diastolique)
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- ADDA J, MIELOT C, GIORGI R, et al. Low flow/low gradient severe aortic stenosis despite normal ejection fraction is associated with severe left ventricular dysfunction as assessed by speckle-tracking echocardiography: a multicenter study. Circ Cardiovasc Imaging 2012; 5:27-35
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- DARE AJ, VEINOT JP, EDWARDS WD, et al. New observations on the etiology of aortic valve disease. Hum Pathol 1993; 24:1330
- DEFILIPPI CR, WILLETT DL, BRICKNER ME, et al. Usefullness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol 1995; 75:191-4
- FOX CS, VASAN RS, PARISE H, et al. Mitral annular calcification predicts cardiovascular morbidity and mortality: the Framingham Heart Study. Circulation 2003; 107:1492-6
- IUNG B, BARON G, BUTCHART EG, et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on valvular heart disease. Eur Heart J 2003; 24:1231-43
- LASKEY WK, KUSSMAUL WG, NOORDEGRAAF A. Systemic arterial response to exercise in patients with aortic valve stenosis. Circulation 2009, 119:996-1004
- MINNERS J, ALLGEIER M, GOHLKE-BAERWOLF C, et al. Inconsistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010; 96:1463-8
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NKOMO VT, GARDIN JM, SKELTON TN, et al. Burden of valvular heart diseases: a population-based study. Lancet 2006; 368:1005-11
- OTTO CM, BURWASH IG, LEGGET ME, et al. Prospective study of asymptomatic valvular aortic stenosis: Clinical, echocardiographic and exercise predictors of outcome. Circulation 1997; 95:2262-70
- OTTO CM, LIND BK, KITZMAN DW, et al. Association of aortic-valve sclerosis with cardiovascular mortality and morbidity in the elderly. N Engl J Med 1999; 341:142-7
- PELETIER M, TROJETTE F, ENRIQUEZ-SARANO M, et al. Relation between cardiovascular risk factors and nonrheumatic severe calcific aortic stenosis among patients with a three-cuspid aortic valve. Am J Cardiol 2003; 91:97-105
- SIEVERS HH, SCHMIDTKE C. A classification system for the bicuspid aortic valve from 304 surgical specimens. J Thorac Cardiovasc Surg 2007; 133:1228-33
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
