Le clampage aortique au-delà de l'artère sous-clavière gauche a trois conséquences majeures qui commandent toute la prise en charge anesthésique (Figure 18.34) [15].
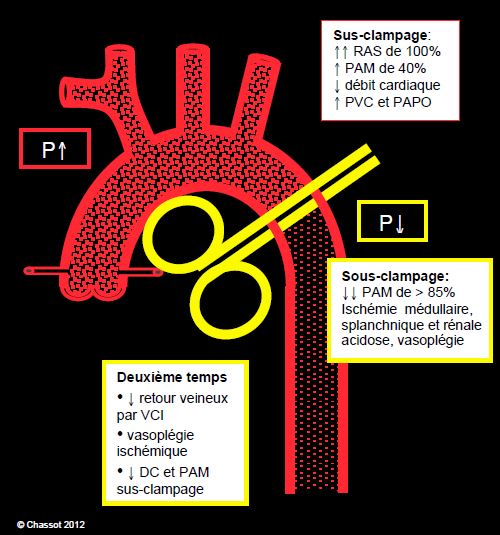
Figure 18.34 : Effets hémodynamiques du clampage de l'aorte thoracique descendante. RAS : résistances artérielles systémique. PAM : pression artérielle moyenne. PVC : pression veineuse centrale. PAPO : pression artérielle pulmonaire d’occlusion. VCI : veine cave inférieure. DC : débit cardiaque.
- En aval, un effondrement de la pression de perfusion et une absence de perfusion des organes:
- Ischémie médullaire;
- Ischémie splanchnique;
- Ischémie rénale;
- Acidose métabolique;
- Vasodilatation et ↑ perméabilité capillaire;
- Flux sanguin dépendant de la pression, pression résiduelle dépendant de la pression sus-clampage.
- En amont, une hypertension artérielle dans un lit vasculaire amputé des deux tiers de son volume; dans un premier temps:
- ↑↑ postcharge du VG (↑ RAS de 40-100%);
- ↑ PAM de > 40%;
- ↑ précharge (persistance du retour veineux par la VCI) et ↑ du débit cardiaque (effet Frank-Starling);
- ↑ contractilité du VG (effet Anrep);
- En amont, dans un deuxième temps face à la persistance de l'élévation de postcharge:
- ↓ de précharge (stase veineuse et "vol" dans le lit ischémie vasodilaté);
- ↓ contractilité du VG, éventuellement ischémie myocardique;
- ↓ débit cardiaque;
- ↓ ventilation / minute.
Effets hémodynamiques
Le système veineux n'étant pas interrompu par le clampage de l’aorte descendante, le flux sanguin se redistribue rapidement depuis les compartiments distaux et le lit splanchnique vers les compartiments supérieurs où le débit est conservé ; cette fuite a lieu par les vaisseaux de capacitance [7,9]. Après l'occlusion aortique, la veine cave sous-diaphragmatique continue à se vider dans l'OD jusqu'à ce que leurs pressions s'égalisent; si la fonction cardiaque est intacte, cette autotransfusion augmente les pressions de remplissage et le débit cardiaque au-dessus du clamp [1]. Suite à l'élévation de la postcharge et de la précharge, le VG normal augmente ses dimensions télédiastoliques et télésystoliques. L'élévation de la tension de paroi en diastole a un effet inotrope positif (effet Frank-Starling); la tension systolique créée par le clampage (↑ impédance) élève la contractilité (effet Anrep). En adaptation à cette nouvelle demande en O2, le flux coronaire augmente de 45% [6]. Par contre, la perte des deux tiers du lit vasculaire diminue la demande systémique en oxygène, et le débit cardiaque, de même que la ventilation-minute, diminue progressivement. Ces données sont modifiées selon le niveau du clampage, le degré de collatéralisation, le flux aortique, la fonction myocardique, ou l'utilisation de shunt. Le clampage de l'aorte descendante augmente de 100% les résistances artérielles mesurées dans les cas d'anévrysme, mais l'effet hémodynamique est plus faible en cas de lésions obstructives de l'aorte à cause du réseau collatéral qui s'est progressivement développé.
Mais ces phénomènes évoluent dans le temps. La chute de la perfusion dans la partie inférieure du corps en dessous du clamp aortique tarit le flux dans la veine cave inférieure après quelques minutes : le retour de volume au coeur droit diminue. Cette baisse de la précharge fait diminuer le débit cardiaque en amont du clamp. Par la suite, la vasoplégie et l'augmentation de la perméabilité capillaire dues à l'acidose métabolique des tissus ischémiés en dessous du clamp vont conduire au stockage de volume dans la partie inférieure du corps. En amont, l'hypertension augmente le gradient de pression à travers la membrane capillaire, conduisant à une exsudation interstitielle progressive; celle-ci occasionne une perte de volume circulant et une surélévation des résistances périphériques [10]; elle contribue à la baisse du débit cardiaque.
Ces adaptations sont conditionnées par l'état myocardique de base du malade. Si sa réserve fonctionnelle et sa compliance sont satisfaisantes, le coeur gauche assume les modifications opératoires sans ambages. S'il est défaillant ou ischémique, le VG dysfonctionne sans pouvoir améliorer ses performances systoliques, alors que l'accroissement de tension dans sa paroi élève ses besoins en O2. Dans ces conditions, la PAPO augmente de 5-10 mmHg, le débit cardiaque et la fraction d'éjection baissent et il apparaît une onde "v" qui signe la régurgitation mitrale pathognomonique de la défaillance ventriculaire. L'ischémie par demande excessive devient probable, d'autant plus qu'une coronaropathie est fréquemment associée à la maladie aortique. Dans la moitié des cas, le VG montre des signes d'insuffisance diastolique, systolique ou ischémique [14]. Un support inotrope est nécessaire, de même qu'un dérivé nitré. La régularisation de la postcharge du VG par du nitroprussiate est proscrite, car elle conduit malheureusement à approfondir l'hypotension d'aval de 30 à 50%, donc à y augmenter le risque ischémique, quand bien même le débit cardiaque augmente en amont du clamp [3,6]. En effet, le flux sanguin en-dessous du clamp devient pression-dépendant, et la pression résiduelle qui l'alimente dépend davantage de la pression au-dessus du clamp que du débit cardiaque. De ce fait, la pression proximale au clamp doit être maintenue aussi haut que toléré par le cœur de manière à assurer une pression résiduelle distale qui arrive encore à perfuser les organes [15].
L'ischémie d'aval libère des métabolites acides qui vont induire une myorelaxation vasculaire progressive et une accumulation de sang, particulièrement dans le lit mésentérique qui provoque un phénomène de "vol" [15]. Ceci contribue à affaiblir le retour veineux au coeur droit, et rend le flux pression-dépendant en dessous du clamp. Le métabolisme anaérobique secondaire à l'ischémie distale au clampage provoque une acidose lactique d'autant plus importante que le rein et le foie, principaux émonctoires du lactate, sont eux-mêmes exclus de la circulation. Certains auteurs recommandent une administration continue de bicarbonate sodique (0.05 mEq/kg/min) pendant le clampage [1]. Comme la consommation d'O2 globale baisse, il arrive que la saturation et le contenu en O2 du sang veineux central (cathéter de Swan-Ganz) soient augmentés, parce que la masse tissulaire perfusée est très diminuée et que des shunts artério-veineux s'ouvrent en amont du clampage [8].
Effets humoraux et organiques
Le clampage aortique provoque une libération de substances vasoactives, à commencer par les hormones de stress endogènes: adrénaline, noradrénaline et rénine-angiotensine [11]. L'augmentation du taux d'adrénaline est simultané au clampage, mais celui de noradrénaline est maximal après le déclampage. L'élévation de la rénine et de l'angiotensine dure au moins 6 heures après le rétablissement du flux. Les zones hypoxiées sont dans un profond bouleversement physiopathologique et relarguent un nombre considérable d'éléments toxiques, à la fois pendant l'ischémie et lors de la reperfusion.
- Acidose métabolique; la baisse de pH persiste sur une longue période après le déclampage.
- Radicaux libres (reactive oxygen species, ROS); associés à l'ischémie et surtout à la reperfusion, ils sont létaux pour la cellule. Leur production est favorisée par l'hyperoxie [16].
- Thromboxane et prostaglandine, vasoconstricteurs pulmonaires et agents inotropes négatifs.
- Endotoxines libérées à partir de la muqueuse digestive ischémiée.
- Cytokines (TNF, interleukine-6, etc), activateurs du complément C3a et C5a.
La signification clinique de ces différents médiateurs est difficile à apprécier, car leurs effets sont souvent opposés et dominés par les changements hémodynamiques majeurs [7]. Ces phénomènes sont d'autant plus prononcés que le clampage dure plus longtemps.
Tous les organes souffrent d'un clampage aortique, même ceux qui ne sont pas directment ischémiés [15].
- Poumons: les éléments inflammatoires s'accumulent dans le poumon et y provoquent une vasoconstriction artériolaire et une augmentation de perméabilité microvasculaire, conduisant à une hypertension pulmonaire et à un œdème interstitiel.
- Reins: le flux plasmatique rénale chute de 90% avec le clampage sus-rénal; le taux d'insuffisance rénale postopératoire est de 25-35% (10% en cas de clampage sous-rénal) [5]. Les reins semblent répondre à l'ischémie différemment des autres organes: après déclampage, le transport et l'extraction d'O2 corticaux restent abaissés [12].
- Intestins: une ischémie colo-rectale survient dans 3-5% des cas lorsque l'artère mésentérique inférieure et les iliaques internes sont sacrifiées.
Déclampage
Le déclampage effondre soudainement l'impédance aortique, le volume circulant et la pression artérielle pour plusieurs raisons [4,13,15].
- Reperfusion du lit distal vasodilaté par l'anoxie;
- Fuite transcapillaire interstitielle (↑ perméabilité due à l'anoxie);
- Baisse du retour veineux central (stockage de volume dans le lit reperfusé et vasodilaté);
- Mise en circulation des métabolites induisant:
- Acidose métabolique, lactacidémie;
- Vasodilatation systémique (adénosine, CO2);
- Vasoconstriction pulmonaire (hypercardbie, thrombexane, cytokines);
- Baisse de contractilité myocardique;
- Mise en circulation d'endotoxines bactériennes digestives;
- Hémorragie par les anastomoses;
- Hyperémie réactionnelle, maximale à 15 minutes.
L’efficacité des agents vasoconstricteurs est diminuée, car les vaisseaux situés en aval du clampage, qui restent maximalement vasodilatés à cause de l'acidose métabolique, sont peu réactifs et se contractent faiblement. Comme ce sont les vaisseaux normaux qui se contractent, les vasopresseurs occasionnent un phénomène de "vol" en direction des territoires déclampés et créent une hypovolémie en amont. Un déclampage très progressif est essentiel, parce qu’il donne le temps de remplacer le volume perdu, de ralentir la libération des substances acides, vaso-actives et cardio-dépressives, et de limiter les lésions de reperfusion (radicaux libres, superoxydes, etc) [2].
En résumé, le clampage aortique haut se traduit par une incidence importante de décompensation cardiaque gauche, d'ischémie médullaire (paraplégie), d'insuffisance rénale, d'ischémie digestive et d'acidose métabolique. Le déclampage est associé à une hypotension sévère.
| Chirurgie de l’aorte descendante |
|
Clampage de l’aorte descendante :
- En amont : hypertension artérielle (risque de défaillance du VG)
- En aval : ischémie (moelle, viscères, reins), acidose, vasoplégie
Hypotension au déclampage :
- Hémorragie chirurgicale
- Vasoplégie du lit ischémié, fuite capillaire, pooling et baisse du retour veineux
- Mise en circulation de métabolites acides et d’endotoxines digestives provoquant une vasoplégie systémique, une vasoconstriction pulmonaire
et une baisse de contractilité
Priorité : restreindre la durée de l’ischémie médullaire. Risque de paraplégie : 1-10% selon le niveau et la durée du clampage.
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- BANOUB M, KAGAN-KOEPKE T, SHENAQ S. Anesthesia for thoracic aortic surgery. In: ESTEFANOUS FG, ed. Cardiac anesthesia: Principles and clinical practice. Philadelphia: J.B.Lippincott Co, 1994, pp 545-95
- BOURCHIER RG, GLOVICZKI P, LARSON MV, et al. The mechanisms and prevention of intravascular fluid loss after occlusion of the supracoeliac aorta in dogs. J Vasc Surg 1991; 13:637-45
- CERNAIANU AC, OLAH A, CILLEY JH Jr, et al. Effect of sodium nitroprusside on paraplegia during cross-clamping of the thoracic aorta. Ann Thorac Surg 1993; 56:1035-7
- COHEN JR, SARDARDI F, PAUL J, et al. Increased intestinal permeability : implications for thoracoabdominal aneuvrysm repair. Ann Vasc Surg 1992; 6:433-9
- DUBOIS L, DURANT C, HARRINGTON DM, et al. Technical factors are strongest predictors of postoperative renal dysfunction after open transperitoneal juxtarenal abdominal aortic aneurysm repair. J Vasc Surg 2013; 57:648-54
- GELMAN S. Regional blood flow during cross-clamping of the thoracic aorta and infusion of sodium nitroprusside. J Thorac Cardiovasc Surg 1983; 85:287-91
- GELMAN S. The pathophysiology of aortic cross-clamping and unclamping. Anesthesiology 1995; 82:1026-60
- GELMAN S, GRANGER DN, FOWLER K, et al. Clearance of 9-mcm spheres and rubidium in the intestinal circulation. Am J Physiol 1984; 247:G13-G18
- GELMAN S, KHAZAELI MB, ORR R, et al. Blood volume redistribution during cross-clamping of the descending aorta. Anesth Analg 1994; 78:219-224
- HONG SAH, GELMAN S, HENDERSON T. Angiotensin and adrenoceptors in the hemodynamic response to aortic cross-clamping. Arch Surg 1992; 127:438-41
- ROYTBLATT L, GELMAN S, HENDERSON T, et al. Humoral factors and hemodynamics during cross-clamping of the thoracic aorta. J Cardiothorac Vasc Anesth 1991; 5:10-4
- SIEGEMUND M, VAN BOMMEL J, STEGENGA ME, et al. Aortic cross-clamping and reperfusion in pigs reduces microvascular oxygenation by altered systemic and regional blood flow distribution. Anesth Analg 2010; 111:345-53
- SIMPSON JI. Anesthesia for descending thoracic aortic surgery. In: SIMPSON JI. Anesthesia for aortic surgery. Boston: Butterworth-Heinemann, 1997, 175-98
- VAUGHN SB, LEMAIRE SA, COLLARD CD. Case scenario: anesthetic considerations for thoracoabdominal aortic aneurysm repair. Anesthesiology 2011; 115:1093-102
- ZAMMERT M, GELMAN S. The pathophysiology of aortic cross-clamping. Best Pract Res Clin Anaesthesiol 2016; 30:257-69
- ZOROV DB, JUHASZOVA M, SOLLOTT SJ. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release. Physiol Rev 2014; 94:909-50
