En cas d’insuffisance aortique, même minime, il est important de surveiller en continu la taille du VG en début de CEC. Dès que la bradycardie s'installe puis que le rythme spontané s'arrête, la cardioplégie introduite par la racine de l'aorte fuit par l'IA et dilate de ventricule qui n'éjecte plus. Il faut interrompre la cardioplégie dès que ce dernier commence à s'agrandir. A cet effet, on peut enregistrer une image de référence sur un demi-écran (split-screen) et observer en comparaison l’image en temps réel sur l’autre moitié (Vidéo et Figure 25.236).
Vidéo: vue 5-cavités en début de CEC; une petite insuffisance aortique permet à la cardioplégie de fuir dans le VG dès que ce dernier n'éjecte plus. Le ventricule se dilate; le contraste spontané indique un très bas débit dans les cavités gauches.
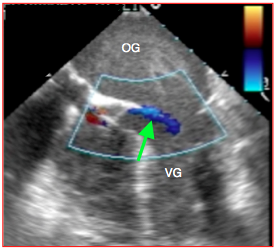
Figure 25.236 : Dilatation aiguë du VG avec la cardioplégie en cas d'insuffisance aortique. L'OG et le VG sont remplis par la solution de cardioplégie apparaissant comme du contraste spontané; la fuite continue par l'IA est visible au Doppler couleur (flèche verte).
Lors de canulation fémorale, on observe le flux rétrograde du liquide d’amorçage dans l’aorte descendante et on surveille régulièrement cette dernière à cause du risque de dissection. La position de la canule veineuse dans l’OD est observée en vue bi-cave 90-100°, notamment en raison du risque de passage dans l’OG en cas de FOP; le guide monté depuis la veine fémorale doit entrer dans la VCS pour s'y stabiliser, et la canule se situer au centre de l'OD (voir Figure 25.235). Lorsque le chirurgien procède à une canulation directe des coronaires, il est judicieux d’en vérifier l’anatomie à l’ETO : taille et longueur du tronc commun (distance de la bifurcation en IVA et CX), implantation séparée de la CX et de l’IVA, position de la coronaire droite (voir Figure 25.90).
L’absence de ventilation pulmonaire en CEC permet d’introduire dans la bronche souche droite un ballon rempli de NaCl monté sur un guide qui, en obstruant cette dernière, rétablit la visibilité de l’ETO sur la partie distale de l’aorte ascendante et proximale de la crosse [1]. On peut ainsi examiner ces structures qui tombent normalement dans la zone avengle de la voie transoesophagienne.
Avant la mise en charge, on recherche systématiquement plusieurs éléments [2].
Vidéo: vue 5-cavités en début de CEC; une petite insuffisance aortique permet à la cardioplégie de fuir dans le VG dès que ce dernier n'éjecte plus. Le ventricule se dilate; le contraste spontané indique un très bas débit dans les cavités gauches.

Figure 25.236 : Dilatation aiguë du VG avec la cardioplégie en cas d'insuffisance aortique. L'OG et le VG sont remplis par la solution de cardioplégie apparaissant comme du contraste spontané; la fuite continue par l'IA est visible au Doppler couleur (flèche verte).
Lors de canulation fémorale, on observe le flux rétrograde du liquide d’amorçage dans l’aorte descendante et on surveille régulièrement cette dernière à cause du risque de dissection. La position de la canule veineuse dans l’OD est observée en vue bi-cave 90-100°, notamment en raison du risque de passage dans l’OG en cas de FOP; le guide monté depuis la veine fémorale doit entrer dans la VCS pour s'y stabiliser, et la canule se situer au centre de l'OD (voir Figure 25.235). Lorsque le chirurgien procède à une canulation directe des coronaires, il est judicieux d’en vérifier l’anatomie à l’ETO : taille et longueur du tronc commun (distance de la bifurcation en IVA et CX), implantation séparée de la CX et de l’IVA, position de la coronaire droite (voir Figure 25.90).
L’absence de ventilation pulmonaire en CEC permet d’introduire dans la bronche souche droite un ballon rempli de NaCl monté sur un guide qui, en obstruant cette dernière, rétablit la visibilité de l’ETO sur la partie distale de l’aorte ascendante et proximale de la crosse [1]. On peut ainsi examiner ces structures qui tombent normalement dans la zone avengle de la voie transoesophagienne.
Avant la mise en charge, on recherche systématiquement plusieurs éléments [2].
- Présence de bulles d’air dans les cavités gauches, particulièrement en cas de cardiotomie. L’air provient en grande partie des veines pulmonaires, particulièrement des veines droites, car leur trajet depuis le hile pulmonaire fait une coudure supérieure ou l'air se bloque. L’air s’accumule dans les endroits les plus élevés des cavités gauches : veines pulmonaires, sommet du septum interauriculaire, angle mitro-aortique, sinus de Valsalva droit; en position de Trendelenburg, il se prend dans les trabéculations de la région septo-apicale (Figure 25.237). L’embolisation d’air est fréquente dans les vaisseaux issus de la face antérieure de l’aorte, comme la coronaire droite et les pontages veineux.
- Recherche d’éventuel thrombus intra- ou extra-cavitaire; malgré l'anticoagulation et la surveillance de l'ACT, les surfaces étrangères du circuit de CEC stimulent la cascade coagulatoire, ce qui peut donner naissance à des thrombus et causer des embolies systémiques catastrophiques dès la mise en charge (Figure 25.238).
- Recherche de lésion en rapport avec la canulation (dissection aortique, déchirure du sinus coronaire).
- Recherche d’épanchement pleural gauche (en avant de l’aorte descendante).
- En cas d’IA, le déclampage de l’aorte peut occasionner une dilatation aiguë du VG tant que le cœur n’a pas repris une activité électrique coordonnée et un rythme > 50 batt/min. Les fuites d'auto-lavage des prothèses mécaniques et les petites fuites des bioprothèses, bien que mineures, peuvent à elles seules dilater le VG avant que celui-ci reprenne une activité éjectionnelle.
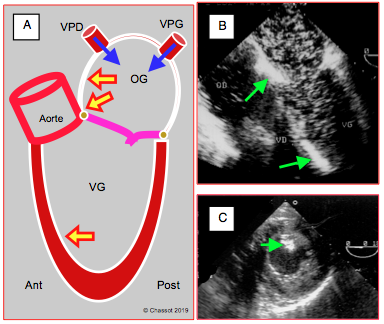
Figure 25.237 : Accumulation d’air dans le cœur gauche en fin de CEC. A : l’air provient de la cardiotomie gauche et des veines pulmonaires droite (VPD) et gauches (VPG) ; il s’accumule aux endroits les plus suré-levés : angle entre le septum interauriculaire et le toit de l’OG, angle mitro-aortique, septum interventriculaire antéro-apical en position de Trendelenburg. B : vue 4 cavités avec d’innonbrables bulles dans l’OG et le VG, ainsi que deux zones d’accumulation contre le septum inter-auriculaire et dans les trabéculations du septum interventriculaire. C : embolisation d’ait dans le muscle papillaire postérieur (territoire de la coronaire droite).
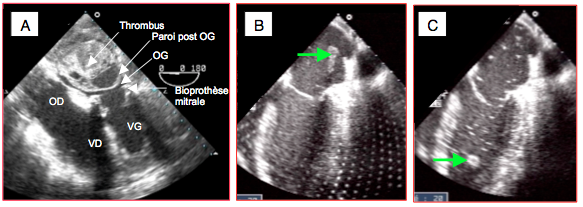
Figure 25.238 : Découvertes fortuites de thrombus en fin de CEC. A: thrombus et accumulation sanguine en arrière de l’OG, refoulant complètement la paroi de cette dernière après remplacement valvulaire mitral (prothèse biologique); l'image est prise avant la sortie de CEC. B: thrombus flottant dans l'OG avant la mise en charge après remplacement valvulaire aortique, au milieu de nombreuses petites bulles d'air. C: thrombus dans le VG; il s'agit du même cas que l'image précédante, le thrombus ayant migré dans le VG.
| ETO pendant la CEC |
| L'ETO remplit plusieurs fonctions pendant la CEC: - Guidage des canulations - Surveillance du VG en cas d'IA (cardioplégie) - Reprise d'activité musculaire à l'épuisement de la cardioplégie - Débullage en fin de CEC - Recherche de thrombus ou d'épanchement |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- LI YL, WONG DT, WEI W, LIU J. A new method for detecting the proximal aortic arch and innominate artery by transesophageal echocardiography. Anesthesiology 2006; 105:226-7
- WOUTERS PF, GUARRACINO F, SEEBERGER M. Perioperative echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 575-93
