Comme déjà mentionné plus haut, la maladie de Barlow est un ensemble assez vaste, allant d’un syndrome bénin à prédominance féminine caractérisé par des symptômes cardiaques vagues jusqu’à une maladie structurelle grave de la valve mitrale accompagnée d’une insuffisance majeure [3]. En Occident, la maladie de Barlow est très fréquente, puisqu’elle touche 1.7-2.4% de la population adulte [4]. Cependant, elle n’est accompagnée d’une IM significative que dans 10-15% des cas. Cette insuffisance se développe le plus souvent chez les hommes, et en général à partir de 50 ans; elle ne conduit à la réparation chirurgicale que 5% des malades [1,8]. Son incidence est plus élevée dans certaines affections comme le syndrome de Marfan, la maladie de von Willebrand, le pectus excavatum, ou la CIA ostium secundum [2].
La maladie de Barlow peut être à l’origine d’embolie artérielle due à des dépôts de fibrine, ou de troubles du rythme paroxystiques: FA, ESSV, tachyarythmie ventriculaire ou supraventriculaire, bloc AV. Le taux de mort subite est de 1% par an [3,9]. L’incidence d’endocardite n’est augmentée que s’il existe des lésions anatomiques graves de la valve, mais non si les feuillets sont seulement ballonnisés ou déplacés dans l’OG. L’antibiothérapie prophylactique n’est indiquée qu’en cas de lésions tissulaires sévères [6,7].
Les manifestations du syndrome sont protéiformes: fatigabilité, dyspnée, angoisse, pseudo-angor et palpitations. Lorsque l’insuffisance s’installe, les symptômes de l’IM dominent le tableau clinique. A l’auscultation, accentuée par les manoeuvres qui diminuent la précharge, on entend un clic mésosystolique à l'apex et un souffle télésystolique discret. Le clic est déclenché par la tension soudaine exercée sur les cordages lorsque le prolapsus bascule dans l'OG [2]. L’ECG n’est pas spécifique.
Le prolapsus de la maladie de Barlow est une insuffisance mitrale de type II (voir Figure 26.13). Le recul du point de coaptation dans l’oreillette est d’autant plus prononcé que le volume télésystolique (Vts) du ventricule est réduit, car la course des cordages s’allonge (voir Figure 11.70). Contrairement aux autres types d’IM, la régurgitation du prolapsus s’aggrave si la précharge baisse et si la contractilité augmente. L’effet de la postcharge est ambivalent: il est bénéfique dans la mesure où elle augmente le volume ventriculaire télésystolique, mais néfaste si elle est assez élevée pour augmenter la régurgitation. Classiquement, l’auscultation du Barlow augmente si le patient respire du nitrite d’amyle et se lève brusquement (Vts diminué). Toutefois, rappelons que le prolapsus arrivé au stade d'une rupture de cordage engendre une IM massive. Dans ce cas, le mécanisme du type II est débordé par les dimensions importantes de l’orifice de régurgitation. L’IM devient alors directement dépendante d’une augmentation de la pression systolique [5].
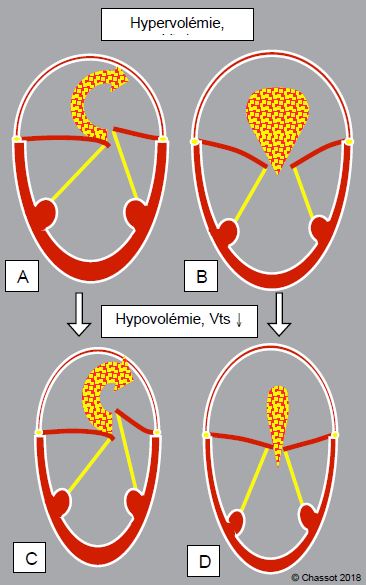
Figure 11.70 : Comportement différent de la régurgitation mitrale avec les variations de volémie selon le type d’IM. A et B: hypervolémie; le ventricule se dilate, son volume télésystolique (Vts) augmente; l'IM diminue dans le prolapsus (A) car les cordages sont tirés vers le bas, mais augmente dans les types I et III (B), car la restriction des feuillets mitraux s'accroît. C et D: hypovolémie; le ventricule se rappetisse, son volume télésystolique diminue; l'IM augmente dans le type II (C) car les cordages ont davantage de course, mais diminue dans les types I et III (D), car la restriction diminue et les feuillets arrivent presque à coapter.
Le traitement du syndrome de Barlow consiste essentiellement en β-bloqueur en cas d'arythmies et en aspirine (75-250 mg/j) en cas de symptômes neurologiques transitoires. L'anticoagulation est recommandée en cas d'AVC ou de thrombus auriculaire, ou s'il s'installe une FA [2].
Principes pour l’anesthésie
Les recommandations ci-après concernent exclusivement les malades souffrant de maladie de Barlow avec une IM de degré mineur ou modéré, et opérés pour une intervention de chirurgie non-cardiaque. Pour contrecarrer la régurgitation de la maldie de Barlow simple, il faut maintenir le ventricule relativement dilaté. Pour ce faire, on vise les points suivants.
- Précharge: elle doit être élevée pour maintenir les volumes télédiastolique et télésystolique agrandis: perfusions généreuses, PVC > 10 mmHg, PAPO > 12 mmHg.
- Postcharge: elle doit être maintenue normale, au moyen de vasoconstricteurs si nécessaire.
- Contractilité: elle doit être abaissée; on a recours à une anesthésie profonde, éventuellement à un β-bloqueur (esmolol) ; le traitement β-bloqueur en cours n’est pas interrompu.
- Fréquence: un ralentissement du rythme favorise le remplissage et dilate le ventricule; à contractilité égale, le volume télésystolique est plus grand.
En chirurgie cardiaque comme en chirurgie non-cardiaque, l’ETO est le seul moyen peropératoire efficace pour juger l’adéquation de la volémie, la fonction ventriculaire et l’évolution de la régurgitation chez les malades souffrant de Barlow. Le traitement pharmacologique (β-bloqueur, aspirine) est maintenu en périopératoire.
Technique d’anesthésie
- L’induction peut être réalisée au moyen de propofol, de midazolam ou de thiopental.
- Le midazolam abaisse le tonus sympathique ; il est adéquat mais de longue durée;
- Le propofol abaisse la précharge ; il faut compenser avec des perfusions;
- Le thiopental n’est indiqué que si la fonction ventriculaire est normale (FE ≥ 0.6);
- L’étomidate n’est recommandé que si la fonction ventriculaire est très diminuée.
- Pour le maintien de l’anesthésie, le sevoflurane ou le propofol sont bien adaptés ; l’halothane était l’agent idéal car il agit comme un β-bloqueur, mais il est retiré de la clinique dans la plupart des pays.
- Maintenir les résistances artérielles sytémiques (RAS) avec un vasoconstricteur, éviter toute hypotension artérielle (pas d’isoflurane).
- Maintenir le volume circulant (perfusions) et éviter toute baisse de précharge (prévenir l’hypovolémie).
- Freiner la contractilité (esmolol).
|
Hémodynamique recherchée en cas de maladie de Barlow
(IM type II mineure-à-modérée)
|
|
Volémie normale à élevée
Contractilité diminuée
Postcharge élevée
Fréquence lente
Plein – Mou – Fermé
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- AVIERINOS JF, INAMO J, GRIGIONI F, et al. Sex differences in morphology and outcomes of mitral valve prolapse. Ann Intern Med 2008; 149:787-95
- BONOW RO, CARABELLO B, CHATTERJEE K, et al. 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease. J Am Coll Cardiol 2008; 52:e1-e142
- BOUDOULAS H, KOLIBASH, AJ, BAKER P, et al. Mitral valve prolapse and the mitral valve prolapse syndrome: A diagnostic classification and pathogenesis of symptoms. Am Heart J 1989; 118:796-803
- FREED LA, LEVY D, LEVINE RA, et al. Prevalence and clinical outcome of mitral valve prolapse. N Engl J Med 1999; 341:1-7
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- NISHIMURA RA, CARABELLO BA, FAXON DP, et al. 2008 focused update incorporated into the ACC/AHA 2006 Guidelines for the management of patients with valvular disease. J Am Coll Cardiol 2008; 52:e1-e42
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- WILCKEN DEL, HICKEY AJ, Lifetime risk for patients with mitral valve prolapse of developping severe valve regurgitation requiring surgery. Circulation 1988; 78:10-8
- ZUPPIROLI A, RINALDI M, KRAMER-FOX R, et al. Natural history of mitral valve prolapse. Am J Cardiol 1995; 75:1028-32
