L’état clinique préopératoire est le premier facteur de risque de complications postopératoires en chirurgie de revascularisation coronarienne (PAC : pontage aorto-coronarien). Les nombreux indices de risque en usage (voir Chapitre 03, Facteurs de risque) démontrent une aggravation du pronostic avec différents éléments (par ordre de gravité décroissant) [8].
- Choc cardiogène ou dysfonction ventriculaire (FE < 0.35);
- Ischémie aiguë ou infarctus préopératoires, angor instable;
- Lésions du tronc commun ou de l’IVA proximale;
- Opération en urgence ou réopération;
- Comorbidités : insuffisance rénale, diabète;
- Maladie artérielle polyvasculaire;
- Age > 70 ans;
- Sexe féminin.
Conventionnellement, l'infarctus postopératoire après revascularisation chirurgicale (infarctus de type 5) est diagnostiqué sur la base des éléments suivants [14].
- Montée et descente typiques du taux de troponine (TnT-hs) avec un pic (> 10 fois la valeur du 99ème percentile) après l'acte chirurgical (en l'absence d'autre explication, telle une embolie pulmonaire), en combinaison avec l'un au moins des éléments suivants :
- Douleurs ischémiques (peu fréquentes).
- Apparition progressive d'onde Q pathologiques (≥ 30 ms dans 2 dérivations ECG contiguës).
- Modifications du segment ST (sus-décalage ≥ 1 mm, sous-décalage ≥ 1-2 mm) dans au moins 2 dérivations contiguës ; apparition d’un bloc de branche gauche.
- Inversion symétrique de l'onde T (> 1 mm).
- Nouvelles altérations de la cinétique segmentaire à l'échocardiographie (lésion impliquant > 20% de l'épaisseur de la paroi myocardique).
- Intervention sur les coronaires (pontage aorto-coronarien).
- Image coronarographique de thrombose de vaisseaux natifs, de stents ou de greffons.
- Infarctus aigu ou cicatrisé à la pathologie.
Le taux d’infarctus postopératoire après PAC varie de 0.1% à 14% selon les études, avec une moyenne de 2 et 4% [9,10], mais le mode de définition de l’infarctus postopératoire est un problème majeur : son incidence peut varier de 3-14% sur la base de l’ECG à 20-31% sur celle de l'IRM [4]. L'ECG est souvent difficile à interpréter dans le postopératoire immédiat et ses altérations sont fréquemment transitoires. Les akinésies segmentaires à l'échocardiographie peuvent être dues à une ischémie active sans infarcissement, à la sidération, à l'hibernation, à l'embolisation de particules athéromateuses ou à un problème de préservation myocardique avec la cardioplégie. Bien qu’elles ne permettent pas de faire la différence entre une ischémie et les dégâts de l’intervention chirurgicale elle-même, les troponines sont un indicateur assez spécifique d’infarctus en chirurgie cardiaque [1,3,13]. Mais une élévation isolée de ≤ 10 fois la LSR survient dans la majorité des patients qui subissent des pontages aorto-coronariens (PAC), notamment lorsqu'on teste les troponines à haute sensibilité (TnT-hs) [16]. Pour éviter une surestimation de l'infarctus, on a proposé de relever le taux de troponines à > 70 fois la LSR en valeur isolée et de > 35 fois la LSR lors d'association avec une onde Q sur l'ECG [7]. Si la valeur préopératoire était déjà anormale, une élévation de > 20% est considérée comme diagnostique, pour autant que la valeur soit > 10 fois la valeur du 99ème percentile [14]. Or la réalité clinique montre qu'il existe une relation graduelle entre le taux de troponine et la mortalité à 30 jours, indépendamment du diagnostic d'infarctus [2,12].
- Elevation de 1-2 fois la LSR mortalité: 0.8%;
- Elevation de 5-10 fois la LSR mortalité: 2.1%;
- Elevation de 10-20 fois la LSR mortalité: 2.8%;
- Elevation de 20-40 fois la LSR mortalité: 7.6%;
- Elévation de > 40 fois la LSR mortalité: 11%.
La retransfusion de sang médiastinal complique le diagnostic biologique de l’infarctus, car cette autotransfusion augmente artificiellement le taux des biomarqueurs habituels [15]. L'IRM est certainement un moyen diagnostique de premier plan, notamment par les images tardives au gadolinium (late gadolinium enhancement) qui mettent en évidence les zones dévitalisées avec une grande précision spatiale, mais elle n'est pas toujours disponible et impraticable dans la phase postopératoire précoce [12].
Contrairement à la chirurgie non-cardiaque, la présence d’épisodes d’ischémie peropératoire, notamment avant la CEC, est un facteur de risque d’infarctus postopératoire ; ces épisodes sont souvent associés à une tachycardie. La persistance d’anomalies de la contraction segmentaire (ACS) du VG après la CEC est un facteur de mauvais pronostic, directement lié l’incidence d’infarctus postopératoire. Dans une étude sur les revascularisations à cœur battant, 71% des complications cardiaques postopératoires se retrouvent chez les patients qui n'ont pas récupéré de leur ACS en peropératoire, mais aucune complication n'est enregistrée chez ceux qui ont une contractilité segmentaire normale en fin d'intervention [6].
La prise en charge est basée sur le soutien hémodynamique (rapport DO2/VO2 adéquat, levosimendan, contre-pulsion intra-aortique, assistance ventriculaire) et sur la revascularisation. L'incidence d'échec sur les greffons voisine 3-5%: 3-12% pour les greffons veineux, 3-4% pour l'artère radiale et 1-2% pour l'artère mammaire interne [12]. La clinique est variable: difficulté à sortir de pompe, instabilité hémodynamique, arythmies réfractaires ou choc cardiogène. Les taux de troponines sont particulièrement élevés lors d'occlusion de pontage: > 45 fois la LSR à 12 heures et > 70 fois la LSR à 24 heures, alors que l'ECG ou l'imagerie cardiologique sont peu spécifiques [11]. Dans 80% des cas, la coronarographie révèle une thrombose, une coudure, une sténose, un spasme artériel ou une revascularisation incomplète [5]. Comme une réintervention précoce limite l'étendue de l'infarcissement, il est recommandé de procéder rapidement à une coronarographie dès que la suspicion est fondée (Figure 9.9). La PCI avec pose de stent est efficace dans les lésions situées sur les artères natives et dans les greffons artériels, mais décevante dans les greffons veineux et sur les sites d'anastomose. La revascularisation chirurgicale est préférée lorsque l'anatomie ne se prête pas à une reconstruction endovasculaire ou lorsque le territoire incriminé est très important [17]. Pour éviter de nouvelles lésions d'ischémie-reperfusion lors de la CEC, il peut être préférable de procéder à un pontage à cœur battant avec le soutien hémodynamique de la machine cœur-poumon mais sans cardioplégie ni clampage aortique [12].
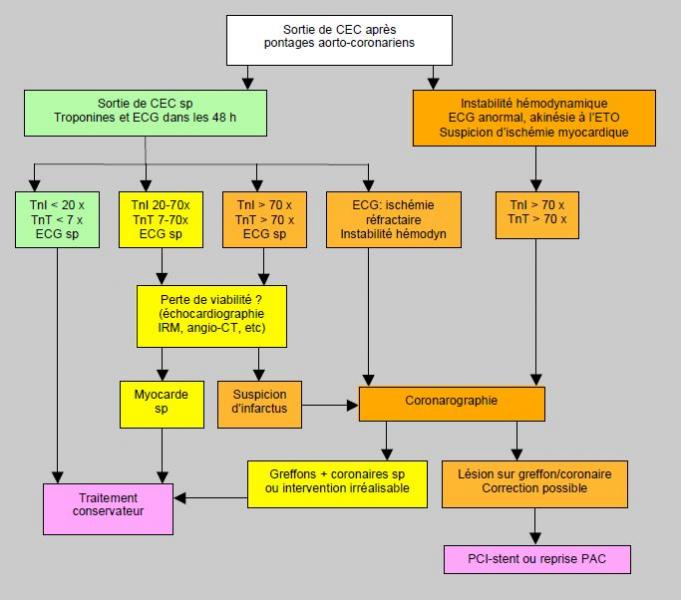
Figure 9.9: Algorithme de prise en charge d'un infarctus en cours après une revascularisation coronarienne chirurgicale en CEC. Le degré d'élévation des troponines (Tn) et les altérations électriques définissent la marche à suivre. Lorsque la suspicion d'infarctus est élevée, on procède en urgence à une coronarographie. PAC: pontage aorto-coronarien [12].
| Infarctus postopératoire en chirurgie cardiaque |
|
En chirurgie cardiaque, le taux d’infarctus postopératoire après PAC varie en moyenne de 2 à 4%. Les épisodes d'ischémie peropératoires et la persistence d'altérations de la cinétique segmentaire après revascularisation sont des marqueurs d'une augmentation du risque d'infarctus postopératoire. Le diagnostic est posé sur les modifications de l’ECG et l’élévation des troponines. Des altérations électriques pathognomoniques et une élévation des troponines à > 70 fois leur valeur de base commandent une coronarographie d'urgence.
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- CHAN MY, PRONOVOST PJ. Clinical utility of biomarkers in myocardial injury. Curr Opin Anesthesiol 2004; 17:49-55
- DOMANSKI MJ, MAHAFFEY K, HASSELBLAD V, et al. Association of myocardial enzyme elevation and survival following coronary artery bypass graft surgery. JAMA 2011; 305:585-91
- FELLAHI JL, GUEX X, RICHOMME X, et al. Short-and long-term prognostic value of ppostoperative cardiac troponin I concentration in patients undergoing coronary artery bypass grafting. Anesthesiology 2003; 99:270-4
- HUEB W, GERSCH BJ, ALVES DA COSTA LM, et al. Accuracy of myocardial biomarkers in the diagnosis of myocardial infarction after revascularization as assessed by cardiac resonance: the Medicine, Angioplasty, Surgery Study V (MASS-V) trial. Ann Thorac Surg 2016; 101:2202-8
- LAFLAMME M, DEMEY N, BOUCHARD D, et al. Management of early postoperative coronary artery bypass graft failure. Interact Cardiovasc Thorac Surg 2012; 14:452-6
- MOISES VA, MESQUITA CB, CAMPOS O, et al. Importance of intraoperative transesophageal echocardiography during coronary artery surgery without cardiopulmonary bypass. J Am Soc Echocardiogr 1998; 11:1139-44
- MOUSSA ID, KLEIN LW, SHAH B, et al. Consideration of a new definition of clinically relevant myocardial infarction after coronary revascularization: an expert consensus document from the Society for Cardiovascular Angiography and Interventions (SCAI). J Am Coll Cardiol 2013; 62:1563-70
- NASHEF SAM, ROQUES F, MICHEL P, et al. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 1999; 16:9-13
- NALYSNYK L, FAHRBACH K, REYNOLDS MW, ZHAO SZ, ROSS S. Adverse events in coronary artery bypass graft (CABG) trials: a systematic review and analysis. Heart 2003; 89:767-72
- STS – Society of Thoracic Surgeons National Cardiac Surgery Database, 2017. https://www.sts.org/site/defaut/files/documents/ ACSD_ExecutiveSummary2017Harvest4_RevisedReport.pdf
- THIELMANN M, MASSOUDY P, SCHMERMUND A, et al. Diagnostic discrimination between graft-related and non-graft-related perioperative myocardial infarction with cardiac troponin I after coronary artery bypass surgery. Eur Heart J 2005; 26:2440-7
- THIELMANN M, SHARMA V, AL-ATTAR N, et al. ESC Joint Working Groups on Cardiovascular Surgery and the Cellular Biology of the Heart Position Paper: peri-operative myocardial injury and infarction in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2017; 38:2392-411
- THYGESEN K, ALPERT JS, WHITE HD. Universal definition of myocardial infarction. J Am Coll Cardiol 2007; 50:2173-95
- THYGESEN K, ALPERT JS, JAFFE AS, et al. Fourth universal definition of myocardial infarction (2018). J Am Coll Cardiol 2018; 72:2231-64
- WAHL GW, FEINS RH, AQLFIERES G, et al. Reinfusion of shed blood after coronary operation causes elevation of cardiac enzyme levels. Ann Thorac Surg 1992; 53:625-31
- WANG TK, STEWART RA, RAMANATHAN T, et al. Diagnosis of MI after CABG with high-sensitivity troponin T and new ECG or echocardiogram changes: relationship with mortality and validation of the Universal Definition of MI. Eur Heart J Acute Cardiovasc Care 2013; 2:323-33
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
