Hormis le monitorage de base, la chirurgie de l'aorte ascendante présente certaines spécificités. Il est judicieux de disposer de deux cathéters artériels (Figure 18.25).
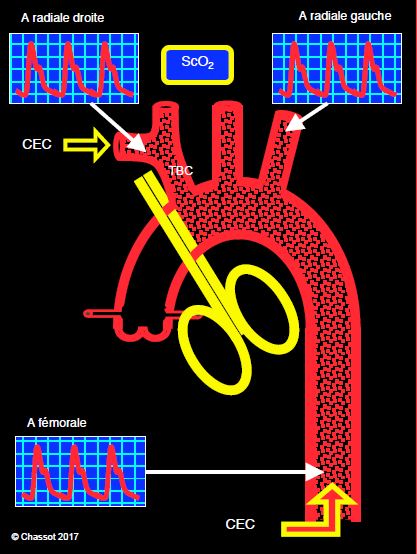
Figure 18.25 : Schéma de la chirurgie de l’aorte ascendante. Le clampage distal est plus ou moins proche du tronc brachio-céphalique (TBC). Un cathéter radial droit permet de contrôler le flux dans le TBC, donc dans la carotide droite. Mais lorsque la canulation de CEC est placée de préférence en sous-clavière droite (flèche jaune), la radiale droite est caduque. Dans ce cas, on monitorise la pression de perfusion cérébrale par un cathéter radial gauche. Un cathéter fémoral renseigne sur la perfusion viscérale. Si le clampage est à bonne distance du TBC (ce qui n’est pas le cas dans le schéma), la canulation de CEC peut se situer dans la partie distale de l’aorte ascendante de manière standard. La canulation de CEC peut aussi être réalisée dans une artère fémorale. L'inconvénient majeur de la canulation fémorale est une perfusion rétrograde de l'aorte.
- Cathéter placé dans l'artère fémorale de moins bon calibre, l’autre étant laissée à disposition pour la canulation artérielle de la CEC. L’extrémité de ce cathéter se trouve dans l’iliaque externe et y mesure la pression aortique sans subir l’amortissement dû à la vasoconstriction hypothermique, comme c’est le cas dans l’artère radiale. Alternative : 2 cathéters radiaux.
- Cathéter radial droit : l'étendue de la lésion aortique pouvant amener l'opérateur à positionner le clamp distal très proche du tronc brachio-céphalique et restreindre le flux dans la carotide droite, ce monitorage permettra la surveillance de la circulation cérébrale droite. Dans ces conditions, la manchette à pression et le saturomètre sont placés au bras gauche, de manière à surveiller les deux extrémités. Si l'opérateur canule l'artère sous-clavière droite par l'intermédiaire d'une prothèse tubulaire branchée par une anastomose termino-latérale, le cathéter radial droit est utile pour éviter le risque d'hyperperfusion du bras.
- Cathéter radial gauche en cas de canulation artérielle de CEC par la sous-clavière droite; dans ce cas, la manchette à pression et le saturomètre sont placés au bras droit. En cas de perfusion cérébrale sélective par le tronc brachio-céphalique, la radiale gauche monitore la pression de perfusion cérébrale effective.
Le risque hémorragique par les grandes prothèses étant élevé, il faut se munir de voies veineuses de gros calibre (voies périphériques 14G, introducteur de Swan-Ganz). Le cathéter artériel pulmonaire n'est plus utilisé de routine pour les interventions sur l'aorte ascendante. Il peut être remplacé par un moniteur de débit cardiaque de type PiCCO™. L'ETO peropératoire est capitale car elle a plusieurs fonctions (voir Chapitre 27 Aorte thoracique).
- Monitorage de la fonction ventriculaire, de la volémie et de l’ischémie myocardique (éventuelles altérations de la cinétique segmentaire dues à une hypoperfusion coronarienne). En cas d'hypotension réfractaire, l’ETO permet le diagnostic différentiel entre dysfonction ventriculaire, hypovolémie, ischémie coronarienne et tamponnade.
- Visualisation de l'étendue de la lésion en amont: déchirure ou désinsertion d'une valvule aortique, dilatation de l’anneau valvulaire, extension de la dissection dans un orifice coronarien (le plus souvent celui de la CD).
- L'ETO est nécessaire pour identifier et quantifier l'insuffisance aortique qui accompagne souvent l’anévrysme et la dissection; elle permet de déceler le mécanisme en cause.
- En cas de dissection aiguë, l’ETO peut mettre en évidence la déchirure primaire, estimer les orifices de sortie et évaluer l’extension du flap dans la descendante.
- Lors de canulation de CEC par voie fémorale, l'ETO permet de s'assurer que le guide artériel est bien dans la vraie lumière. La vraie lumière est caractérisée par une expansion en systole et un flux accéléré; la fausse lumière s'expand en diastole et affiche un flux de basse vélocité ou du contraste spontané; elle est en général plus grande que la vraie.
- Le chirurgien est intéressé par la mesure des diamètres de l'anneau aortique, des sinus de Valsalva, de la jonction sino-tubulaire et de l'aorte ascendante au niveau de son croisement avec l’artère pulmonaire droite (Figure 18.18).
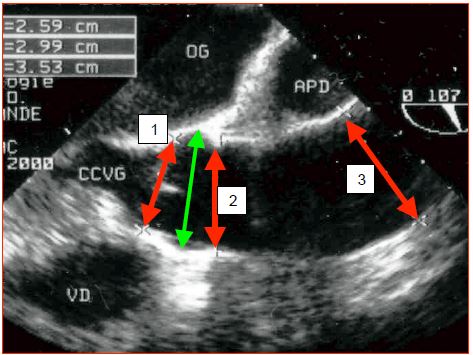
Figure 18.18 : Illustration échocardiographique transoesophagienne des différents diamètres de l'aorte ascendante. 1: anneau de la valve. 2: jonction sino-tubulaire. 3: aorte ascendante au niveau du croisement avec l'art pulmonaire droite (APD). Flèche verte : diamètre au niveau des sinus de Valsalva. CCVG: chambre de chasse du VG. APD: artère pulmonaire droite.
- L’interposition de la trachée et de la bifurcation des bronches-souches entre l’oesophage et l’aorte crée une zone aveugle à l’ETO depuis la moitié de l’aorte ascendante jusqu’après le tronc brachio-céphalique (les ultrasons ne pénètrent pas dans l’air). L’aorte ascendante distale depuis le croisement de l’artère pulmonaire droite et la crosse proximale sont donc invisibles à l’ETO. On peut contourner ce problème de deux manières.
- Echocardiographie épiaortique ; un capteur de type transthoracique est placé dans une housse stérile et manipulé dans le champ opératoire au contact de la face antérieure de l’aorte ascendante [3].
- Après l’intubation, on peut introduire dans la bronche souche gauche un cathéter sur lequel est monté un ballonnet rempli de NaCl qui rétablit la vision sur toute la longueur du vaisseau en assurant la transmission des ultrasons [4,5].
- En sortant de CEC, l’ETO offre la possibilité de contrôler la correction chirurgicale: évaluation de la plastie valvulaire aortique, flux résiduel dans la fausse lumière, diamètre du vaisseau.
Le monitorage est complété par la saturométrie cérébrale (ScO2) bilatérale par NIRS (near-infrared spectroscopy). Bien que la valeur de base du NIRS soit assez variable (60-70%), une désaturation < 55% ou une baisse de > 25% sont associées à des troubles neurologiques postopératoires dans plusieurs études [2]. Une chute de la ScO2 impose un diagnostic différentiel entre hypotension artérielle, désaturation artérielle, bas débit cardiaque, anémie aiguë, hypocapnie, convulsion, œdème cérébral ou hyperthermie cérébrale [1].
Mise à part la présence de deux cathéters artériels, la chirurgie de l'aorte ascendante ne se différencie pas fondamentalement d'une autre intervention majeure de chirurgie cardiaque. Toutefois, il arrive que le manchon d'aorte distale soit trop faible pour réaliser l'anastomose avec la prothèse et que la manœuvre doive se faire à clamp ouvert. Il faut alors réaliser un arrêt circulatoire total en hypothermie profonde (18-20°C) ou une perfusion cérébrale sélective (voir Hypothermie et Arrêt circulatoire).
| Monitorage pour l'aorte ascendante |
|
Monitorage :
- Cathéter artériel fémoral + radial droit/gauche selon canulation de CEC
- Cathéter pulmonaire de Swan-Ganz, éventuellement PiCCO™
- ETO
- Saturométrie cérébrale (ScO2)
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Décembre 2019
Références
- DENAULT A, DESCHAMPS A, MURKIN JM. A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy. Semin Cardiothorac Vasc Anesth 2007; 11:274-81
- GREGORY SH, YALAMURI SM, BISHAWI M, SWAMINATHAN M. The perioperative management of ascending aortic dissection. Anesth Analg 2018; 127:1302-13
- REEVES ST, GLAS KE, ELTZSCHIG H, et al. Guidelines for performing a comprehensive epicardial echocardiographic examination: Recommendations of the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2007; 20:427-37
- VAN ZAANE B, NIERICH AP, BUHRE WF, et al. Resolving the blind spot of transoesophageal echocardiography: a new diagnostic device for visualizing the ascending aorta in cardiac surgery. Br J Anaesth 2007; 98:434-41
- VAN ZAANE B, NIERICH AP, BRUINSMA GJBB, ET AL. Diagnostic accuracy of modified transoesophageal echocardiogrphy for pre-incision assessment of aortic atherosclerosis in cardiac surgery patients. Br J Anaesth 2010; 105:131-8
