Modifications cellulaires
Nos cellules ont une échéance appelée apoptose. L’apoptose consiste en une série d’évènements génétiquement programmés qui conduisent à un rétrécissement de la cellule, à une perte de ses activités, à une fragmentation du noyau et du DNA, et à une dégénérescence intracellulaire, mais avec un maintien de l’intégrité du sarcolemme et des mitochondries. Ce qui reste de la cellule est ensuite phagocyté par les voisines sans laisser de trace. Il n’y a ni fibrose ni cicatrice comme lors d’une nécrose [16]. La cellule vieillit également par accumulation de radicaux libres (ROS : reactive oxygen species) qui sont des peroxydes (O2-) produits par les mitochondries à cause de la perte d’électrons (e-) au cours de la chaîne d’oxydo-réduction ; normalement, ces ROS hautement toxiques sont immédiatement neutralisés par des enzymes (super-O--dismutases), car ils peuvent peroxyder le DNA et les phospholipides de la membrane, mais en vieillissant les mitochondries en produisent de plus en plus. Les ROS sont également générés par les radiations ionisantes, par des toxines et par divers polluants. Progressivement, leur accumulation dépasse les capacités des enzymes régulateurs, la mitochondrie dégénère, la cellule dysfonctionne, ne se régénère plus et meurt (Figure 21.1) [13,17].
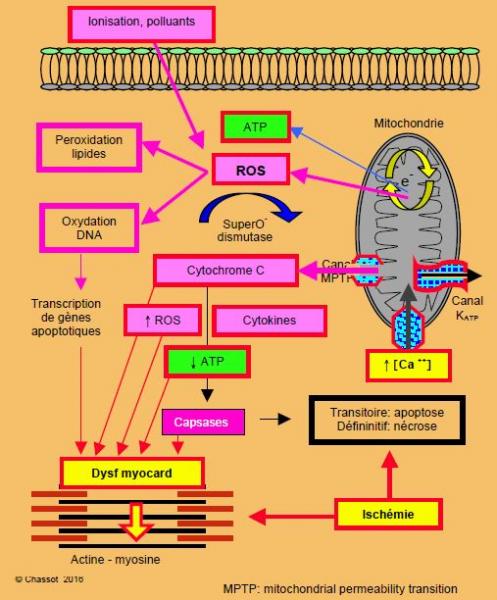
Figure 21.1 : Physiologie cellulaire du vieillissement. La cellule vieillit par accumulation de radicaux libres (ROS : reactive oxygen species) qui sont des peroxydes (O2-) produits par les mitochondries à cause de la perte d’électrons (e-) au cours de la chaîne d’oxydo-réduction ; normalement, ces ROS hautement toxiques sont immédiatement neutralisés par des enzymes (super-O--dismutases), car ils peuvent peroxyder le DNA et les phospholipides de la membrane. Les ROS sont également produits par les radiations ionisantes et par divers polluants. La mitochondrie libère aussi du cytochrome C qui interfère avec la fonction de l’ATP, active des cytokines et augmente le taux de ROS. Ces voies conduisent à la formation de capsases, enzymes susceptibles de digérer la cellule et ses organelles.
Cette disparition progressive des cellules remplacées par du collagène se traduit par une baisse du métabolisme global. A partir de 30-40 ans, la consommation d’O2 et le débit cardiaque diminuent graduellement de 1% par an, pour n’être plus que de 50% à 80 ans [13]. La plupart des organes perd environ 1% de sa capacité fonctionnelle par année à partir de 35 ans [9]. D'autre part, le turn-over des cellules myocardiques, qui est de 1%/an à 20 ans, diminue de plus de la moitié au-delà de 65 ans [28].
Modifications myocardiques
Le cœur n’échappe pas à cette règle. Avec l’âge, plusieurs modifications structurelles se développent dans la paroi ventriculaire [17,21,26].
- Le myocarde adulte contient environ 60% de myocytes et 40% de fibrocytes ; à 75 ans, la proportion s’est inversée : il n’y a plus que 40% de myocytes, 60% de la masse myocardique étant constituée de fibrocytes.
- Pour maintenir la performance contractile, les myocytes restants s’hypertrophient.
- Outre les fibrocytes, les fibroblastes produisent également du collagène, qui induit une fibrose interstitielle ; le myocarde devient moins compliant et plus rigide.
- L’élévation de la postcharge gauche due à la rigidité des grandes artères et à l’hypertension artérielle conduit à une hypertrophie concentrique qui accentue encore la rigidité myocardique.
La fonction systolique apparente est préservée et la fraction d’éjection conservée (FE 0.6), bien que la prévalence de l'insuffisance cardiaque soit de 10-15% au-delà de 80 ans [17,20], mais une évaluation plus fine met en évidence plusieurs phénomènes [28].
- Dysfonction diastolique sur défaut de relaxation et perte de compliance, accompagnée d’une augmentation des pressions de remplissage (voir Chapitre 5 Dysfonction et insuffisance diastolique). Elle est caractéristique de la fibrose progressive et de l'hypertrophie ventriculaire concentrique du VG; elle se manifeste par une dilatation de l'OG.
- Dépendance accrue de la précharge pour maintenir le volume systolique (redressement de la courbe de Starling (voir Figure 21.2 ci-dessous).
- Diminution de la puissance systolique: ralentissement de l’éjection à ≥ 300 ms, baisse de force par unité de masse, diminution de la déformation myocardique systolique (strain), bien qu'une mesure grossière comme la fraction d'éjection puisse rester normale.
- Limitation du débit cardiaque: le DC chute de 1%/an au-delà de 40 ans par baisse de la demande métabolique; le DC maximal baisse parce que la réserve fonctionnelle diminue.
- Augmentation de l’incidence de tachyarythmies (20%) et de fibrillation auriculaire (10%) [21].
- Valvulopathies (10% des patients > 75 ans): sténose aortique, insuffisance mitrale, insuffisance tricuspidienne.
Le cœur vieillissant présente encore d’autres altérations physiologiques par rapport à celui d’un jeune adulte [21,27].
- Désensibilisation des récepteurs β-adrénergiques ; l’âge entraîne une augmentation du tonus sympathique de base et de la sécrétion de nor-adrénaline [13], ce qui conduit à une régulation à la baisse des récepteurs β. Cette désensibilisation explique la fréquence cardiaque de base plus basse et la faible réponse inotrope et chronotrope en cas de stress sympathique ou de perfusion de catécholamines à effet β1 et/ou β2 [12,30].
- Augmentation de la densité des récepteurs α1 ; l’adrénaline est plus efficace que la dobutamine ou la dopamine [24].
- Abaissement de la fréquence cardiaque (FC) moyenne ; sa valeur maximale est donnée par la formule : 220 – âge pour les hommes et 200 – âge pour les femmes. La FC est relativement fixe et la variabilité fractale du rythme cardiaque est perdue [27].
- Augmentation de l'activité sympathique de base.
- Diminution de la réponse tachycardisante à l’hypovolémie, à l’hypotension, à l’effort et à la stimulation sympathique.
- Diminution du recrutement de contractilité à l’effort et à la stimulation sympathique.
- Augmentation du volume télédiastolique ; élever le Vtd et la Ptd devient le moyen prépondérant pour augmenter le débit cardiaque (effet Frank-Starling) lorsque l’accélération de la FC est insuffisante [12].
- Perte de l’efficacité des baroréflexes ; l’arc sympathique est conservé, mais l’arc parasympathique est affaibli [5] ; bien qu’hypertendus, les malades souffrent d’hypotension orthostatique.
- Augmentation de la pression artérielle pulmonaire; la PAPm s'élève de 1 mmHg par décennie.
- Diminution de la réserve coronarienne par baisse de la production endothéliale de NO• et augmentation de l’effet vasoconstricteur de l’endothéline [2].
- Dépôts amyloïdes; ils sont présents chez 25% des malades de > 80 ans [15].
- Après un infarctus, les fibroblastes âgés sont incapables de produire une cicatrice solide, d’où un risque accru d’anévrysme, de défaillance et de rupture [26].
La courbe de Frank-Starling d’un vieillard est redressée et déplacée vers les hautes pressions télédiastoliques à cause de la dysfonction diastolique : de faibles variations de remplissage se traduisent par de fortes variations du volume systolique (Figure 21.2).
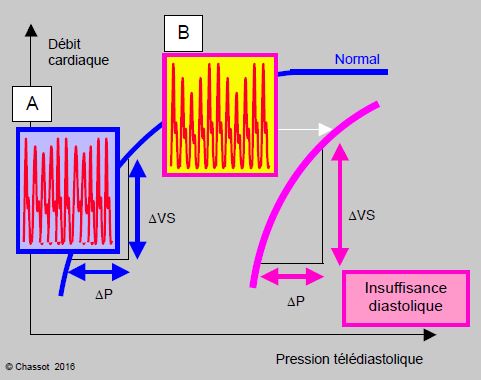
Figure 21.2 : Courbe de Starling de l’insuffisance diastolique (en violet) comparée à la courbe normale (en bleu). La pente de recrutement est très raide, le genou conduisant au plateau a disparu. La variation de volume systolique correspondant à la même variation de pression de remplissage est plus grande en cas d’insuffisance diastolique. Ceci se traduit pas une plus grande dépendance de la précharge et par une accentuation des variations ventilatoires de la pression artérielle (B) par rapport à la normale (A).
Cliniquement, ce phénomène est responsable d’une étroite dépendance du débit cardiaque par rapport à la précharge et de fortes oscillations du volume systolique, donc de la pression artérielle, avec les modifications de pression endothoracique dues à la ventilation mécanique (IPPV). Ajoutée à la faible accélération de la FC lors de stimulation sympathique, la dysfonction diastolique rend ces patients très peu tolérants aux variations de volume ; l’hypovolémie n’est plus compensée et se traduit par une baisse immédiate du volume systolique et du débit cardiaque. Ceci n’a pas de traduction clinique au repos, mais limite la capacité à répondre au stress, car une augmentation de débit cardiaque s’accompagne d’une augmentation disproportionnée de la pression télédiastolique ; d’où stase en amont et dyspnée par excès liquidien interstitiel pulmonaire. Le pic de pression télédiastolique à l’effort est 30% plus élevé chez la personne âgée que chez le jeune [6]. Cette haute pression diastolique peut contribuer à une ischémie sous-endocardique si le flux coronarien y est déjà compromis.
La dysfonction diastolique modifie également la courbe de compliance, qui est déplacée vers le haut et dont la pente est accentuée. Cette modification due à l’excès de fibrocytes et de collagène est accentuée par l’hypertrophie ventriculaire concentrique (HVG) caractéristique de l’augmentation de postcharge liée à la rigidité artérielle de l’âge (augmentation de l’impédance) et à l’hypertension systémique (augmentation des RAS) (Figure 21.3).
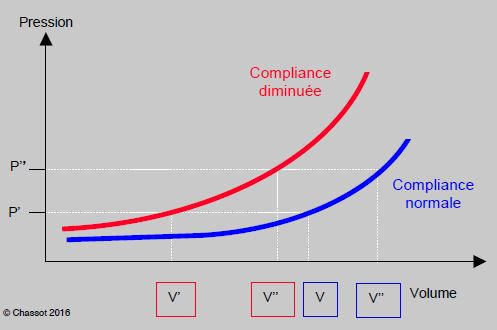
Figure 21.3 : Représentation schématique de la courbe de compliance normale du VG (en bleu) et lors de dysfonction diastolique (en rouge). La courbe est curvilinéaire. A faible remplissage, la courbe a très peu de pente : une variation de volume se traduit par une minime variation de pression. De ce fait, la pression veineuse centrale (PVC) ou la pression artérielle pulmonaire d’occlusion (PAPO) sont de médiocres critères de remplissage en hypovolémie. En hypervolémie, au contraire, la relation entre la pression et le volume devient fiable (partie droite de la courbe). La courbe lors d’insuffisance diastolique (compliance diminuée) se redresse et se déplace vers le haut et vers la gauche. La même variation de volume se traduit par une variation de pression plus importante que lorsque la compliance est normale. A la pression P correspond un volume ventriculaire plus petit (V’) que la norme (V) ; le sujet peut être hypovolémique avec une POD (PVC) ou une POG (PAPO) normale. La normovolémie d’un sujet souffrant de dysfonction diastolique (V’’ rouge) est une pression de remplissage (P’) qui correspond à une hypervolémie (V’’ bleu) chez un sujet normal.
La prévalence de la dysfonction diastolique est de 60% au-delà de 75 ans ; celle de l’insuffisance diastolique, qui est une défaillance ventriculaire congestive à fonction systolique préservée, n’est que de 10% [20]. La traduction clinique de la dysfonction diastolique est une élévation chronique de la PVC et de la PAPO pour le même volume auriculaire, ce qui engendre une stase en amont, une dilatation de l’OG et une augmentation de la pression liquidienne interstitielle pulmonaire. D’autre part, une PVC et une PAPO considérées comme normales chez l’adulte correspondent à une hypovolémie chez le vieillard. Ce défaut diastolique implique une durée assez longue pour permettre le remplissage du ventricule : le volume systolique baisse lorsque la fréquence est élevée. Il implique également une intolérance à la bradycardie, parce que le ventricule n’est plus assez souple pour compenser la baisse de fréquence par une augmentation adaptative du volume télédiastolique.
Le défaut de relaxation ventriculaire en protodiastole est bien visible sur la silhouette du flux mitral (Figure 21.4).
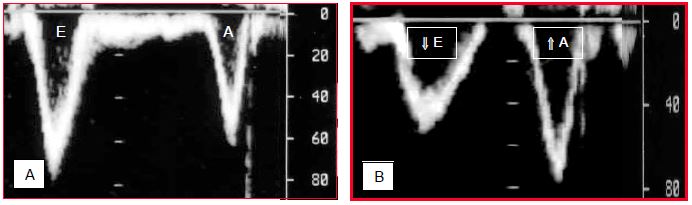
Figure 21.4 : Flux mitral enregistré à l’échocardiographie transoesophagienne. A : flux normal; le flux protodiastolique (E) fournit le 80% du remplissage ventriculaire et la contraction auriculaire (A) le 20%. B : chez la personne âgée, la composante E diminue de vélocité et ne représente plus que la moitié du remplissage ; le flux auriculaire augmente et apporte l’autre moitié du Vtd.
Normalement, le flux protodiastolique (composante E) fournit 80% du remplissage ventriculaire, la contraction auriculaire (composante A) ne contribuant que pour 20% au volume télédiastolique (son but est d’augmenter la Ptd et non le Vtd). Chez la personne âgée, la composante E diminue de vélocité et ne représente plus que la moitié du remplissage ; dans ces conditions, la contraction auriculaire apporte l’autre moitié du Vtd [11]. La conséquence est une étroite dépendance du rythme sinusal ; lorsque ces malades passent en rythme nodal ou en FA, leur volume systolique diminue soudainement de moitié. Par ailleurs, la prévalence de la FA est de 10% au-delà de 80 ans [27].
L’impact clinique de ces multiples modifications dues à l’âge est complexe, mais il peut se résumer par les points suivants (Tableau 21.1).
- Dépendance accrue du volume systolique à la précharge et intolérance à l’hypovolémie (chute importante de la pression artérielle et du DC à l’induction et à l’IPPV) ;
- Faibles modifications de la FC lors des variations de volume ou de stimulation sympathique ;
- Dépendance de la systole auriculaire ;
- Intolérance à la tachycardie ;
- Intolérance à la bradycardie ;
- Dyspnée d’effort.
A ces altérations myocardiques s’ajoutent des affections structurelles du cœur. L’usure des zones de stress maximal se traduit par leur fibrose et leur calcification progressives. Ainsi les valves ont tendance à devenir rigides et peu étanches. A cela s’ajoute la dégénérescence myxoïde propre à la valve mitrale. Ainsi, un tiers des personnes âgées présente une insuffisance mitrale et un quart une sténose aortique. Ces affections sont modérées et bénignes ; elles sont sans traduction clinique dans la vie quotidienne, mais peuvent avoir une incidence fonctionnelle dans les situations de stress comme une intervention chirurgicale.
Modifications vasculaires
Les artères vieillissent elles aussi. Plusieurs phénomènes apparaissent avec la sénescence de l’arbre vasculaire ; ils conduisent à une rigidification progressive de ses parois [3,4,10,23].
- Epaississement de l’intima et de la média.
- Dysfonction endothéliale avec frein à la synthèse du NO• et élévation de la production de ROS.
- Glycosylation non-enzymatique (réaction du glucose avec des protéines, des lipides et des acides nucléaires) conduisant progressivement à des amas moléculaires entrelacés et rigides.
- Calcification dans l’intima et de la média ; le calcium envahit de nombreux tissus alors que les os se décalcifient : c’est le paradoxe du calcium.
- Modification du rapport entre le collagène et l’élastine au détriment de cette dernière, qui tend à se fragmenter ; la prolifération du collagène diminue l’élasticité des grandes artères.
- Accumulation de fibroblastes dans l’externa et remplacement progressif des myocytes par des fibrocytes avec fibrose de toute la paroi.
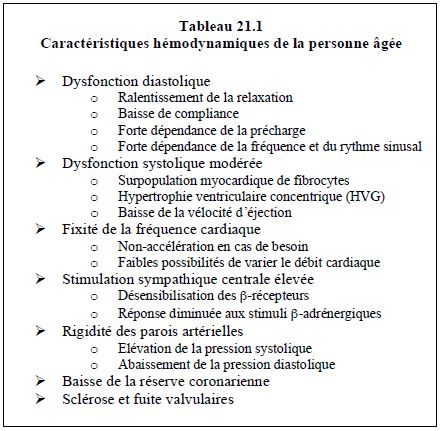
Ces lésions d’artériosclérose (rigidification diffuse de toutes les artères) sont distinctes de celles de l’athéromatose, qui consiste en dépôts lipidiques localisés, secondairement calcifiés ou non. L’hypertension artérielle de la vieillesse est due pour 75% à la rigidité des grandes artères et pour 25% à l’augmentation des résistances artériolaires (RAS). L’aorte et les grandes artères perdent leur élasticité et leur capacité à amortir la différence de pression entre la systole et la diastole [3]. Normalement, elles tamponnent la pulsatilité et diminuent la pression artérielle systolique (PAs) par dilatation et stockage d’énergie en systole ; en diastole, elles restituent le volume et l’énergie sous forme d’un flux diastolique antérograde (Figure 21.5).
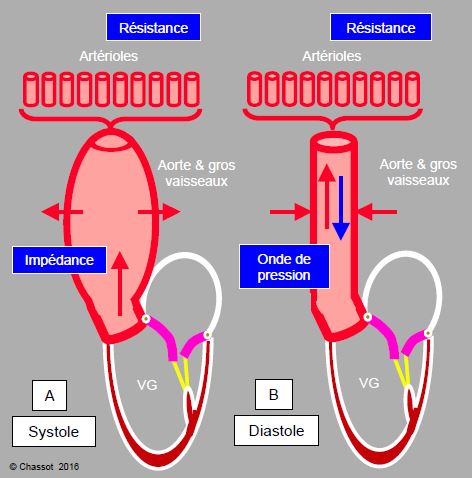
Figure 21.5 : Amortissement de la pression par l’élasticité des grandes artères. A : En systole, l’élasticité emmagasine de l’énergie en se dilatant. L’impédance se définit comme le rapport entre la pression instantanée et le flux à cet instant (temps t) (Pt / Ft) ; elle varie au cours de la systole. Chez la personne âgée, elle est très élevée. B : En diastole, cette énergie est restituée sous forme d’une augmentation de la pression et du flux diastolique. La résistance a lieu dans les artérioles et les capillaires. Elle est définie par la loi d’Ohm, mais ne s’applique qu’à un flux continu non-pulsé. Chez la personne âgée, elle varie normalement selon la stimulation sympathique vasoconstrictrice alpha. Flèche bleue: onde de pression rétrograde.
Le rôle des grandes artères est ainsi d’amortir la pulsatilité engendrée par la systole ventriculaire et de délivrer un flux quasi dépulsé dans les capillaires, sauf aux niveaux cérébral, coronaire et rénal. Avec l’âge, la perte de cette élasticité fait que la pression systolique s’élève parce qu'elle n'est plus amortie, alors que la diastolique (PAd) s’abaisse parce que la restitution du volume emmagasiné en systole n'existe plus. La pression différentielle (PAs – PAd), ou pression pulsée, augmente comme chez l’hypertendu (voir Chapitre 5, Couplage ventriculo-artériel).
La rigidité des artères augmente également l’intensité et la rapidité de l’onde de pression, et l’augmentation des résistances périphériques (0.5%/an) accroît sa réflexion en périphérie [23]. La pression systolique s’en trouve accrue d’autant [14,18]. En effet, la contraction du VG provoque une onde de pression qui se propage rapidement dans les parois vasculaires (4-5 m/s), alors que le flux sanguin n’avance qu’à 0.6-1 m/s. Cette onde de pression est réfléchie en périphérie au niveau des artérioles, là où les RAS augmentent brusquement, et revient en direction du cœur, qu’elle atteint en protodiastole chez l’adulte jeune (Figure 21.6) [4].
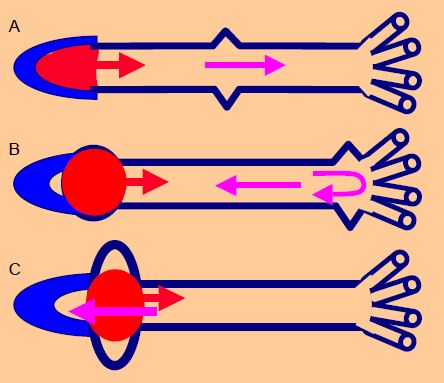
Figure 21.6 : Schéma du cheminement des ondes de flux et des ondes de pression. A: contraction ventriculaire en protosystole: l’énergie est répartie en une onde oscillatoire de pression (flèche violette), dont la propagation est fonction de la rigidité des parois vasculaires, et en une onde de flux (flèche rouge), qui propulse le volume sanguin systolique effectif. B: avancement à des vitesses différentes de la masse sanguine et de l’onde de pression qui se réfléchit en périphérie. C: superposition de l'onde de flux et du retour de l'onde de pression, qui provoque un pic de pression. Cette onde oscillatoire de pression représente 10% de la postcharge du VG, et 25-30% de la postcharge du VD [14,18].
L’âge induit deux modifications majeures de ce mécanisme.
- La propagation de l’onde de pression est plus rapide (10 m/s) lorsque les parois sont rigides et la pression artérielle élevée ;
- L’intensité de la réflexion en périphérie est augmentée lorsque les RAS sont élevées.
Le résultat est un retour plus rapide et plus intense de cette onde : elle se superpose au pic de pression systolique et élève la postcharge du VG au lieu d’augmenter la pression diastolique. La composante systolique de la courbe de pression apparaît bifide sur l’écran du moniteur (Figure 21.7).
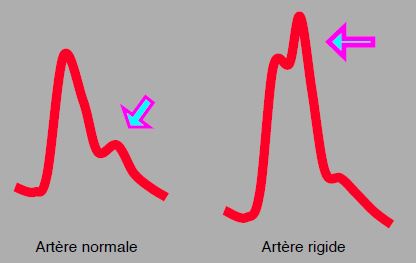
Figure 21.7 : Comparaison d’une artère normale et d’une artère rigidifiée par une athéromatose diffuse (artère fémorale). L’effet du retour de l’onde de pression (onde réfléchie, marquée par la flèche violette) survient plus tôt dans le deuxième cas et donne un crochetage sur le pic systolique. Bien qu’enregistré comme la pression systolique par le moniteur, cet effet ne correspond pas à une pression de perfusion réelle mais à un simple pic de pression intra-artériel.
Le moniteur donne comme valeur systolique la pression artérielle maximale, mais celle-ci ne correspond pas à la pression de perfusion des organes. Cette dernière est liée à la pression engendrée par le volume systolique et le flux sanguin; elle est représentée par le premier crochetage systolique (ou le plus bas des deux pics). Si l’on compare la courbe artérielle d’une personne âgée à celle d’un individu normal, on voit que le VG du premier est doublement pénalisé : sa postcharge augmente, alors que sa pression de perfusion coronarienne diminue (Figure 21.8) [19,25].
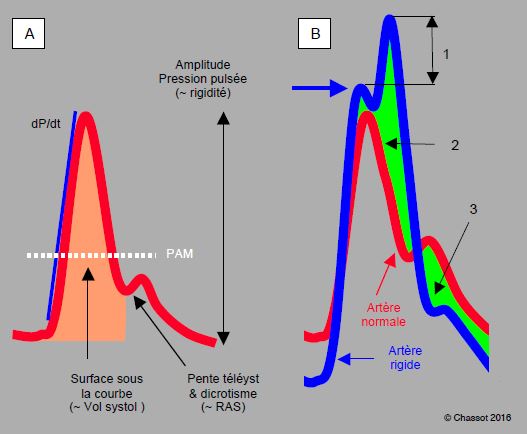
Figure 21.8 : Aspect analogique de la courbe artérielle. A : courbe normale. La pente ascensionnelle est fonction du dP/dt intraventriculaire (pour autant qu’il n’y ait pas de pathologie valvulaire aortique). La surface sous la courbe systolique est proportionnelle au volume systolique, la pente télésystolique et le niveau du dicrotisme sont fonction des résistances artérielles périphériques (RAS), l’amplitude est fonction de la rigidité des parois mais aussi de la volémie et des RAS. La pression artérielle moyenne (PAM) est calculée selon la formule : PAM = (PAsyst + 2 PAdiast) / 3. B : comparaison d’une courbe artérielle normale (en rouge) et de la courbe d’un patient souffrant d’athéromatose (en bleu), dont l’aorte est devenue rigide. 1 : augmentation de la pression systolique due à la superposition de l’onde réfléchie. 2 : augmentation de la postcharge du VG. 3 : diminution de la pression de perfusion coronarienne en diastole. La flèche bleue indique la pression de perfusion réelle des organes, qui est celle générée par le volume systolique et non celle additionnée du retour de l'onde de pression.
La postcharge du VG est doublée par la rigidité des vaisseaux et encore augmentée par le cumul du retour de l’onde de pression ; ceci entraîne une hypertrophie gauche de type concentrique. Les RAS, résistance statique mesurée par la loi d’Ohm, sont la composante majeure de la postcharge gauche lorsque l’arbre vasculaire est souple et compliant comme il l’est chez le jeune. Lorsque les vaisseaux deviennent rigides chez la personne âgée, c’est au contraire la composante dynamique, mesurée par l’impédance à l’éjection, qui devient le déterminant principal de la postcharge ; le travail du VG est augmenté essentiellement à cause de la rigidité de l’aorte et des grandes artères [3]. Les RAS n’augmentent pas avec le vieillissement lorsqu’il est physiologique (PAd basse), mais seulement lorsqu’il s’accompagne d’hypertension artérielle (PAd élevée).
Le risque cardiovasculaire est directement lié à l’augmentation de la pression pulsée (PAs – PAd). Le taux d’ictus, d’infarctus et de néphropathie s’accroît significativement lorsque la PA pulsée est > 80 mmHg [7,8]. En effet, les organes comme le cerveau, le cœur et les reins ne sont pas protégés par une vasoconstriction artériolaire physiologique mais sont au contraire maintenus en vasodilatation par leur autorégulation pour bénéficier d’un flux maximal. De ce fait, la pulsatilité artérielle s’y propage jusqu’en périphérie ; plus elle augmente, plus s’élève le stress vasculaire et les risques d’accidents. La vélocité de l’onde de pression, qui exprime le degré de rigidité de l’arbre vasculaire, est ainsi un prédicteur indépendant d’accidents cardiovasculaires, avec un hazard ratio de 2.26 [29].
Les inhibiteurs de l’enzyme de conversion (IEC) ou du récepteur de l'angiotensine (IRA) réduisent la rigidité vasculaire et la pression artérielle centrale, et améliorent le pronostic à long terme indépendamment de la baisse de la pression artérielle mesurée en périphérie [3]. Un régime de béta-bloqueur et de diurétique n’a pas ces avantages, car la bradycardie augmente le volume systolique et de ce fait accentue la pression réfléchie [31].
Insuffisance cardiaque
Alors que sa prévalence est de 2.2% dans la population générale, l'insuffisance cardiaque est très présente dans la vieillesse, où elle atteint une incidence de 8.4% au-delà de 75 ans [22]. Outre la sénescence cardiaque déjà mentionnée, un certain nombre de facteurs en augmente le risque [28].
Insuffisance cardiaque
Alors que sa prévalence est de 2.2% dans la population générale, l'insuffisance cardiaque est très présente dans la vieillesse, où elle atteint une incidence de 8.4% au-delà de 75 ans [22]. Outre la sénescence cardiaque déjà mentionnée, un certain nombre de facteurs en augmente le risque [28].
- Hypertension artérielle; elle touche 90% de la population âgée dans les pays industrialisés;
- Coronaropathie; des lésions coronaires sont présentes chez 60% des individus de > 60 ans;
- Obésité; 35% de la population de > 65 ans en souffre;
- Diabète;
- Sédentarité, diète, tabagisme, éthnicité, sexe (prédominance mâle).
Effets de l’anesthésie
L’induction de l’anesthésie provoque une baisse de la pression artérielle plus importante chez la personne âgée que chez le jeune adulte. Plusieurs phénomènes sont impliqués (Figure 21.9).
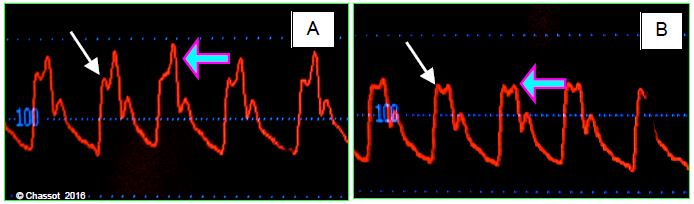
Figure 21.9 : Courbes de pression artérielle avant (A) et après (B) l’induction chez un patient de 80 ans dont les vaisseaux artériels sont athéromateux et rigides. La vasodilatation due à l’anesthésie diminue l’intensité de l’onde réfléchie (flèche violette), mais non sa synchronisation parce que la pression différentielle liée au flux sanguin (premier pic systolique) n’a pas changé (flèches blanches: pression de perfusion des organes). Le moniteur affiche la valeur maximale comme pression systolique, d’où la chute importante de la PAsyst, alors que la pression due à l’éjection du volume systolique ne s’est presque pas modifiée.
- Chute des RAS ; cette vasodilatation diminue considérablement l’intensité de l’onde réfléchie, mais non sa synchronisation parce que la pression artérielle différentielle liée au flux sanguin n’a pas changé. Le moniteur de pression affiche la valeur maximale de la pression comme valeur systolique ; on note donc une chute importante de la PAsyst, alors que la pression due à l’éjection du volume systolique dans les artères ne s’est presque pas modifiée. Ce phénomène est démontré par l’enregistrement préopératoire de la vélocité de l’onde de pression carotido-fémorale ; ce test mesure le degré de rigidité de l’arbre artériel. Chez les patients dont les vaisseaux sont rigides, la chute de pression artérielle à l’induction est de 25% plus importante que chez ceux dont le test est normal [1].
- Baisse de précharge par la veinodilatation (propofol, thiopental) et par le frein au retour veineux (ventilation en pression positive) ; la courbe de Starling étant très verticale à cause de la dysfonction diastolique, la diminution du volume systolique est très marquée.
- Le peu de tachycardie compensatrice ne permet pas de maintenir le débit cardiaque ; ce phénomène est aggravé par le propofol qui bloque la cardio-accélération.
Même avec des substances sans effet inotrope négatif, la pression artérielle et le DC diminuent donc considérablement.
| Modifications cardiovasculaires dues à la vieillesse |
|
La consommation d’O2 et le débit cardiaque baissent de 1%/an à partir de 30 ans. La plupart des organes perd 1%/an de sa fonction à partir de 30-40 ans.
Modifications myocardiques :
- Dysfonction diastolique
- Dépendance accrue du volume systolique à la précharge
- Désensibilisation des récepteurs β et augmentation des récepteurs α
- Abaissement et fixité de la fréquence cardiaque
- Perte d’efficacité des baroréflexes
- Diminution de la réserve fonctionnelle et de la réserve coronarienne
Modifications vasculaires :
- Artériosclérose, perte d’élasticité et rigidité des grandes artères
- Amplification de l’onde de pression et de sa réflexion
- Hypertension artérielle systolique et baisse de la pression diastolique, augmentation de la pression différentielle (PAs – PAd)
|
© CHASSOT PG, Septembre 2007, dernière mise à jour, Décembre 2019
Références
- ALACU C, CUIGNET-ROYER E, MERTES PM, et al. Pre-existing arterial stiffness can predict hypotension during induction of anaesthesia in the elderly. Br J Anaesth 2010; 105:583-8
- AMRANI M, GOODWIN AT, GRAY CC, et al. Ageing is associated with reduced basal and stimulated release of nitric oxide by the coronary endothelium. Acta Physiol Scand 1996; 157:79-84
- BARODKA V, JOSHI BL, BERKOWITZ DE, et al. implications of vascular aging. Anesth Analg 2011; 112:1048-60
- CORCORAN TB, HILLYARD S. Cardiopulmonary aspects of anaesthesia for the elderly. Best Pract Res Clin Anaesthesiol 2011; 25:329-54
- EBERT TJ, MORGAN BJ, BARNEY JA, et al. Effects of aging on baroreflex regulation of sympathetic activity in humans. Am J Physiol 1992; 263:H798-H803
- FLEG JL, O’CONNOR FC, GERSTENBLITH G, et al. Impact of age on the cardiovascular response to dynamic upright exercise in healthy men and women. J Appl Physiol 1995; 78:890-900
- FRANKLIN SS. Cardiovascular risks related to increased diastolic, systolic and pulse pressure. An epidemiologist's point of view. Pathol Biol 1999; 47:594-603
- FRANKLIN SS, KHAN SA, WONG ND, et al. Is pulse pressure useful in predicting risk for coronary heart disease. The Framingham heart study. Circulation 1999; 100:354-60
- GRIFFITHS R, BEECH F, BROWN A, et al. Peri-operative care of the elderly 2014. Guidelines of the Association of Anaesthetists of Great Britain and Ireland. Anaesthesia 2014; 69 (Suppl 1): 81-98
- KOVACIC JC, MORENO P, NABEL EG, et al. Cellular senescence, vascular disease, and aging. Part 2 of a 2-part review: clinical vascular disease in the elderly. Circulation 2011; 123:1900-10
- LAKATTA EG. Changes in cardiovascular function in aging. Eur Heart J 1990; 11(suppl C):22-9
- LAKATTA EG. Cardiovascular aging research: the next horizons. J Am Geriatr Soc 1999; 47:613-25
- LAKATTA EG. Cardiovascular regulatory mechanisms in advanced age. Physiol Rev 1993; 73:413-67
- LEVICK JR. An introduction to cardiovascular physiology. 2nd. ed. Oxford, Butterworth-Heinemann, 1995, p 117
- MOHAMMED SF, MIRZOYEV SA, EDWARDS WD, et al. Left ventricular amyloid deposition in patients with heart failure and preserved ejection fraction. JACC Heart Fail 2014; 2:113-22
- NADAL-GINARD B, et al. Myocyte death, growth and regeneration in cardiac hypertrophy and failure. Circ Res 2003; 92:139-50
- OLIVETTI G, MELISSARI M, CAPASSO JM, et al. Cardiomyopathy of the aging human heart. Myocyte loss and reactive cellular hypertrophy. Circ Res 1991; 68:1560-8
- O'ROURKE MF, AVOLIO AP., NICHOLS WW. Left ventricular / systemic arterial coupling in humans and strategies to improve coupling in disease states. In: YIN FCP, ed. Ventricular / vascular coupling. New York, Springer Verlag, 1987, 1-19
- O’ROURKE MF, SAFAR ME. Relationship between aortic stiffenning and microvascular disease in brain and kidney: cause and logic of therapy. Hypertension 2005; 46:200-4
- PHILIP B, PASTOR D, BELLOWS W, et al. The prevalence of preoperative diastolic filling abnormalities in geriatric surgical patients. Anesth Analg 2003; 97:1214-21
- PRIEBE HJ. The aged cardiovascular risk patient. Br J Anaesth 2000; 85:763-78
- REDFIELD MM, JACOBSEN SJ, BURNETT JC, et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003; 289:194-202
- ROOKE GA. Autonomic and cardiovascular function in the geriatric patients. Anesthesiol Clin N Am 2000; 18:31-46
- RUDNER XL, BERKOWITZ DE, BOOTH JV, et al. Subtype specific regulation of human 1-adrenergic receptors by vessel bed an age. Circulation 1999; 100:2336-43
- SAFAR ME, LEVY BI, STRUIJKER-BOUDIER H. Current perspectives on arterial stiffness and pulse pressure in hypertension and cardiovascular disease. Circulation 2003; 107:2864-9
- SHIH H, LEE B, RANDALL BA, et al. The aging heart and post-infarction left ventricular remodeling. J Am Coll Cardiol 2011; 57:9-17
- TONNER PH KAMPEN J, SCHOLZ J. Pathophysiological changes in the elderly. Best Pract Clin Res Anaesth 2003; 17:163-77
- TRIPOSKIADIS F, XANTHOPOULOS A, BUTLER J. Cardiovascular aging and heart failure. JACC review topic of the week. J Am Coll Cardiol 2019; 74:804-13
- VLACHOPOULOS C, AZNAOURIDIS K, O’ROURKE MF, et al. Prediction of cardiovascular events and all-cause mortality with central haemodynamics: a systematic review and meta-analysis. Eur Heart J 2010; 31:1819-22
- WHITE M, RODEN R, MINOBE W, et al. Age-related changes in beta-adrenergic neuroeffector systems in the human heart. Circulation 1994; 90:1225-38
- WILLIAMS B, LACY PS. Impact of heart rate on central aortic pressures and hemodynamics: analysis from the CAFE (Conduit Artery Function Evaluation) study: CAFE-heart rate. J Am Coll Cardiol 2009; 94:705-13
