Ischémie myocardique
Le taux d'ischémie et d'infarctus est plus faible en peropératoire qu’en-dehors de la salle d’opération [13]. En effet, le malade analgésié, endormi et minutieusement monitorisé est dans une situation privilégiée; seuls 16% des infarctus surviennent en cours d'opération [1]. Dans le postopératoire, au contraire, il court 4-6 fois plus de risque ischémique à cause du réveil, de la douleur, du stress et du relâchement de la surveillance [20]. Alors que les épisodes ischémiques peropératoires n’ont que peu de lien avec l’incidence de l’infarctus postopératoire, les évènements ischémiques postopératoires, eux, sont directement reliés à la survenue d’infarctus [14,19]. L'ischémie survient le plus souvent dans la période postopératoire immédiate (24-48 premières heures), qui est un moment de fort déséquilibre hémodynamique. Elle est silencieuse dans 90% des cas, et ne se manifeste que par un sous- ou un sus-décalage (> 1 mm) prolongé du segment ST ou par un bloc de branche gauche, pour autant que le malade soit sous surveillance ECG constante. Elle est très souvent précédée ou accompagnée d’une période de tachycardie, qui débute dès les premières heures postopératoires [15].
Actuellement, ce sont les troponines qui sont considérées comme l’étalon-or pour la surveillance de l’ischémie postopératoire. En effet, leur élévation au-dessus du 99ème percentile de la valeur normale offre la meilleure corrélation avec la mortalité à 30 jours : l’odds ratio (OR) varie de 3.4 à 6.7 selon les études, bien que 80% des patients soient asymptomatiques [4,8,29]. Plus leur taux est élevé, plus le risque est grand : OR 2.2 pour 0.02 mcg/L, OR 5.4 pour 0.03-0.3 mcg/L et OR 10.7 pour > 0.3 mcg/L [3,8]. La présence d’une souffrance myocardique caractérisée par un relargage de troponines sans signes ECG ni symptômes cliniques a la même valeur prédictive de mortalité qu’un infarctus ; après chirurgie non-cardiaque intermédiaire ou majeure chez les malades de > 45 ans, elle est aussi fréquente que la sepsis et l’embolie pulmonaire (8-16% des cas) [4,24]. Comme le délai entre le pic de troponine et le décès varie de 9 [8] à 12 jours [29], on dispose largement du temps nécessaire pour prendre en charge le patient dans le cadre d’un infarctus aigu et avoir ainsi un impact thérapeutique majeur (voir Traitement de l’ischémie aiguë). Ces dernières années, le développement de tests ultrasensibles capables de déceler des traces de troponine de l'ordre de 1-3 ng/L a permis un diagnostic beaucoup plus précoce de l'infarctus (1 heure après le début des symptômes au lieu de 6 heures). La valeur-seuil pour une signification pathologique est basée sur le dépassement du 99ème percentile des valeurs rencontrées dans une population normale, mais elle dépend du test utilisé et varie considérablement d'un dispositif à un autre [31]. En adoptant une valeur-seuil de 14 ng/L comme définition de l'infarctus, le taux de lésion ischémique après chirurgie majeure chez les patients de > 65 ans, ou de > 45 ans souffrant de maladie cardiovasculaire, est de 9% dans la catégorie de moindre risque et de 25% dans la catégorie de risque maximal (moyenne 16%). La mortalité à 1 mois et à 1 année est respectivement de 9% et 22%, alors qu'elle est de 1.6% et 2.1% chez les malades sans variation de troponine [24]. La mortalité est identique si l'ischémie est silencieuse ou si les patients sont symptomatiques (précordialgie, altération du segment ST, BBG nouveau, onde Q, modification segmentaire de contractilité ou thrombus à la coronarographie). La douleur thoracique est d'ailleurs rare en postopératoire (6% des cas), et les modifications ST ne concernent qu'un quart des sujets [24]. La moitié des patients affichant une élévation des troponines (troponines I > 60 ng/L) après chirurgie majeure souffre d'une coronaropthie significative à l'angio-CT, alors que ces malades ne présentent pas d'anamnèse cardiaque ni de symptomatologie après l'opération [11].
Définie par les troponines à haute sensibilité (TnT/I-hs), une ischémie myocardique postopératoire est présente chez 8-25% des patients à risque intermédiaire et élevé, bien que 58% d’entre eux ne remplissent pas les critères d’un infarctus et que 84% soient asymptomatiques [4,5,29]. Ils souffrent de ce qu’il est convenu d’appeler MINS (Myocardial Injury after Noncardiac Surgery) [4]. Cette souffrance myocardique sans traduction clinique ni électrocardiographique correspond toutefois à une pathologie bien réelle, puisqu'elle est associée à une péjoration significative du pronostic et à une mortalité 3 fois plus élevée (OR 2.9) [22]. Cette mortalité est proportionnelle au taux de troponine. Ainsi, une élévation de 0.02 ng/L, 0.03-0.25 ng/L et de ≥ 0.3 ng/L est associée à une élévation de la mortalité postopératoire de 2.41, 5.0 et 10.5 fois respectivement [30]. Toutefois, l’élévation du taux de troponine postopératoire à des valeurs inférieures à celles admises pour le diagnostic non-équivoque d’infarctus est un marqueur de risque pour les complications cardiovasculaires et générales (embolie pulmonaire, insuffisance respiratoire, AVC, sepsis) plus que pour l’infarctus per se [29]. La question est de savoir si la mise en évidence de MINS réclame une sanction thérapeutique, bien que le taux de troponine soit faible et l’ECG sans altération. Une étude portant sur 667 patients de chirurgie vasculaire a montré que le traitement correspondant à celui d’une ischémie myocardique stable asymptomatique (antiplaquettaires, statine, béta-bloqueur, inhibiteur de l’enzyme de conversion et, à long terme, modifications du style de vie) est bénéfique: le risque de complication est nettement diminué (HR 0.63) chez les patients traités activement alors qu'il est augmenté chez ceux qui ne l'ont pas été (HR 2.8) [10]. Ce traitement est parfaitement concevable comme préparation préopératoire chez les patients à haut risque ischémique.
Infarctus
L’incidence d’infarctus myocardique dans la période périopératoire est de 1.4% dans la population générale, toutes interventions confondues ; elle s'élève à 3.9% dans les populations à risque [1,2,17,19]. La période postopératoire est particulièrement dangereuse pendant plusieurs jours à cause de la vulnérabilité du patient à trois phénomènes [21].
- Syndrome inflammatoire systémique (acute phase reaction):
- Elévation de tous les marqueurs inflammatoires, activation leucocytaire;
- Activation généralisée de l’inflammation dans les plaques instables;
- Hypercoagulabilité : augmentation du nombre et de l’adhésivité des plaquettes, élévation du taux de fibrinogène, de facteur VIII et de von Willebrand, chute de la fibrinolyse.
- Augmentation de la demande en O2 (mVO2):
- Stimulation sympathique : hypertension artérielle, tachycardie et augmentation de la contractilité;
- Douleur, stress, hypothermie (les frissons augmentent la VO2 jusqu’à 4 fois);
- Dans les coronaires : vasoconstriction épicardique, sécrétion locale d’endothéline, augmentation des forces de cisaillement sur les plaques instables.
- Baisse de l’apport d’O2 (DO2):
- Hypotension et hypovolémie;
- Anémie aiguë;
- Diminution des échanges gazeux (atélectasie, hypoventilation);
- Augmentation de la viscosité (déshydratation).
L’infarctus postopératoire est silencieux dans la majorité des cas [2,14] : l'angor n'est présent que chez 14% des patients, et des symptômes cliniques n'apparaissent que dans 53% des cas [19]. Après un acte de chirurgie générale, on rencontre les deux types d’infarctus mentionnés précédemment ; ils surviennent préférentiellement pendant les premières 24 à 96 heures.
- Infarctus sur sténose serrée et déséquilibre DO2/VO2 (infarctus de type 2): 60-75% des accidents coronariens sont précédés de longs épisodes de tachycardie, d'hypotension et de sous-décalage du segment ST (non-STEMI) [9,12,14,15] ; la durée de ce sous-décalage est directement associée à la valeur du pic de troponine enregistré ultérieurement [25]. L’ascension des troponines est tardive, et l’accident survient en général au 3ème ou 4ème jour [16,18]. Le β-blocage est une prévention possible; la prise en charge est initialement médicale, suivie secondairement de tests d'effort et d'une revascularisation si indiquée.
- Infarctus sur rupture de plaque instable et thrombose (infarctus de type 1): 22-40% des infarctus apparaîssent sur des plaques thrombosées, en-dehors des sténoses les plus serrées à la coronarographie [7,12,23]. Ce type d’infarctus survient plus tôt, en général dans les 36 premières heures, mais il peut apparaître n’importe quand dans les dix jours qui suivent l’intervention [18]. Il n’est pas précédé de modifications du segment ST et se caractérise par une surélévation ST (STEMI) ; l’élévation des troponines est brusque et précoce. La seule prévention efficace est les antiplaquettaires (aspirine, clopidogrel, prasugrel, ticagrelor) et les statines [6]. Le traitement est une revascularisation d’urgence (angioplastie et stent).
En outre, 10% des syndromes coronariens aigus périopératoires sont liés à une cardiomyopathie de stress et ne présentent pas de lésion coronarienne [12]. Bien que la morphologie de leurs plaques soit semblable, les infarctus périopératoires présentent moins souvent un thrombus intracoronarien que les infarctus rencontrés en cardiologie (13% versus 67% des cas) [27]. Ceci traduit l'implication plus fréquente d'une altération du rapport DO2/VO2 dans la genèse des premiers que dans celle des seconds, comme le prouve le fait qu'une hypotension peropératoire (baisse de la PA de ≥ 40% par rapport à la valeur pré-induction pendant ≥ 30 minutes) double le risque de lésion myocardique définie par le taux de troponine postopératoire [28]. L'hypotension et la tachycardie sont directement associées à l'ischémie, à l'infarctus et à la mortalité cardiaque (OR 1.41-1.81) [1]. Dans l'analyse secondaire d'une étude prospective, par exemple, l'hypotension (PAsyst < 90 mmHg pendant > 10 min) est indiscutablement liée à la survenue d'infarctus ou de décès cardiovasculaire après chirurgie majeure [26].
- Patients sans hypotension ni coronaropathie (taux de base): 2.7%;
- Patients sans hypotension mais avec coronaropathie obstructive: 6.7% (HR 2.51);
- Patients avec hypotension mais sans coronaropathie: 8.8% (HR 3.85);
- Patients avec hypotension et avec coronaropathie obstructive: 16.4% (HR 7.34);
- Ces accidents sont survenus dans les 12 premiers jours postopératoires.
La mortalité de l'infarctus postopératoire (9% à 1 mois et 14-25% à 1 an, moyenne 10-15%) est plus élevée que celle de l'infarctus qui survient en dehors d'un contexte chirurgical (5%) [5,12]. Elle est également plus importante en cas de STEMI (31%) que de N-STEMI (8.5%) lorsque la situation requiert une revascularisation d'urgence [23]. Dans les deux catégories, les malades de chirurgie vasculaire ont la plus forte morbi-mortalité.
Une étude de l'évolution postopératoire des taux de troponine I (cTnI) après chirurgie de l'aorte abdominale montre que le 14% des patients présente une élévation de la cTnI [18]. Chez 9%, cette élévation est inférieure au seuil fixé à 1.5 ng/L; il s'agit de lésion myocardique sans infarcissement (mortalité 7%). Chez 5%, le seuil de 1.5 ng/L est franchi, traduisant la présence d'un infarctus. Dans ce dernier cas, les malades se répartissent en deux catégories selon la période à laquelle apparaît le pic de cTnI (Figure 9.7):
- Pic à 37 heures chez 2% ; mortalité 24%;
- Pic à 74 heures chez 3% ; mortalité 21%.
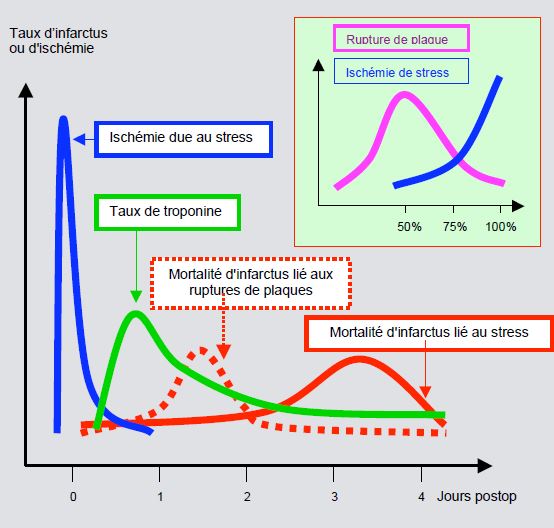
Figure 9.7 : Représentation schématique de l'incidence d'ischémie, du taux de troponine, et de la mortalité de l'infarctus dans la période postopératoire précoce. On distingue deux types d'infarctus: infarctus non-Q lié à l'ischémie sur une sténose coronarienne serrée (trait plein), et infarctus avec onde Q dû à une rupture de plaque sur une sténose non significative (traitillé). L'infarctus lié à une ischémie de stress prolongée culmine entre vers le 3ème jour après l'intervention, alors que le deuxième est plus précoce [18]. La cartouche illustre l'incidence des deux types d'infarctus selon le degré de sténose coronarienne à l'angiographie: l'infarctus lié à une rupture de plaque est le plus fréquent dans les sténoses angiographiquement non significatives (50%), alors que l'infarctus lié à l'ischémie est d'autant plus courant que la sténose est plus serrée [13].
Le premier pic, très soudain, traduit probablement des infarctus liés à des ruptures de plaques instables (infarctus type 1). Le second pic survient après une période d'élévation constante de la troponine I traduisant une ischémie persistante, de même niveau que celle des lésions cellulaires sans infarctus. Dans ce cas, l’infarctus est probablement secondaire à une ischémie sur déséquilibre DO2/VO2 (infarctus type 2). Le contrôle de la fréquence cardiaque est un élément capital dans la prévention de cet accident, d'où l'efficacité du béta-blocage prophylactique.
La dichotomie en deux types séparés d’infarctus est une simplification méthodologique pratique, mais probablement trop grossière. L’infarctus postopératoire est la manifestation ultime d’une longue cascade d’évènements multiples et interdépendants, qui interagissent entre eux de manière dynamique et imprédictible (Figure 9.8). Le nombre et la variété des mécanismes en jeu expliquent l’aspect aléatoire du phénomène et le peu d’impact de la revascularisation préopératoire sur le devenir des patients en chirurgie non-cardiaque. Ces données justifient la tendance actuelle de préférer une cardioprotection pharmacologique maximale (béta-bloqueurs, antiplaquettaires, statines, préconditionnement, anesthésie combinée) et le strict contrôle hémodynamique peropératoire (fréquence ≤ 65 batt/min, PAM ≥ 80 mmHg) à une série d’investigations préopératoires coûteuses.
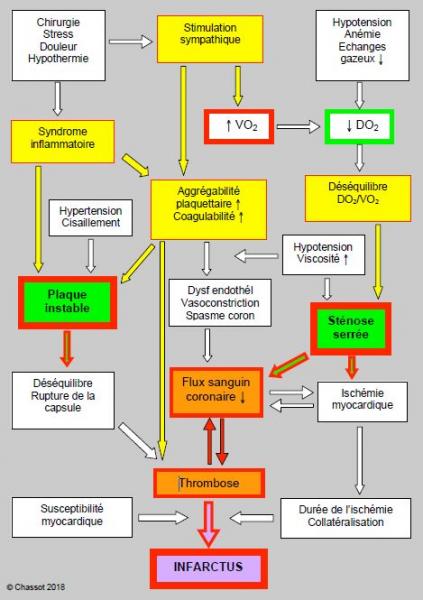
Figure 9.8 : Représentation schématique des mécanismes liés à l’infarctus postopératoire au niveau de la circulation coronarienne. La dichotomie entre plaque instable et sténose serrée est noyée au milieu d’une série d’éléments interdépendants et d’importance variable selon les situations, d’où l’imprédictibilité fondamentale de l'infarctus postopératoire.
| Infarctus postopératoire en chirurgie non-cardiaque |
|
En chirurgie non-cardiaque, le taux d'infarctus postopératoire chez les coronariens stables varie de 1-6% selon le type de chirurgie (mortalité moyenne: 7-20%); en cas de syndrome coronarien aigu, il varie de 8% à 31% (mortalité moyenne: 10-20%). Les épisodes ischémiques postopératoires, non peropératoires, sont liés à l'incidence d'infarctus. L'infarctus postopératoire est en général silencieux. Ses pics d'incidence sont à 24-36 heures (infarctus sur plaque instable) et à 72 heures (infarctus sur déséquilibre DO2/VO2, plus fréquent et en général précédé de longs épisodes de tachycardie).
L'infarctus de type 1 (STEMI, plaque instable) est moins frequent que l'infarctus de type 2 (N-STEMI, déséquilibre DO2/VO2) dans le périopératoire: proportion approximative 1/3 – 2/3. Une élévation asymptomatique et isolée des troponines à haute sensibilité est présente dans environ 15% des cas après une chirurgie majeure (MINS, Myocardial Injury after Noncardiac Surgery); elle est liée à une augmentation de la mortalité proportionnelle à celle des troponines.
L'hypotension et la tachycardie sont directement associée aux lesions ischémiques. La meilleure protection contre l'infarctus périopératoire est une cardioprotection pharmacologique maximale (béta-bloqueurs, antiplaquettaires, statines, préconditionnement, anesthésie combinée) et un strict contrôle hémodynamique peropératoire (fréquence ≤ 65 batt/min, PAM ≥ 80 mmHg, maintien du transport d'O2).
|
© BETTEX D, CHASSOT PG, RANCATI V, Janvier 2008, dernière mise à jour, Novembre 2019
Références
- ABBOTT TEF, PEARSE RM, ARCHBOLD A, et al. A prospective international multicentre cohort study of intraoperative heart rate and systolic blood pressure and myocardial injury after noncardiac surgery: results of the VISION study. Anesth Analg 2018; 126:1936-45
- BADNER NH, KNILL RL, BROWN JE, et al. Myocardial infarction after noncardiac surgery. Anesthesiology 1998; 88:572-8
- BICCARD BM. Detection and management of perioperative myocardial ischemia. Curr Opin Anesthesiol 2014; 27:336-43
- BOTTO F, ALONSO-COELLO P, CHAN MT, et al. Myocardial injury after noncardiac surgery: a large international prospective cohort study establishing diagnostic criteria: characteristics, predictors, and 30-day outcomes. Anesthesiology 2014:120:564-78
- CHAPMAN AR, SHAH ASV, LEE KK, et al. Long-term outcomes in patients with type 2 myocardial infarction and myocardial injury. Circulation 2018; 137:1236-45
- CHASSOT PG, MARCUCCI C, DELABAYS A, SPAHN DR. Perioperative antiplatelet drugs. Am Fam Physician 2010; 82:1484-9
- DAWOOD MM, GUPTA DK, SOUTHERN J, et al. Pathology of fatal perioperative myocardial infarction: implications regarding physiopathology and prevention. Int J Cardiol 1996; 57:35-44
- DEVEREAUX PJ, CHAN MT, ALONSO-COELO P, et al. Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307:2295-304
- DUVALL WI, SEALOVE B, PUNGOTI C, et al. Angiographic investigation of the pathophysiology of perioperative myocardial infarction. Catheter Cardiovasc Interv 2012; 80:768-76
- FOUCRIER A, RODSETH R, AISSAOUI M, et al. The long-term impact of early cardiovascular therapy intensification for postoperative troponin elevation after major vascular surgery. Anesth Analg 2014; 119:1053-63
- GROBBEN RB, VAN WAES JAR, LEINER T, et al. Unexpected cardiac computed tomography findings in patients with postoperative myocardial injury. Anesth Analg 2018; 126:1462-8
- HELWANI MA, AMIN A, LAVIGNE P, et al. Etiology of acute coronary syndrome after noncardiac surgery. Anesthesiology 2018; 128:1084-91
- LANDESBERG G. The pathophysiology of perioperative myocardial infarction: Facts and perspectives. J Cardiothorac Vasc Anesth 2003; 17:90-100
- LANDESBERG G, LURIA MH, COTEV S. et al. Importance of long-duration postoperative ST-segment depression in cardiac morbidity after vascular surgery. Lancet 1993; 341:715-9
- LANDESBERG G, MOSSERI M, ZAHGER D, et al. Myocardial infarction following vascular surgery: The role of prolonged, stress induced, ST-depression type ischemia. J Am Coll Cardiol 2001; 37:1839-45
- LANDESBERG G, SHATZ V, AKOPNIK I, et al. Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term survival after major vascular surgery. J Am Coll Cardiol 2003; 42:1547-54
- LEE TH, MARCANTONIO ER, MANGIONE CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LEMANACH Y, PERREL A, CORIAT P, ET AL. Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005; 102:885-91
- MANGANO DT, BROWNER WS, HOLLENBERG M, et al. Association of perioperative myocardial ischemia with cardiac morbidity and mortality in men undergoing noncardiac surgery. The study of Perioperative Ischemia Research Group. N Engl J Med 1990; 323:1781-8
- MANGANO DT, HOLLENBERG M, FEGERT G, et al. Perioperative myocardial ischemia in patients undergoing non-cardiac surgery. J Am Coll Cardiol 1991; 17:843-57
- NAGHAVI M, LIBBY P, FALK E, et al. From vulnerable plaque to vulnerable patient. A call for new definitions and risk assessment strategies. Part I. Circulation 2003; 108:1664-72
- OBERWEIS BS, SMILOWITZ NR, NUKALA S, et al. Relation of perioperative elevation of troponin to long-term mortality after orthopedic surgery. Am J Cardiol 2015; 115:1643-8
- PARASHAR A, AGARWAL S, KRISHNASWAMY A, et al. Percutaneous intervention for myocardial infarction after noncardiac surgery: patient characteristics and outcomes. J Am Coll Cardiol 2016; 68:329-38
- PUELACHER C, LURATI BUSE G, SEEBERGER D, et al. Perioperative myocardial injury after noncardiac surgery. Circulation 2018; 137:1221-32
- RAPP HJ, RABETHGE S, LUIZ T, et al. Perioperative ST-segment depression and troponin T release. Identification of patients with highest risk for myocardial damage. Acta Anaesthesiol Scand 1999; 43:124-9
- ROSHANOV PS, SHETH T, DUCEPPE E, et al. Relationship between perioperative hypotension and perioperative cardiovascular events in patients with coronary artery disease undergoing major noncardiac surgery. Anesthesiology 2019; 130:756-66
- SHETH T, NATARAJAN MK, HSIEH V, et al. Incidence of thrombosis in perioperative and non-operative myocardial infarction. Br J Anaesth 2018; 120:725-33
- VAN WAES JA, VAN KLEI WA, WIJEYSUNDERA DN, et al. Association between intraoperative hypotension and myocardial injury after vascular surgery. Anesthesiology 2016; 124:35-44
- VAN WAES JA, NATHOE HM, DE GRAAFF JC, et al. Myocardial injury after noncardiac surgery and its association with short-term mortality. Circulation 2013; 127:2264-71
- VISION – The Vascular Events in Noncardiac Surgery Patients Cohort Evaluation study investigators. Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012; 307:2295-304
- WESTERMANN D, NEUMANN JT, SÖRENSEN NA, et al. High-sensitivity assays for troponin in patients with cardiac disease. Nat Rev Cardiol 2017; 14:472-83
