IM primaire vs secondaire
L'importance de l'IM secondaire est beaucoup plus dynamique et fluctuante que celle de l'IM primaire, parce que la première est liée à la fonction ventriculaire alors que la seconde est déterminée par la lésion structurelle des feuillets. La surface de l'orifice de régurgitation de l'IM secondaire augmente significativement au test d'effort, mais diminue considérablement sous anesthésie à cause de la baisse de précharge, de postcharge et de tonus sympathique. Les agents inotropes comme la dobutamine contribuent aussi à sa diminution en réduisant le volume télésystolique du VG, sauf s'ils induisent une ischémie myocardique aiguë [10]. L'absence d'effet de la dobutamine sur l'IM traduit une absence de réserve contractile qui pronostique une dyfonction ventriculaire postopératoire. Une augmentation de précharge (remplissage, Trendelenburg) ou de postcharge (vasopresseur) forcent la dilatation du VG et accroissent la régurgitation secondaire. Au contraire, une IM sur prolapsus ou sur obstruction dynamique de la CCVG diminue dans ces conditions, parce que l'agrandissement du VG exerce une tension sur les cordages qui ramène le prolapsus vers le plan de coaptation dans le premier cas, ou contrecarre l'effet SAM dans le second cas [17].
Le volume régurgité, un élément directement lié au pronostic, dépend de la durée d'ouverture de l'orifice de régurgitation au cours de la systole. Or la surface de cet orifice est une donnée dynamique qui varie au cours de l'éjection. Ainsi la surface de la vena contracta (SVC) ou le pic de dimension du PISA, qui sont calqués sur la surface de l'orifice de régurgitation, ne sont pas constants au cours de la systole; ils présentent un pic télésystolique dans l'IM primaire sur prolapsus (augmentation de 110%); ce phénomène est absent dans l'IM sur rupture de cordage ou sur RAA. Dans les IM secondaires, la variation de la SVC présente une allure biphasique, avec une augmentation en proto- et en télé-systole (27%), mais une baisse en mésosystole (Figure 26.42) [1,23]. La raison de cette configuration particulière de l'IM secondaire est le léger rétrécissement de la surface de fuite mitrale lorsque la pression intraventriculaire, qui tend à fermer la mitrale, est à son maximum en méso-systole. Dans l'IM primaire, l'augmentation de pression intraventriculaire en cours de systole tend au contraire à augmenter le prolapsus du feuillet pathologique. Ce phénomène démontre le manque de pertinence des mesures réalisées sur une image immobile (still frame) sélectionnée à un instant aléatoire de la systole et la difficulté à comparer les IM primaires et les IM secondaires avec les mêmes critères.
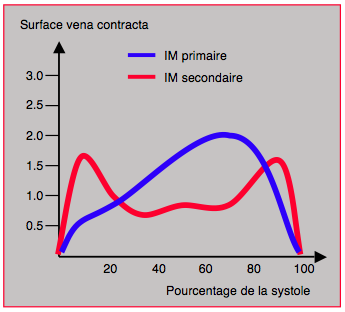
Figure 26.42: Evolution de l'IM au cours de la systole décrite par celle de la surface de la vena contracta. En rouge: IM fonctionnelle; répartition temporelle biphasique avec une diminution méso-systolique. En bleu: IM structurelle (maladie de Barlow); la surface de la vena contracta s'accroît progressivement pour culminer en télésystole [1].
IM secondaire
La prévalence d'IM secondaire est de 28% chez les patients souffrant d'ischémie myocardique et de 50% chez ceux qui sont en insuffisance ventriculaire gauche [26,27]. La découverte d'une IM significative à l'examen ETO pré-CEC est donc fréquente pour l'anesthésiste échocardiographeur. Cette insuffisance est de type IIIb, symétrique en cas de dilatation du VG et asymétrique en cas d'ischémie focalisée. La caractéristique échocardiographique de l'IM secondaire est le maintien d'un ou des deux feuillets mitraux en-dessous du plan de l'anneau mitral en systole à cause de la traction excessive exercée par les cordages ancrés sur une paroi ventriculaire localement ou globalement dilatée. Le point de coaptation est situé à une certaine distance intraventriculaire du plan de l'anneau (Vidéos). Le triangle formé en systole par le plan de l'anneau et les deux feuillets ressemble à une tente (à l'envers en ETO mais à l'endroit en ETT); il détermine quelques paramètres permettant de quantifier le degré de déformation mitrale liée à la pathologie ventriculaire (Figure 26.43). Dans l'IM secondaire, l'anneau mitral est plus plat, il perd sa forme en selle, s'agrandit mais diminue son degré de rétrécissement et son coulissage vertical en systole [9]. La déformation est sévère lorsque les conditions suivantes sont remplies (mesures faites en mésosystole) [2,9,15,24].
L'importance de l'IM secondaire est beaucoup plus dynamique et fluctuante que celle de l'IM primaire, parce que la première est liée à la fonction ventriculaire alors que la seconde est déterminée par la lésion structurelle des feuillets. La surface de l'orifice de régurgitation de l'IM secondaire augmente significativement au test d'effort, mais diminue considérablement sous anesthésie à cause de la baisse de précharge, de postcharge et de tonus sympathique. Les agents inotropes comme la dobutamine contribuent aussi à sa diminution en réduisant le volume télésystolique du VG, sauf s'ils induisent une ischémie myocardique aiguë [10]. L'absence d'effet de la dobutamine sur l'IM traduit une absence de réserve contractile qui pronostique une dyfonction ventriculaire postopératoire. Une augmentation de précharge (remplissage, Trendelenburg) ou de postcharge (vasopresseur) forcent la dilatation du VG et accroissent la régurgitation secondaire. Au contraire, une IM sur prolapsus ou sur obstruction dynamique de la CCVG diminue dans ces conditions, parce que l'agrandissement du VG exerce une tension sur les cordages qui ramène le prolapsus vers le plan de coaptation dans le premier cas, ou contrecarre l'effet SAM dans le second cas [17].
Le volume régurgité, un élément directement lié au pronostic, dépend de la durée d'ouverture de l'orifice de régurgitation au cours de la systole. Or la surface de cet orifice est une donnée dynamique qui varie au cours de l'éjection. Ainsi la surface de la vena contracta (SVC) ou le pic de dimension du PISA, qui sont calqués sur la surface de l'orifice de régurgitation, ne sont pas constants au cours de la systole; ils présentent un pic télésystolique dans l'IM primaire sur prolapsus (augmentation de 110%); ce phénomène est absent dans l'IM sur rupture de cordage ou sur RAA. Dans les IM secondaires, la variation de la SVC présente une allure biphasique, avec une augmentation en proto- et en télé-systole (27%), mais une baisse en mésosystole (Figure 26.42) [1,23]. La raison de cette configuration particulière de l'IM secondaire est le léger rétrécissement de la surface de fuite mitrale lorsque la pression intraventriculaire, qui tend à fermer la mitrale, est à son maximum en méso-systole. Dans l'IM primaire, l'augmentation de pression intraventriculaire en cours de systole tend au contraire à augmenter le prolapsus du feuillet pathologique. Ce phénomène démontre le manque de pertinence des mesures réalisées sur une image immobile (still frame) sélectionnée à un instant aléatoire de la systole et la difficulté à comparer les IM primaires et les IM secondaires avec les mêmes critères.

Figure 26.42: Evolution de l'IM au cours de la systole décrite par celle de la surface de la vena contracta. En rouge: IM fonctionnelle; répartition temporelle biphasique avec une diminution méso-systolique. En bleu: IM structurelle (maladie de Barlow); la surface de la vena contracta s'accroît progressivement pour culminer en télésystole [1].
IM secondaire
La prévalence d'IM secondaire est de 28% chez les patients souffrant d'ischémie myocardique et de 50% chez ceux qui sont en insuffisance ventriculaire gauche [26,27]. La découverte d'une IM significative à l'examen ETO pré-CEC est donc fréquente pour l'anesthésiste échocardiographeur. Cette insuffisance est de type IIIb, symétrique en cas de dilatation du VG et asymétrique en cas d'ischémie focalisée. La caractéristique échocardiographique de l'IM secondaire est le maintien d'un ou des deux feuillets mitraux en-dessous du plan de l'anneau mitral en systole à cause de la traction excessive exercée par les cordages ancrés sur une paroi ventriculaire localement ou globalement dilatée. Le point de coaptation est situé à une certaine distance intraventriculaire du plan de l'anneau (Vidéos). Le triangle formé en systole par le plan de l'anneau et les deux feuillets ressemble à une tente (à l'envers en ETO mais à l'endroit en ETT); il détermine quelques paramètres permettant de quantifier le degré de déformation mitrale liée à la pathologie ventriculaire (Figure 26.43). Dans l'IM secondaire, l'anneau mitral est plus plat, il perd sa forme en selle, s'agrandit mais diminue son degré de rétrécissement et son coulissage vertical en systole [9]. La déformation est sévère lorsque les conditions suivantes sont remplies (mesures faites en mésosystole) [2,9,15,24].
- Diamètre de l'anneau > 4.0 cm (en vue long-axe 120-140°), surface de l'anneau > 12 cm2;
- Distance entre le point de coaptation et le plan de l'anneau: distance de tente (tenting distance) ≥ 1.1 cm (normal < 7 mm);
- Surface entre le plan de l'anneau et les feuillets mitraux: surface de tente (tenting surface) ≥ 2.5 cm2 (normale < 1.2 cm2);
- Volume entre le plan de l'anneau et les feuillets mitraux (3D): volume de tente (tenting volume) ≥ 3.5 cm3;
- Non-planarité de l'anneau > 150° (perte de la forme en selle);
- Coulissage vertical systolique diminué < 5.8 mm;
- Angle du feuillet antérieur avec le plan de l'anneau > 20°;
- Angle du feuillet postérieur avec le plan de l'anneau > 30°;
- Déformation en "aile de mouette" (seagull sign) du feuillet antérieur par traction des cordages secondaires implantés sur le corps du feuillet; ceci survient lors de déplacement vers l'extérieur d'un muscle papillaire à cause d'une ischémie de la paroi sous-jacente (postérieure ou antéro-latérale) (Figure 26.44).
- Pseudo-prolapsus: la traction excessive sur un feuillet alors que l'autre reste en place engendre un jet d'IM excentrique qui peut être confondu avec celui d'un prolapsus du feuillet opposé (Figure 26.45).
Vidéo: insuffisance mitrale secondaire sur dilatation du VG (IM type IIIb); les feuillets sont retenus en systole en-dessous de leur point de coaptation. L'IM est centrale et symétrique.
Vidéo: insuffisance mitrale secondaire sur dilatation du VG (cardiomyopathie ischémique avec akinésie antéro-latérale étendue); l'IM est légèrement asymétrique.
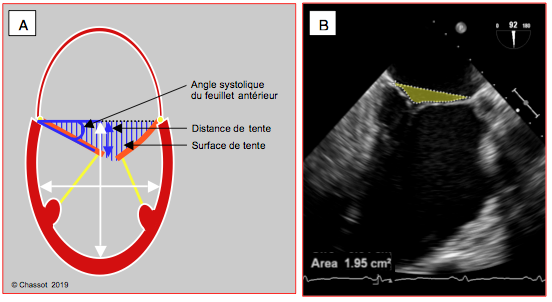
Figure 26.43 : IM restrictive (Type IIIb) sur dilatation du VG. A: Le degré de restriction est défini par la distance du point de coaptation au plan de l’anneau mitral (distance de tente), la surface triangulaire comprise entre les feuillets et le plan de l’anneau (surface de tente), et l’angle de fermeture du feuillet antérieur mesuré entre le plan de l’anneau et l’extrémité du feuillet [21]. Le rapport des diamètres du VG en long axe et en court axe définit le degré de sphéricisation de celui-ci (rapport normal long-axe / court-axe : > 1.5). B: dessin de la surface de tente (1.95 cm2) en vue 4-cavités d'un VG dilaté et sphérique.
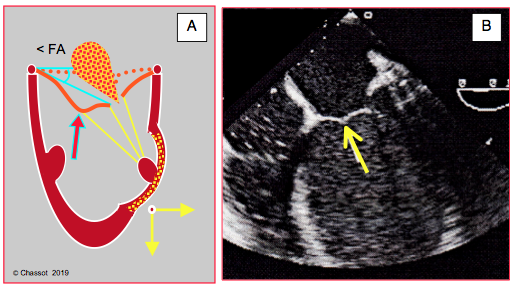
Figure 26.44 : Akinésie ou dyskinésie segmentaire entraînant le muscle papillaire vers l’extérieur avec une traction excessive sur les codages de 2ème ordre du feuillet antérieur dans une insuffisance mitrale ischémique; ceci se traduit par une image en aile de mouette du feuillet antérieur (flèches). < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. Dans l'image ETO, on voit clairement la dilatation sphérique du VG. La section chirurgicale des cordages de 2ème ordre peut être curative dans ce cas de figure.
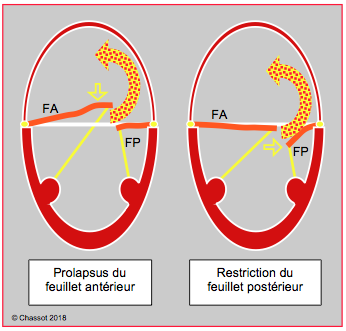
Figure 26.45 : Insuffisance mitrale excentrique dirigée vers la paroi latéro-postérieure de l’OG ; elle peut être due à un prolapsus du feuillet antérieur (FA) ou à une restriction du feuillet postérieur (FP). Dans le premier cas, le feuillet antérieur est basculé en arrière du plan de l’anneau mitral (prolapsus vrai), alors que dans le second le feuillet postérieur est maintenu en dessous du plan de l’anneau (faux prolapsus). Dans les deux cas, le jet a la même direction.
Ces mesures sont réalisées en vue mi-œsophage 4-cavités 0°, 2-cavités 90° et long-axe 120° en télésystole. Dans les IM secondaires, la ligne de coaptation entre les feuillets conserve sa forme en croissant, puisque ces derniers sont normaux. Le PISA et la vena contracta ne sont plus de section circulaire mais reproduisent plus ou moins une fente. Leur diamètre tel qu'il est mesuré habituellement sous-estime considérablement leur importance. De ce fait, les critères de sévérité sont plus faibles, et l'IM IIaire est considérée comme sévère dès que la surface de l'orifice de régugitation (calculée par le PISA ou la vena contracta) est > 0.2 cm2 et le volume de régugitation > 30 mL. Au problème de la forme en croissant et non-circulaire de l'orifice de régurgitation s'ajoute l'atteinte ischémique ou fonctionnelle du VG que peut décompenser une IM même modérée. Un diamètre de vena contracta ≥ 0.4 cm et une surface de régurgitation de ≥ 0.2 cm2 sont associés à une élévation de la mortalité [5]. Ces remarques justifient les seuils plus bas pour la définition de l'IM sévère lorsqu'elle est secondaire. Toutefois, lorsque les mesures sont exécutées en 3D, on tend maintenant à prendre les mêmes critères de sévérité que pour les IM primaires, puisque la technologie tridimensionnelle permet la mesure réelle de l'orifice de régurgitation quelle que soit sa forme; elle est exempte des approximation géométriques utilisées en 2D [8,14].
D'autres éléments non-valvulaires importants font partie de l'évaluation quantitative d'une IM secondaire [24].
- Taille de d'OG; une dilatation massive de l'OG entraine une dilatation de l'anneau mitral; elle est un facteur de mauvais pronostic.
- Taille et fonction du VG; avec la dilatation, le VG devient plus sphérique. Cette sphéricisation est un phénomène majeur dans la distortion de l'appareil sous-valvulaire. Il existe deux manières différentes de calculer l'indice de sphéricité du VG.
- Rapport entre le diamètre du court-axe (vue transgastrique) et la longueur du long-axe (vue 2-cavités 90° ou long-axe 120°); valeur normale: < 0.7;
- Rapport entre le volume télédiastolique (méthode de Simpson) et le volume d'une sphère fictive dont le diamètre est la distance entre le plan de l'anneau mitral et l'apex du VG; valeur normale: < 0.25.
- Anomalie de la cinétique segmentaire; l'étendue de la lésion ischémique est moins importante que sa localisation dans le voisinage d'un muscle papillaire.
Les IM secondaires sont particulièrement sensibles aux conditions hémodynamiques du patient; elles fluctuent avec la précharge, la postcharge et la fonction ventriculaire dans une bien plus grande mesure que les IM structurelles. Sous anesthésie, il est donc capital de les évaluer lorsque le malade est équilibré.
La dilatation du VG peut affecter la valve mitrale de deux manière différentes, qui déternminent la prise en charge thérapeutique [14,19].
La dilatation du VG peut affecter la valve mitrale de deux manière différentes, qui déternminent la prise en charge thérapeutique [14,19].
- IM proportionnée: il existe une relation linéaire entre la surface de l'orifice de régurgitation et la dilatation du VG (écartement des muscles papillaires, dilatation et aplatissement de l'anneau mitral). L'IM, plutôt modérée, correspond au degré de dilatation ventriculaire. Elle diminue en réponse au traitement pharmacologique de la défaillance ventriculaire ou à la mise en place d'une assistance ventriculaire. Par contre, une intervention sur la valve comme une plastie d'accompagnement ne donne pas des résultats favorables [16].
- IM disproportionnée: l'IM est plus importante que ne le laisse prévoir le degré de dilatation du VG, parce que le remodelage est localisé ou la contraction des muscles papillaires désynchronisée (délais de conduction). Lorsque le QRS est élargi, l'IM tend à s'aggraver avec le traitement médical de la dilatation gauche. La resynchronisation et la plastie par MitraClip™ sont ici efficaces [20,25]. Il se peut aussi que la valve souffre d'une lésion propre qui aggrave la régurgitation indépendamment de la pathologie du VG et qui mérite d'être traitée chirurgicalement quelle que soit l'atteinte du ventricule.
| IM secondaire |
| Mécanisme: traction excessive sur les cordages en systole. Quantification: - Distance de tente IM sévère: ≥ 1.1 cm - Surface de tente IM sévère: ≥ 2.5 cm2 - Angle feuillet antérieur IM sévère: ≥ 20° - Angle feuillet postérieur IM sévère: ≥ 30° - Vena contracta IM sévère: VC > 0.4 cm - Orifice de régurgitation IM sévère: SOR > 0.2 cm2 - Volume de régurgitation IM sévère: Vrég > 30 mL IM proportionnée: plutôt modérée, elle correspond au degré de dilatation ventriculaire; plastie mitrale peu efficace. IM disproportionnée: IM plus importante que ne le laisse prévoir le degré de dilatation du VG; plastie efficace. |
Insuffisance mitrale ischémique
L’IM d’origine ischémique est la traduction d’un problème ventriculaire majeur. Lorsqu’elle est modérée ou sévère, elle double la mortalité et quadruple le risque de défaillance ventriculaire [7,11]. Elle relève de plusieurs mécanismes différents (Vidéos et Figure 26.46) [18].
- Restriction asymétrique : l’akinésie ou la dyskinésie pariétale déplace un pilier vers l’apex et vers l’extérieur en systole (61% des cas) ; ceci maintient une tension excessive sur les cordages et empêche le feuillet de rejoindre son point de coaptation. Le pilier postérieur et le feston P3 sont le plus souvent concernés. Cette IM restrictive (type IIIb) induit un jet excentrique dirigé du côté du feuillet atteint (voir Vidéo ci-dessus).
- Restriction symétrique sur cardiomyopathie dilatative d'origine ischémique.
- L’ischémie ou l’élongation du pilier (24% des cas) donne trop de course aux cordages en systole puisque le muscle papillaire ne se contracte plus. Le résultat est un prolapsus de la commissure correspondante (IM type II), avec un jet oblique dont la direction dépend du degré de bascule de chaque feuillet.
- Rupture de pilier (type II extrême); une rupture partielle entraîne un bascule de la commissure correspondante dans l'OG en systole. La rupture totale du pilier cause une IM si massive et un état de choc cardiogène si profond que 50-75% des malades décèdent avant d'atteindre la salle d'opération. La rupture concerne le pilier postérieur dans les trois quarts des cas parce que sa vascularisation uniquement par l'interventriculaire postérieure (issue de la CD ou de la CX) est plus fragile que celle du pilier antérieur, vascularisé par l'IVA et la CX (voir Figures 26.23 et 26.24).
- L’ischémie des segments basaux du VG empêche l’anneau mitral de modifier sa forme en systole (contraction majoritairement postérieure et accentuation de la forme en selle); sa surface augmente de 14-20% par dilatation de sa partie postérieure (en regard de P2) [3,4,22]. Ceci provoque une IM fonctionnelle équivalant à une dilatation de l’anneau (type I) (15% des cas); le jet est en général central.
Vidéo: insuffisance mitrale secondaire sur dilatation du VG due à une cardiomyopathie ischémique avec akinésie antéro-latérale étendue entraînant une IM légèrement asymétrique.
Vidéo: insuffisance mitrale secondaire sur dilatation du VG due à une cardiomyopathie ischémique diffuse; l'IM est symétrique.
Vidéo: insuffisance mitrale sur prolapsus de la commissure antérieure par lésion ischémique du muscle papillaire antérieur.
Vidéo: prolapsus de la commissure postérieure sur rupture ischémique partielle du muscle papillaire postérieur.
Vidéo: insuffisance mitrale massive sur rupture totale du muscle papillaire antérieur.
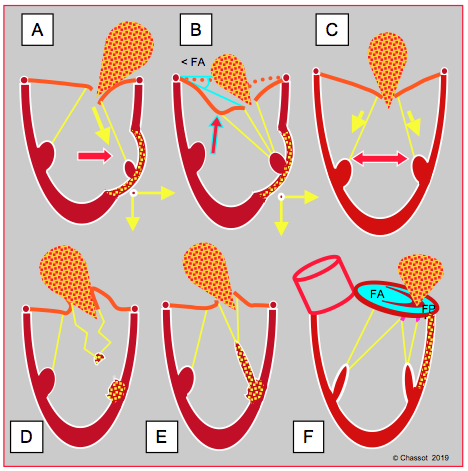
Figure 26.46 : Insuffisance mitrale ischémique. L’IM peut être de type IIIb restrictif (A, B et C), de type II prolapsus (D et E) ou de type I fonctionnel (F). A : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur et vers l’apex en systole ; le feuillet correspondant est restrictif ; l’IM est excentrique. B : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur avec une traction excessive sur les codages de 2ème ordre ; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. C : cardiomyopathie ischémique avec dilatation homogène du VG ; l’IM restrictive est centrale. D : la rupture complète d’un pilier provoque un bascule total de la commissure dans l’OG en systole ; on voit un morceau du pilier rompu oscillant au bout des cordages. E : ischémie d’un pilier occasionnant un prolapsus de la commissure correspondante parce que le pilier s’allonge au lieu de se contracter en systole. F : ischémie basale causant une dilatation postérieure de l’anneau mitral [18].
Il est important de distinguer une restriction du feuillet postérieur d’un prolapsus du feuillet antérieur, car leur traitement est très différent. Dans les deux cas, le jet de l’IM est excentrique et dirigé vers la paroi latérale et postérieure de l’OG, par-dessus le feuillet postérieur. En cas de prolapsus (IM type II), le feuillet antérieur est basculé dans l’OG en systole, alors que le feuillet postérieur se situe au plan de coaptation. Dans la restriction (IM type IIIb), le feuillet antérieur est au plan de coaptation mais le feuillet postérieur est retenu en dessous de celui-ci par traction sur les cordages en systole (voir Figure 26.45).
L’ischémie du pilier n’est pas en soi la cause principale de l’IM, et peut même la corriger. En effet, lorsque le pilier est ischémique, il s’allonge au lieu de se contracter en systole à cause de la tension sur les cordages ; ceci donne davantage de course à ces derniers, et le feuillet se rapproche du point de coaptation dont il était maintenu éloigné par l’akinésie pariétale [13]. Selon qu’elle déplace un pilier davantage vers l’extérieur ou vers l’apex, l’akinésie de la paroi induit des situations différentes (Figure 26.47) [12].
- Si l’ischémie segmentaire déplace le pilier vers l’extérieur, ce qui est fréquemment le cas pour le pilier postérieur, la tension est particulièrement grande pour les cordages de 2ème ordre du feuillet antérieur. Ceci crée une angulation dans le corps du feuillet qui prend une allure en aile de mouette (seagull sign) (voir Figure 26.44); cette déformation est la cause principale de l’IM.
- Si l’ischémie déplace le pilier vers l’apex, ce qui le plus souvent le cas pour le pilier antérieur, la traction est plus homogène sur les cordages, mais l’angle de fermeture du feuillet antérieur est plus important.
- Si l’ischémie nécrose le point d’insertion d’un ou de plusieurs cordages, le feston correspondant de la valve prolabe dans l’OG en systole (Type II).
- Une nécrose complète du pilier aboutit à sa rupture et à une IM massive, habituellement accompagnée de choc cardiogène et d’OAP ; la Vmax de l’IM est basse (< 3 m/s) à cause de la grande taille de l’orifice et de la dysfonction du VG.
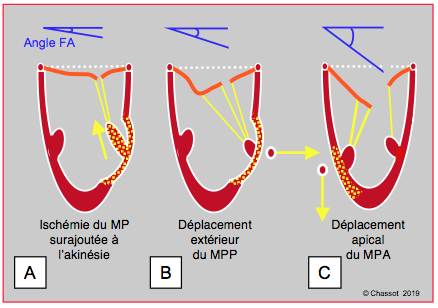
Figure 26.47 : Angle de fermeture du feuillet antérieur (FA) de la valve mitrale mesuré entre l’extrémité du FA et le plan de l’anneau mitral en systole. A : l’ischémie du pilier surajoutée à celle de la paroi donne davantage de course aux cordages et permet aux feuillets de se rapprocher de leur point de coaptation ; l’angle se referme et l’IM diminue. B: akinésie pariétale postérieure et déplacement externe du pilier postérieur ; la traction prédomine sur les cordages de 2ème ordre parce qu’elle est désaxée vers l’extérieur ; le feuillet antérieur est angulé en son centre et déformé en aile de mouette. C : akinésie pariétale antérieure et déplacement apical du pilier antérieur ; la traction prédomine dans le sens longitudinal et tire de manière homogène sur les cordages ; l’angle de fermeture est maximal. MPP: muscle papillaire postérieur. MPA: muscle papillaire antérieur.
Ces différents mécanismes de l’IM ischémique sont importants à diagnostiquer en salle d’opération, car ils modifient la technique de valvuloplastie (voir Plastie mitrale et Chapitre 11 IM ischémique). D’autre part, l’IM ischémique est un phénomène dynamique qui varie au cours du temps ; son augmentation sous stimulation sympathique est un facteur de mauvais pronostic [11]. Les critères de sévérité de l’IM ischémique sont plus restrictifs que ceux de l’IM organique, car sa présence péjore davantage le pronostic des patients. Une IM ischémique est considérée comme sévère à partir des seuils bidimensionnels suivants [6,12,28,29] :
- Largeur du jet à la vena contracta > 0.4 cm ;
- Surface de l’orifice de régurgitation ≥ 0.3 cm2 ;
- Volume régurgité ≥ 30 mL ;
- Fraction de régurgitation ≥ 30%.
| IM ischémique |
| Mécanismes - Akinésie pariétale : traction asymétrique sur des cordages (IM type IIIb) - Ischémie ou rupture partielle d’un pilier : prolapsus commissural (IM type II) - Ischémie des segments basaux : non-contraction de l’anneau (IM type I) - Rupture totale de pilier (choc cardiogène) Quantification - PISA IM sévère : r 1er aliasing ≥ 0.7 cm si Valiasing = 0.4 m/s) - Vena contracta IM sévère : diamètre ≥ 0.4 cm - Orifice de régurgitation IM sévère : S ≥ 0.3 cm2 - Volume de régurgitation IM sévère : Vrég ≥ 30 mL |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- COBEY FC, ASHIHKMINA E, EDRICH T, et al. The mechanism of mitral regurgitation influences the temporal dynamics of the vena contracta area as measured with color flow Doppler. Anesth Analg 2016; 122:321-9
- DEORSOLA L, BELLONE A. Coaptation triangle and Golden Proportion in mitral valve anatomy. Does nature play with geometry? Echocardiography 2018; 35:30-8
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- GLASSON JR, KOMEDA M, DAUGHTERS GT, et al. Three-dimensional dynamics of the canine mitral annulus during ischemic mitral regurgitation. Ann Thorac Surg 1996; 62:1059-68
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GRIGIONI F, BASMADJIAN A, ENRIQUEZ-SARANO M. Ischemic mitral regurgitation: impact on outcome and implications of quantitative measurements. Circulation 1999; 100:I-378
- GRIGIONI F, ENRIQUEZ-SARANO M, ZEHR KJ, et al. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation 2001; 103:1759-64
- JAIN P, FABBRO M. ACC Expert Consensus Decision Pathway on the management of mitral regurgitation: A review of the 2017 document fot cardiac anesthesiologist. J Cardiothorac Vasc Anesth 2019; 33:274-89
- KHABBAZ KR, MAHMOOD F, SHAKIL O, et al. Assessment of mitral annular geometry in patients with functional mitral regurgitation. Ann Thorac Surg 2013; 95:105-10
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- LANCELLOTTI P, TROISFONTAINES P, TOUSSAINT AC, et al. Prognostic importance of exercise-induced changes in mitral regurgitation in patients with chronic ischemic left ventricular dysfunction. Circulation 2003; 108:1713-7
- MAGNE J, SENECHAL M, DUMESNIL J, PIBAROT P. Ischemic mitral regurgitation: A complex multifactorial disease. Cardiology 2009; 112:244-59
- MESSAS E, GUERRERO JL, HANDSCHUMACHER MD, et al. Paradoxic decrease in ischemic mitral regurgitation with papillary muscle dysfunction. Circulation 2001; 104:1952-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11:e007028
- OBADIA JF, MESSIKA-ZEITOUN D, LEURENT G, et al, MITRA-FR investigators. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med 2018; 379:2297-306
- O'GARA PT, GRAYBURN PA, BADHWAR V, et al. 2017 ACC Expert consensus décision pathway on the management of mitral regurgitation. J Am Coll Cardiol 2017; 70:2421-49
- OURY JH, CLEVELAND JC, DURAN CG, ANGELL WW. Ischemic mitral valve disease: classification and systemic approach to management. J Card Surg 1994; 9(suppl2):262-73
- PACKER M, GRAYBURN PA. Contrasting effects of pharmacological, procedural, and surgical interventions on proportionate and disproportionate functional mitral regurgitation in chronic heart failure. Circulation 2019; 140:779-89
- PRAZ F, GRASSO C, TARAMASSO M, et al. Mitral regurgitation in heart failure: time for a rethink. Eur Heart J 2019; 40:2189-93
- RYAN L, JACKSON B, PARISH L. Quantification and localization of mitral valve tenting in ischemic mitral regurgitation using real-timew three-dimensional echocardiography. Eur J Cardiothorac Surg 2007; 31:839-4
- RYAN L, JACKSON B, PARISH L. Regional and global patterns of annular remodeling in ischemic mitral regurgitation. Ann Thorac Surg. 2007; 84:553-9
- SCHWAMMENTHAL E, CHEN C, BENNING F, et al. Dynamics of mitral regurgitant flow and orifice area. Physiologic application of the proximal flow convergence method: clinical data and experimental testing. Circulation 1994; 90:307-22
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- STONE GW, LINDENFELD J, ABRAHAM WT, et al, COAPT investigators. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med 2018; 379:2307-18
- TRICHON BH, FELKER GM, SHAW LK, et al. Relation of frequency and severity of mitral regurgitation to survival among patients with left ventricular systolic dysfunction and heart failure. Am J Cardiol 2003; 91:538-43
- WIERUP P, NIELSEN SL, EGELBLAD H, et al. The prevalence of moderate mitral regurgitation in patients undergoing CABG. Scand Cardiovasc J 2009; 43:46-9
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
- ZOGHBI WA, ENRIQUEZ-SARANO M, FOSTER E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. Eur J Echocardiogr 2003; 4:237-61
