Relaxation protodiastolique
La phase de relaxation protodiastolique est une phase active consommatrice d’O2 (mVO2 +). L'effet lusitrope positif correspond à une accélération de ce processus. En cas d’ischémie, ce phénomène est ralenti. Cette relaxation diastolique active comprend plusieurs événements [11].
- La capture active par le réticulum sarcoplasmique (RS) du Ca2+ libéré lors de l’excitation contractile (voir Figure 5.3). En cas de dysfonction diastolique, cette recapture est incomplète, d'où retard de relaxation et rigidité myocardique.
- L'effet de succion: en protodiastole, la pression intraventriculaire chute brusquement et devient momentanément inférieure à la pression intrathoracique [10]. Ce phénomène s'explique par la contraction tardive de la musculature sous-épicardique qui se prolonge pendant la protodiastole, et par la disposition de ses fibres en hélice lévogyre qui provoque une ouverture de la cavité ventriculaire lorsque le reste de la musculature est déjà relaché (voir Figure 5.30) [8].
- L’ascension de l’anneau auriculo-ventriculaire: le sang qui se trouvait dans l’OG au début de ce mouvement se retrouve dans le VG à la fin de celui-ci. Le volume ventriculaire s’est agrandi de 15% (VG) à 20% (VD) par simple coulissage de la base autour du volume sanguin sans que celui-ci ne se soit lui-même déplacé (voir Figure 5.32).
- Effet lusitrope positif: les anticalciques (↓ concentration de Ca2+ libre), les inhibiteurs de la phosphodiestérase-3 (↑ activité de l'AMPc) et les catécholamines (↑ recapture du Ca2+) accélèrent la relaxation diastolique [11].
- Effet lusitrope négatif: la relaxation est ralentie par la digitale, les halogénés, l'ischémie et l'insuffisance systolique [3,7].
A ces phénomènes se joignent d’autres éléments qui ne participent pas à la mVO2 parce qu’ils sont énergétiquement passifs.
- L'élasticité de la connectine (elastic recoil): lors de la contraction, la structure élastique de cette molécule géante est comprimée comme un ressort au sein du myofibrille; elle se détend en début de diastole et amorce le remplissage [4]; plus la contraction a été puissante (Vts bas, FE élevée), plus cet effet est important (voir Figure 5.13).
- L'élasticité propre du myocarde: plus il est souple et compliant, plus la relaxation est rapide. Lors d'hypertrophie ventriculaire ou en cas de tissu fibreux abondant (nouveau-né, cicatrice d'infarctus, par exemple), cette phase est ralentie. Chez l’adulte, le 60% du myocarde est constitué de myocytes, mais cette proportion tombe à 40% chez le vieillard et 30% chez le nouveau-né; ce qui signifie que, respectivement, 40%, 60% et 70% du myocarde sont constitués de fibrocytes non compliants.
- L'homogénéité géométrique: les zones akinétiques (ischémie, infarctus) ou dyskinétiques (anévrysme ventriculaire) ne participent pas au remplissage proto-diastolique ou le contrecarrent. Un bloc de branche ou un entraînement électrosystolique (pace-maker) désordonnent la relaxation [4].
- Le gradient de pression auriculo-ventriculaire: bien que n'étant pas en soi-même un facteur de relaxation, la pression de remplissage de l'oreillette (↓ par hypovolémie, ↑ par haut débit veineux) est déterminante pour la vitesse du flux diastolique et pour le volume transvasé entre les deux cavités.
La vitesse de relaxation du VG se mesure par la constante de temps τ (tau) de la relaxation calculée entre la valeur maximale du – dP/dt et une valeur arbitraire de 5 mmHg à la fin de la phase de relaxation isovolumétrique : P(t) = P • e-t/tau (Figure 5.77) [6]. Elle est accélérée par les substances lusitropes positives, la stimulation sympathique et la tachycardie; elle est diminuée par effet lusitrope négatif (valeur normale < 45 ms).
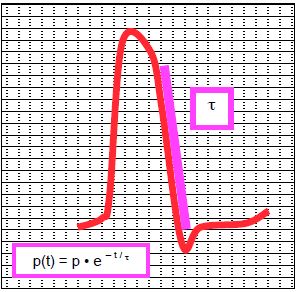
Figure 5.77 : Constante de temps de relaxation τ (tau). C'est une valeur mesurant la vitesse de la baisse de pression dans le VG pendant la relaxation isovolumétrique (- dP/dt) [d’après réf 6].
Chez l’individu normal (jusqu’à environ 50 ans), le remplissage ventriculaire protodiastolique est assuré par l’aspiration active du sang par le VG et non par le gradient de pression entre l’OG et le VG. Comme l’exercice physique a un effet lusitrope positif, la relaxation est améliorée, et la pression de l’OG ne monte pas à l’effort malgré l’augmentation du débit cardiaque. Avec l’âge et l’HVG, toutefois, la relaxation devient de moins en moins efficace et le remplissage dépend de plus en plus du gradient de pression OG – VG ; dans ces conditions, la POG s’élève avec l’effort.
Elasticité et distensibilité
L’élasticité et la distensibilité méso-télédiastoliques, réunies sous le terme de compliance, sont des phénomènes essentiellement passifs, dans lesquels interviennent plusieurs éléments [4,12].
- Dimensions ventriculaires: la courbe de compliance étant curvilinéaire, la distensibilité physiologique baisse lorsque le volume diastolique augmente; un ventricule dilaté opère sur la portion verticalisée de la courbe.
- Souplesse de la paroi: la rigidité myocardique représente la résistance du muscle cardiaque à la distension lorsqu'on l'étire; on parle de visco-élasticité lorsque cette résistance est fonction du degré et de la vitesse d'étirement. Les infiltrations (fibrose cicatricielle, collagène, amyloïdose) et l'oedème interstitiel (post-CEC, choc anaphylactique, anasarque, crise de rejet d'un transplant) diminuent la souplesse de la paroi ventriculaire. Une augmentation d'épaisseur de la paroi (hypertension artérielle, HVG, par exemple) en diminue l’élasticité et la distensibilité.
- Rapport myocytes / fibrocytes: la compliance baisse lorsque la proportion de tissu fibreux est très élevée (≥ 60%) comme chez le nouveau-né ou le vieillard.
- Température: le refroidissement profond de la cardioplégie en CEC diminue la souplesse du myocarde.
- Contraction auriculaire: ce facteur, accompagné d’une seconde ascension de l’anneau mitral agrandissant longitudinalement la cavité du VG, est capital pour assurer une pression télédiastolique suffisante. Toutefois, lorsque la distensibilité est très altérée, l’oreillette n’a pas la puissance nécessaire pour propulser suffisamment de sang contre la résistance élevée du myocarde ; sa contribution au remplissage devient faible. Il en est de même lorsqu'elle est très dilatée et que se force propulsive diminue.
La compliance de la cavité est la variation de volume en fonction de la pression (dV/dP), alors que sa rigidité est le rapport inverse : dP/dV, ou variation de pression par unité de volume. Les altérations de l’élasticité et de la distensibilité se traduisent par une baisse de la compliance et par un redressement de sa courbe. La silhouette de la courbe de pression intraventriculaire varie selon le type de pathologie diastolique (Figure 5.78) [12].
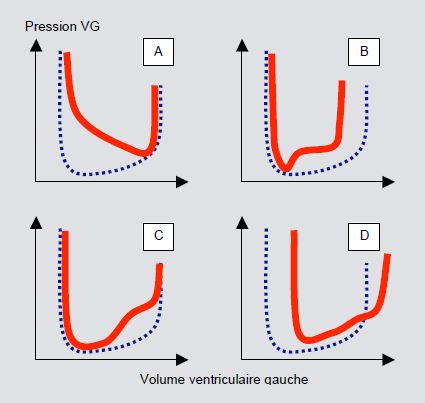
Figure 5.78 : Courbes Pression – Volume du ventricule gauche dans différentes situations de dysfonction diastolique. A: Défaut de relaxation (protodiastolique). B: Restriction péricardique (dip-and-plateau). C: Défaut de distensibilité (télédiastolique). D: Dilatation ventriculaire. Traitillé bleu: courbe normale; trait rouge: courbe pathologique [d'après réf 12].
Fréquence cardiaque
La tachycardie réduit le temps à disposition pour le remplissage ventriculaire pendant la diastole. Le diastasis (phase 3) disparaît et la vélocité du flux protodiastolique (phase 2) diminue ; la composante E du flux auriculo-ventriculaire (phase 2) fusionne progressivement avec la composante A de la contraction auriculaire (phase 4). Il ne subsiste alors plus qu’une seule composante télédiastolique parce que l’oreillette n’a pas le temps d’être remplie avant la fin de la diastole. Comme le remplissage devient davantage dépendant de la contraction auriculaire, la tachycardie est moins bien supportée lorsque le rythme cardiaque n’est pas sinusal.
En cas de dysfonction diastolique (ventricule peu compliant), la tachycardie diminue davantage le volume systolique parce que le manque de souplesse du ventricule réclame une longue diastole et une pression élevée pour atteindre un volume télédiastolique suffisant [1]. La bradycardie allonge le diastasis et augmente le volume télédiastolique. Elle est dangereuse en cas de dysfonction du VG ou d’insuffisance aortique car elle conduit à une dilatation ventriculaire.
Facteurs extrinsèques
Toute une série de facteurs non-myocardiques interfèrent avec la fonction diastolique des ventricules. Citons parmi eux:
- Le péricarde est inextensible; il assure une contention externe lorsque le volume cardiaque augmente; il provoque une inflexion brusque et une pente quasi-verticale de la courbe pression-volume. La présence d'un épanchement ou d’une péricardite constrictive restreint l'expansion diastolique et interrompt le remplissage en cours de diastole (Figure 16.2) [4].
- Interdépendance ventriculaire: les deux ventricules partagent le même septum; en cas de surcharge droite, la distension du VD empiète sur le volume diastolique du VG, car le septum est déplacé vers la gauche (effet Bernheim). L'inverse est aussi possible en cas de dilatation gauche; l'insuffisance d'un ventricule entraîne donc un défaut de remplissage de l'autre [2].
- Compression extrapéricardique: tumeurs ou épanchements thoraciques peuvent limiter l'expansion ventriculaire diastolique; une pression intrathoracique élevée a le même effet (Valsalva, PEEP).
- Une surcharge aiguë de volume ou de pression prolonge la contraction ventriculaire ; elle retarde et raccourcit la relaxation.
- Réseau coronaire: lorsqu'il est mis sous tension par une pression artérielle diastolique élevée, l'arbre coronaire extra- et intra-myocardique se comporte comme un squelette rigide qui diminue l'élasticité de paroi (effet tuyau d'arrosage ou effet Gregg) [5].
- Une insuffisance ventriculaire droite provoque une hypertension auriculaire droite et un engorgement du sinus coronaire; cette hypertension veineuse conduit à une diminution de la distensibilité des deux ventricules [9]. L'élévation chronique de la PVC freine le drainage lymphatique cardiaque; la stase veineuse et lymphatique contribue à la formation d'oedème interstitiel.
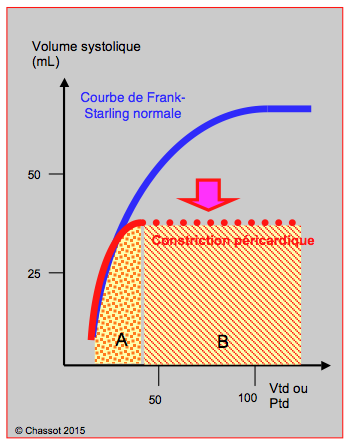
Figure 16.2: Courbe de Frank-Starling. Comparée à la courbe normale (bleue), celle d’une constriction péricardique (rouge) est abaissée et comprimée, avec une pente normale ; elle ressemble à celle d’une hypovolémie, mais s’arrête brusquement lorsque le volume maximal est atteint, ce qui correspond aux 40-50% du volume télédiastolique (Vtd) normal. Les variations de remplissage diastolique ont un effet marqué sur le volume systolique et le débit cardiaque jusqu’à ce point maximal (genou de la courbe), mais n’en n’ont plus au-delà. Si l’on remplace l’échelle de volume par une échelle de pression (Ptd), la courbe prend une forme aplatie (en pointillé), illustrant le fait que l’augmentation du remplissage conduit à une augmentation de la pression télédiastolique mais ne se traduit plus par une augmentation de la performance systolique. Cette courbe délimite une zone A (en pointillé) dans laquelle les variations de précharge se traduisent par d’importantes variations du volume systolique et de la pression artérielle (hypovolémie), et une zone B dans laquelle les variations de la pression artérielle sont absentes lors des variations ventilatoires de la précharge.
| Déterminants de la fonction diastolique |
|
La relaxation protodiastolique est un processus actif de succion qui consomme 15% de la mVO2 totale; elle comprend différents éléments.
- Succion active par la contraction de la musculature sous-épicardique
- Déploiement de la connectine (elastic recoil);
- Recapture du Ca2+ par le réticulum sarcoplasmique
- Ascention de l'anneau mitral
- Elasticité de la paroi (proportion myocytes/fibrocytes, cicatrices, akinésies)
- Homogénéité de la paroi (bloc de branche, pace-maker)
- Effet lusitrope positif (anti-PDE3, catécholamines) ou négatif (digitale)
- Gradient de pression OG → VG
L’élasticité et la distensibilité méso-télédiastoliques, ou compliance, représentent la capacité du ventricule à augmenter passivement de volume sous l'effet du remplissage; elles dépendent de: - Dimension et épaisseur de paroi du ventricule
- Souplesse de la paroi (diminuée par cicatrices, infiltrations, œdème, hypothermie)
- Rapport myocytes/fibrocytes
- Contraction auriculaire
Des facteurs extrinsèques modifient la performance diastolique: restriction péricardique, interdépendance ventriculaire, compression extra-cardiaque, surpression dans les coronaires (HTA) ou dans le sinus coronaire (POD élevée). La tachycardie raccourcit principalement le diastasis; le flux protodiastolique E vient progressivement fusionner avec le flux A de la contraction auriculaire; le flux mitral présente une seule composante télédiastolique. En cas d'insuffisance diastolique le débit est étroitement dépendant de la normocardie; il baisse lors de tachycardie, de bradycardie et de rythme non-sinusal.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- BRUTSAERT DL, SYS SU. Relaxation and diastole of the heart. Physiol Rev 1989; 69:1228-1315
- FENELEY MP, OLSEN CO, GLOWER DD, et al. Effect of acutely increased right ventricular afterload on work output of the left ventricle in conscious dog. Circ Res 1989; 65:135-145
- GEKIERE JP, VALAT P, GOSSE P, KABBANI Y, JANVIER G. Fonction diastolique ventriculaire gauche: physiologie, physiopathologie, évaluation, moyens thérapeutiques, incidence en anesthésie. Ann Fr Anesth Réanim 1998; 17:319-39
- GILBERT JC, GLANTZ SA. Determinants of left ventricular filling and of diastolic pressure-volume relation. Circ Res 1989; 64:827-32
- GREGG DE. Effect of coronary perfusion pressure or coronary flow on oxygen usage of the myocardium. Circ Res 1963; 13:497-500
- NISHIMURA RA, HOUSMANS PR, HATLE LK, TAJIK AJ. Assessment of diastolic function of the heart: Background and current application of Doppler echocardiography. Part I: physiologic and pathophysiologic features. Mayo Clin Proc 1989; 64:71-81
- PAGEL PS, GROSSMANN W, HAERING M, WARLTIER DC. Left ventricular diastolic function in the normal and diseaesed heart. Anesthesiology 1993; 79:836-54 (Part I) et 79:1104-20 (Part II)
- TORRENT-GUASP F, KOCICA MJ, CORNO A, et al. Systolic ventricular filling. Eur J Cardiothor Surg 2004; 25:376-86
- WATANABE J, LEVINE MJ, BELLOTTO F, et al. Effects of coronary venous pressure on left ventricular distensibility. Circ Res 1990; 67:923
- YELLIN EL, HORI M, YORAN C, et al. Left ventricular relaxation in the filling and non-filling intact canine heart. Am J Physiol 1986; 250:H620-H629
- ZILE MR, BRUTSAERT DL. New concept in diastolic dysfunction and diastolic heart failure: Part I. Diagnosis, prognosis, and measurement of diastolic function. Circulation 2002; 105:1387-93
- ZILE MR, SMITH VE. Relaxation and diastolic properties of the heart. In: FROZZARD H.A, ed. The heart and cardiovascular system, Scientific Foundations, 2nd edition. New York, Raven Press, 1991, pp 1353-1367
