Les halogénés sont très utilisés en CEC, mais leur cinétique est sensiblement modifiée dans cette situation. La vitesse d'augmentation de la concentration du gaz est plus faible en CEC hypothermique à cause de l'augmentation de solubilité à froid; par contre, l'extraction du gaz est aussi rapide que dans les conditions standards. Pour le desflurane, par exemple, on atteint la moitié de la concentration inspirée (6%) en 5 minutes, puis un plafonnement à 68% après 32 minutes [12]. Pour le clinicien, cela signifie qu'on n'atteint pas les concentrations habituelles de gaz lors d'une CEC hypothermique. Pour obtenir l'effet désiré, il faut donc augmenter la concentration inspirée et prendre davantage de temps. On doit attendre en moyenne 5 - 10 minutes pour réaliser le plein effet hémodynamique de l'halogéné. Si l'halogéné est l'agent d'anesthésie utilisé avant la CEC, sa concentration va baisser au moment du départ en pompe et du refroidissement; il faut donc augmenter sa concentration sur l'oxygénateur par rapport à celle de l'appareil d'anesthésie. A cela s'ajoute l'effet de l'hémodilution, qui diminue la solubilité des halogénés mais augmente leur volume de répartition. Heureusement, les besoins de l'organisme diminuent avec le froid. Ainsi la MAC de l'isoflurane baisse de 5% par degré de température jusqu'à 20° [1]. Etant liposolubles, les halogénés sont aussi absorbés dans les plastiques et les oxygénateurs; certains modèles ont une capacité pour l'isoflurane équivalente à 17 litres de sang [16]. L'administration d'halogénés dans le circuit de CEC pose plusieurs problèmes, parce que les fabriquants n'ont jusqu'ici jamais intégré de vaporisateur dans leurs machines [3].
- Le type d'oxygénateur a son importance. Les oxygénateurs à membrane de polypropylène microporeux, les plus couramment utilisés, absorbent partiellement les halogénés mais la diffusion de ces derniers n'est pas entravée. Les oxygénateurs à membrane de polyméthylpentène, au contraire, bloquent le passage des halogénés; ils sont principalement utilisés dans les circuits de longue durée comme l'ECMO, mais rarement en salle d'opération [17].
- Sous leur forme liquide, les halogénés endommagent considérablement les plastiques de la CEC. Le vaporisateur doit donc toujours être placé en contre-bas de la machine.
- Pour éviter de polluer la salle d'opération, les halogénés doivent être évacués à partir de l'orifice de sortie des gaz de l'oxygénateur. C'est à ce niveau que l'on devrait mesurer leur fraction expirée (Fe), qui est étroitement corrélée à la MAC réelle reçue par le patient alors que la fraction inspirée (Fi) affichée sur le vaporisateur l'est beaucoup moins; mais cette mesure n'est pas routinière et présente quelques difficultés techniques.
- La tolérance vis-à-vis du montage artisanal d'un vaporisateur sur la machine de CEC varie selon les pays. Alors que ce montage est bien accepté en Amérique du Nord, l'attitude est plus restrictive dans l'Union Européenne, dont une directive soumet toute modification ou ajout au circuit de CEC à une approbation officielle qui en certifie la sécurité.
Si l'on recherche une concentration prédéterminée d'un agent intraveineux par perfusion continue (TCI: target concentration infusion), on voit que l'hémodilution, l'augmentation du volume de distribution, la baisse de clairance et la séquestration dans l'appareillage de CEC et les poumons réduisent l'effet escompté par rapport à la dose administrée. La demi-vie d'élimination est allongée. Pour le propofol, la variation de concentration est de 10-20% [5]. Pour le midazolam et le sufentanil, les concentrations obtenues sont respectivement 13% et 42% inférieures aux concentrations calculées [4]. La demi-vie du midazolam après CEC est significativement allongée [11]. Le lieu d'injection a son importance; pour un traceur injecté en voie centrale, il faut 5 minutes pour que la moitié de la dose apparaisse dans la voie artérielle. Si l'on injecte directement dans l'entrée de l'oxygénateur, le 95% de la dose est distribué en un seul temps circulatoire.
Pour les opiacés, on assiste à une brusque mais brève réduction des concentrations circulantes en début de CEC (fentanyl 53%, sufentanil 34%), suivie d'une rééquilibration des taux par redistribution depuis les tissus [6,8,14]. L'adsorption d'opiacés par les circuits de CEC ne contribue qu'à la chute initiale, mais est sans autre portée clinique. Elle est proportionnelle à la liposolubilité des agents: sufentanil > fentanyl > alfentanil > remifentanil [15]. Les concentrations augmentent au moment du déclampage et de la reperfusion pulmonaire, car les poumons non-perfusés, qui avaient séquestré les fentanils, les relarguent au moment de la recirculation. La demi-vie d'élimination est allongée de 25% après CEC, parce que le volume de distribution total est agrandi et la clairance diminuée (Figure 7.31).
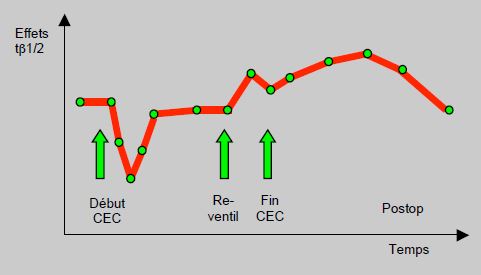
Figure 7.31 : Représentation schématique des variations du taux plasmatique d'un fentanil en cours de CEC [4].
L'hypothermie affecte l'affinité et la fixation des curares sur la plaque neuro-musculaire et diminue la clairance hépatique du vecuronium. Il en résulte une réduction de plus de 80% de la vitesse de perfusion nécessaire pour maintenir le bloc en CEC hypothermique, une fois passé l'épisode de dilution initiale [18]. Les estérases plasmatiques sont diluées en CEC et partiellement inhibées par le froid. La clearance de l'atracurium, du cisatracurium, du mivacurium, de l'esmolol et du remifentanil, tous métabolisés par les estérases plasmatiques, est donc significativement abaissée. Pour l'atracurium, la réaction d'Hoffman est diminuée de 43% à 28° [9]. Les rhodanases hépatiques responsables de la biotransformation du nitroprussiate ont une activité si faible que le risque d'intoxication au thiocyanate est élevé [13]. La dose de xylocaïne administrée pendant la CEC doit être augmentée de 1.5 à 2.5 mg/kg pour assurer les taux thérapeutiques habituels [10]. Une chute de concentration de 36% est enregistrée pour la nitroglycérine pendant la CEC à cause de la captation importante du produit par les circuits [7]. La fixation de la milrinone sur le circuit de CEC est de 20% [2].
| Pharmacologie en CEC |
|
A cause de l’hémodilution et des variations de température, la CEC a une influence majeure sur la pharmacocinétique des agents d’anesthésie. Ces effets sont variables selon les substances et la température; la traduction clinique est la résultante des diverses modifications.
- ↓ brusque concentration en début de CEC (risque de réveil et de décurarisation)
- ↑ volume de distribution
- ↓ concentration par séquestration (poumons, circuits de CEC)
- ↑ concentration effective et ↑ durée d’action par: ↓ clairance, ↓ biotransformation ↓ activité des estérases, ↓ affinité pour les récepteurs
Prise en charge anesthésique:
- Agents intraveineux: ↑ dosage
- Opiacés: ↑ dosage en début de CEC, ↓ dosage en hypothermie et post-reventilation
- Halogénés: ↑ Fi à cause de l’augmentation de solubilité, mais ↓ MAC en hypothermie
- Curares: ↑ effet et durée par ↓ affinité pour les récepteurs, risque de décurarisation en
début de CEC
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- ANTOGNINI J. Hypothermia eliminates isoflurane requirements at 20 degrees celsius. Anesthesiology 1993; 78:1152-7
- BAILEY JM, LEVY JH, KIKURA M. Pharmacokinetics of intravenous milrinone in patients undergoing cardiac surgery. Anesthesiology 1994; 81:616-22
- BARRY AE, CHANEY MA, LONDON MJ. Anesthetic management during cardiopulmonary bypass: a systematic review. Anesth Analg 2015; 120:749-69
- BARVAIS L, HEITZ D, SCHMARTZ D, et al. Pharmacokinetic model-driven infusion of sufentanil and midazolam during cardiac surgery: Assessment of the prospective predictive accuracy and the quality of anesthesia. J Cardiothorac Vasc Anesth 2000; 14:402-8
- BARVAIS L, RAUSIN I, GLEN JB, et al. Administration of propofol by target-controlled infusion in patients undergoing coronary artery surgery. J Cardiothorac vasc Anesth 1996; 10:877-83
- BOVILL J, SEBEL P. Pharmacokinetics of high-dose fentanyl: A study in patients unergoing cardiac surgery. Br J Anaesth 1980; 52:795-9
- DASTA J, JACOBI J, WU LS. Loss of nitroglycerin to cardiopulmonary bypass apparatus. Crit Care Med 1983; 11:50-2
- FLEZZANI P, ALVIS J, JACOBS J. Sufentanil disposition during cardiopulmonary bypass. Can J Anaesth 1987; 34:566-72
- FLYNN P, HUGHES R, WALTON B. Use of atracurium in cardiac surgery involving cardiopulmonary bypass with induced hypothermia. Br J Anaesth 1984; 56:967-82
- LANDOW L, WILSON J. An improved lidocaine infusion protocol for cardiac surgical patients. J Cardiothorac Vasc Anesth 1991; 5:209-13
- MAITRE P, FUNK B, CREVOISIER C, et al. Pharmacokinetics of midazolam in patients recovering from cardiac surgery. Eur J Clin Pharmacol 1989; 37:161-6
- METZ B, REICH NT, MELLAS N, et al. Desflurane pharmacokinetics during cardiopulmonary bypass. J Cardiothorac vasc Anesth 2001; 15:179-82
- MOORE RA, GELLER EA, GALLAGHER JD, et al. Effect of hypothermic cardiopulmonary bypass on nitroprusside metabolism. Clin Pharmacol Ther 1985; 37:680-3
- RIDDINGTON DW, VENKATESH B, BOIVIN CM, et al. Intestinal permeability, gastric intramucosal pH, and systemic endotoxemia in patients undergoing cardiopulmonary bypass. JAMA 1996; 275:1007-12
- ROSEN D, ROSEN K. Elimination of drugs and toxins during cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1997; 11:337-40
- STERN R, WEISS C, STEINBACH J, et al. Isoflurane uptake and elimination are delayed by absorption of anesthetic by the Scimed membrane oxygenator. Anesth Analg 1989; 69:657-62
- WIESENACK C, WIESNER G, KEYL C, et al. In-vivo uptake and elimination of isoflurane by different membrane oxygenators during cardiopulmonary bypass. Anesthesiology 2002; 97:133-8
- WITHINGTON D, MENARD G, HARRIS J, et al. Vecuronium pharmacokinetics and pharmacodynamics during hypothermic cardiopulmonary bypass in infants and children. Can J Anaesth 2000; 47:1188-95
