Anesthésie en cas de CMH
Comme tout ce qui diminue la taille du VG et augmente le gradient trans-aortique est néfaste, les recommandations en cas de cardiomyopathie hypertrophique (CMH) portent sur trois points essentiels [6].
- Contractilité basse: freiner la stimulation sympathique avec une anesthésie profonde et un β-blocage intraveineux peropératoire si nécessaire (esmolol, metoprolol, bisoprolol) ;
- Précharge élevée: remplissage vasculaire adéquat, normovolémie maintenue, pas de dérivés nitrés en cas d'hypertension ;
- Postcharge élevée: agents vasoconstricteurs α en cas d'hypotension (phényléphrine, nor-adrénaline).
En résumé, le patient doit être: plein - mou - fermé. Par ailleurs, la présence d'une dysfonction diastolique rend le débit systolique très dépendant de la contraction auriculaire; il est donc important de conserver un rythme sinusal [8]. Ces patients sont susceptibles de développer une tachyarythmie ventriculaire à tout instant. Il faut y être préparé (xylocaïne et amiodarone à disposition immédiate), notamment en fixant des plaques de défibrillateur dès l'induction [1].
Les symptômes de la maladie étant peu spécifiques en dehors des syncopes, notamment à l'effort, la CMH est facilement sous-diagnostiquée. L'anesthésiste doit donc rester attentif à cette possibilité lors d'instabilité hémodynamique peropératoire. Chez les patients connus pour souffrir de CMH, le traitement médical (β-bloqueur, anticalcique, disopyramide) doit être maintenu en préopératoire, y compris à la prémédication; à noter que le disopyramide (Rythmodan©) possède un effet vasoconstricteur artériel. Une bonne hydratation doit être assurée. Aucune antibiothérapie n'est recommandée en-dehors de celle prescrite spécifiquement pour l'intervention [4,7]. En cours d'intervention non-cardiaque, près de 60% des cas présentent des épisodes d'instabilité hémodynamique [1]; la mortalité opératoire est de 4-5% plus élevée que celle des patients ne souffrant pas de la maladie [9].
Le retrait du fluothane du marché européen a supprimé l'agent idéal pour l'anesthésie du patient souffrant de CMH. La technique recommandée actuellement consiste en une induction par de l'étomidate ou du propofol (mais ce dernier baisse la précharge et la postcharge), et un maintien par du sevoflurane et du fentanyl/sufentanil [14]. L'isoflurane cause trop de vasodilatation artérielle, et le desflurane est responsable d'une stimulation sympathique. Le pentothal altère les baroréflexes et provoque une tachycardie. La kétamine est contre-indiquée à cause de la stimulation sympathique centrale. Les béta-stimulants et les anticholinergiques sont à éviter [10]. Si une anesthésie loco-régionale rachidienne est requise, il faut préférer la péridurale à la rachianesthésie et contrecarrer le bloc sympathique par du volume et des α-stimulants ; l'installation du bloc doit être très lente [10]. La profonde baisse de précharge et de postcharge de la rachianesthésie est une contre-indication à cette technique [2]. Une hypertension peropératoire est traitée préférentiellement par un approfondissement de l'anesthésie/analgésie et des bolus ou une perfusion de β-bloquant (l’esmolol est l'agent le plus manipulable). Une hypotension artérielle réclame une réaction immédiate (remplissage, vasoconstricteur), car elle peut déclencher une crise obstructive de la CCVG; l'usage d'agents inotropes est contre-indiqué.
Le monitorage en continu de la pression artérielle par une canulation de l'artère fémorale ou radiale est essentiel en peropératoire. En amplifiant correctement l'image de la courbe sur l'écran du moniteur, on obtient des informations instantanées sur la contractilité (pente ascendante de la courbe), le volume systolique (surface sous la courbe en systole) et l'éventuelle subocclusion de la chambre de chasse (inflexion sur la partie ascendante de la courbe, voir Figure 13.12A). Ni la PVC ni la PAPO ne sont des indices fiables de remplissage; la voie centrale est indiquée en fonction de la gravité du cas pour l'administration des substances à visée hémodynamique (béta-bloqueur, vasoconstricteur, etc). Le cathéter pulmonaire n'est pas utile pour diagnostiquer l'effet obstructif sur la CCVG. La possibilité de surveiller le ventricule gauche (volume, contractilité), la position systolique du feuillet mitral antérieur et la vélocité à travers la chambre de chasse fait de l'ETO le monitorage idéal pour ce type de pathologie dynamique. Les critères de diagnostic échocardiographiques sont illustrés dans les Figures 13.12A, 13.12B et 13.13.
- Rétrécissement musculaire de la CCVG en 2D.
- Apparition d'un SAM (systolic anterior motion): le feuillet antérieur de la valve mitrale vient en contact avec le septum interventriculaire en méso-systole et occlut partiellement la chambre de chasse du VG (CCVG).
- Vélocité maximale du flux dans la CCVG > 2.5 m/s.
- Aspect du flux aortique en dague.
- Collapsus mésosystolique des feuillets de la valve aortique (mode TM).
- Insuffisance mitrale méso-télésystolique (IM degré II-III).
Des phénomènes différents de la CMH peuvent entraîner la même subocclusion dynamique de la CCVG [3,5,11,12,14].
- Présence d'une crête ou d'une membrane fixe sur le septum créant une sténose sous-aortique mécanique.
- Excès de tissu dans le feuillet antérieur de la mitrale (maladie de Barlow).
- Malposition et hypertrophie du pilier antéro-latéral.
- Après un infarctus myocardique antérieur, la contraction hyperdynamique des segments adjacents de la base peut créer une obstruction à l'éjection du ventricule.
- Après remplacement de la valve aortique pour sténose, la levée de l'obstacle diminue tellement la postcharge du VG hypertrophique que la CCVG peut facilement collaber lorsque le patient devient hypovolémique et qu'il est sous une stimulation β.
- Après une plastie mitrale avec mise en place d'un anneau, la zone d'affrontement des deux feuillets de la valve mitrale peut être considérablement déplacée vers l'avant, aboutissant à un chevauchement de la chambre de chasse et de la chambre d'admission du VG.
- La conservation de l'appareil sous-valvulaire dans le remplacement valvulaire mitral peut également conduire à un effet obstructif si la chambre de chasse est très charnue.
Lorsque survient une obstruction dynamique de la chambre de chasse après plastie mitrale, une hypervolémie et une adaptation pharmacologique (β-bloqueur, α-stimulant, anti-calcique) suffisent à régler le problème dans la grande majorité des patients [17]. Seuls 5% des cas nécessitent un retour en pompe pour traitement chirurgical.
Anesthésie pour cure chirurgicale de CMH
La chirurgie reste le traitement préférentiel, malgré les succès de l'ablation percutanée par alcoolisation [4,7]. Elle est indiquée chez les patients symptomatiques réfractaires au traitement médical qui ont un gradient > 30 mmHg au repos dans la chambre de chasse, ou > 50 mmHg à la provocation. Elle consiste à réséquer en CEC une tranche longitudinale de myocarde dans le septum interventriculaire par voie transaortique. On y associe une plicature horizontale du feuillet antérieur de la mitrale (FAM) destinée à le raccourcir (voie transauriculaire gauche), et un ajustement de l'appareil sous-valvulaire mitral de manière à empêcher le basculement du FAM dans la chambre de chasse en systole (Figure 13.14) [16]. Certains centres utilisent un MitraClip™ pour éloigner la coaptation mitrale de la chambre de chasse [15]. La mortalité chirurgicale est ≤ 0.6% [13].
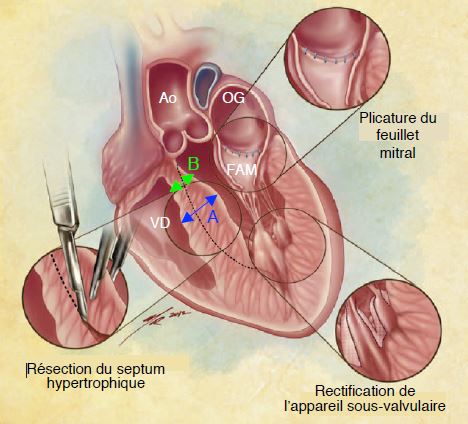
Figure 13.14: L'intervention chirurgicale pour cardiomyopathie hypertrophique symptomatique comprend trois éléments: 1) myectomie longitudinale du septum interventriculaire, 2) plicature horizontale du feuillet antérieur de la mitrale (FAM) pour le raccourcir, et 3) rectification de l'appareil sous-valvulaire de la valve mitrale pour prévenir le basculement du FAM dans la chambre de chasse. Avant la CEC, l'échocardiographie transoesophagienne peropératoire doit déterminer l'épaisseur du septum en deux points: dans le corps du septum à son épaisseur maximale (A, en bleu) et dans la zone sous-aortique où il est le plus mince (B, en vert). Cette deuxième mesure est capitale pour le chirurgien afin d'éviter une résection trop profonde qui ferait courir le risque d'une CIV iatrogène; il est également important de lui indiquer la distance entre l'anneau aortique et le bombement maximal [D'après: Swistel DG & Balaram SK. Surgical myectomy for hypertrophic cardiomyopathy in the 21th century, the evolution of the "RPR" repair: resection, plication, and release. Progr Cardiovasc Dis 2012; 54:498-502 ].
L'ETO peropératoire joue un rôle essentiel dans l'intervention: évaluation de la fonction systolique et diastolique, du déplacement du feuillet mitral antérieur dans la CCVG et de l'IM, mesure de la Vmax dans la chambre de chasse et calcul du gradient de pression, observation du collapsus méso-systolique des feuillets de la valve aortique. Une mesure précise de l'épaisseur du septum interventriculaire est capitale pour le chirurgien, car il doit savoir jusqu'à quelle profondeur il peut réséquer le myocarde sans courir le risque de provoquer accidentellement une perforation dans le VD et une CIV. Pour ce faire, on procède à deux mesures différentes (voir Figure 13.14 ci-dessus).
- Epaisseur maximale en vues mi-oesophagiennes 4-cavités, 2-cavités et long-axe, et en vue transgastrique court-axe; cette mesure peut être répétées à différents niveaux si le septum est inhomogène;
- Epaisseur au niveau sous-aortique en vue long-axe (110-140°), là où le septum est moins épais.
Pour la reconstruction de l'appareil mitral, il est important de mesurer la distance entre le point de coaptation de la valve et le septum (C-sept), le rapport des longueurs du feuillet antérieur et du feuillet postérieur, ainsi que la position des piliers et la longueur des cordages.
Les deux complications les plus fréquentes sont le bloc AV complet nécessitant un pacemaker définitif (1-3%) et la CIV obligeant à un retour en pompe (≤ 1%) [10]. Après la correction, l'ETO est nécessaire pour contrôler la disparition du gradient de pression sous-aortique, au besoin avec un test de provocation à l'isoprénaline (1 mcg/kg/min ou bolus 10 mcg); la persistance d'un gradient ≥ 20 mmHg ou d'un SAM impose une révision. L'ETO permet aussi de s'assurer de l'absence de CIV iatrogène et d'insuffisance aortique secondaire à la déstabilisation du soutien de la valve aortique par une résection trop haute dans la chambre de chasse [8].
| Anesthésie en cas de CMH |
|
L'anesthésie est déterminée par les contraintes hémodynamiques :
- Contractilité basse (arrêt des catécholamines β et/ou β-bloqueur)
- Précharge élevée (remplissage, hydratation)
- Postcharge élevée (vasoconstricteur)
- Maintien du rythme sinusal
- « Plein – mou – fermé »
Technique proposée:
- Induction: etomidate (sûr), propofol (attention à la chute de précharge)
- Fentanyl, sufentanil
- Maintien: sevoflurane, propofol, midazolam
- Cathéter artériel, voie centrale (Swan-Ganz peu utile)
- ETO essentiel
- Patches de défibrillateur en place
|
© CHASSOT PG Septembre 2007 Dernière mise à jour Octobre 2018
Références
- CHENG TO. Cardiac risk of noncardiac surgery in patients with hypertrophic cardiomyopathy. Int J Cardiol 2008; 129:307-8
- DAVIES MR, COUSINS J. Cardiomyopathy and anaesthesia. Contin Educ Anaesth Crit Care Pain 2009; 9:189-93
- DECANNIERE D, JANSENS JL, UNGER P, LLECLERC JL. Left ventricular outflow tract obstruction after mitral valve replacement. Ann Thorac Surg 1997; 64:1805-6
- ELLIOTT PM, ANASTASAKIS A, BORGER MA, et al. 2014 ESC guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology. Eur Heart J 2014; 35:2733-79
- ERIKSSON H, MIDGLEY FM, KARR SS, et al. Role of echocardiography in the diagnosis and surgical management of accessory mitral valve tissue causing left ventricular outflow tract obstruction. J Am Soc Echocardiogr 1995; 8:105-7
- FIFER M, VLAHAKES G. Management of symptoms in hypertrophie cardiomyopathy. Circulation 2008; 117:429-39
- GERSH BJ, MARON BJ, BONOW RO, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: Executive summary. Circulation 2011; 124:2761-96
- HENSLEY N, DIETRICH J, NYHAN D, et al. Hypertrophic cardiomyopathy: a review. Anesth Analg 2015; 120:554-69
- HREYBE H, ZAHID M, SONEL A, et al. Noncardiac surgery and the risk of death and other cardiovascular events in patients with hypertrophic cardiomyopathy. Clin Cardiol 2006; 29:65-8
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- JOFFE II, RILEY MF, KATZ SE, et al. Acquired dynamic left ventricular outflow tract obstruction complicating acute anterior myocardial infarction. J Am Soc Echocardiogr 1997; 10:717-21
- LEE KS, STEWART WJ, LEVER HM, et al. Mechanism of outflow tract obstruction causing failed mitral valve repair. Circulation 1993; 88:24-9
- MARON BJ, DEARANI JA, STEVE R, et al. Low operative mortality achieved with surgical septal myectomy. J Am Coll Cardiol 2015; 66:1307-8
- POLIAC LC, BARRON ME, MARON BJ. Hypertrophic cardiomyopathy. Anesthesiology 2006; 104:183-92
- SEN-CHOWDHRY A, JACOBY D, MOON JC, et al. Update on hypertrophic cardiomyopathy and a guide to the guidelines. Nat Rev Cardiol 2016; 13:651-75
- SWISTEL DG, BALARAM SK. Surgical myectomy for hypertrophic cardiomyopathy in the 21th century, the evolution of the "RPR" repair: resection, plication, and release. Progr Cardiovasc Dis 2012; 54:498-502
- WEBSTER PJ, RAPER RF, ROSS DE, et al. Pharmacologic abolition of severe mitral regurgitation associated with dynamic left ventricular outflow tract obstruction after mitral valve repair: Confirmation by transesophageal echocardiography. Am Heart J 1993; 126:480-3
