L’ETO a une place capitale dans l’évaluation de plusieurs situations qui sont propres aux soins intensifs et ne se retrouvent pas au même degré en salle d’opération ou au déchoquage (voir Instabilité hémodynamique et Pathologies courantes) [6,11].
Choc septique
Le choc septique est un état de bas débit systémique caractérisé par une réduction du volume circulant central, une vasodilatation artérielle massive et une dysfonction biventriculaire [5]. L’échocardiographie répond à une triple exigence : 1) évaluer la fonction ventriculaire et le remplissage cardiaque, 2) guider la thérapie et assurer le suivi par des examens répétés, et 3) diagnostiquer l’origine de la sepsis (endocardite, cathéters, etc). Elle met en évidence les éléments caractéristiques du choc septique [5,6,7,8,14].
Choc septique
Le choc septique est un état de bas débit systémique caractérisé par une réduction du volume circulant central, une vasodilatation artérielle massive et une dysfonction biventriculaire [5]. L’échocardiographie répond à une triple exigence : 1) évaluer la fonction ventriculaire et le remplissage cardiaque, 2) guider la thérapie et assurer le suivi par des examens répétés, et 3) diagnostiquer l’origine de la sepsis (endocardite, cathéters, etc). Elle met en évidence les éléments caractéristiques du choc septique [5,6,7,8,14].
- Hypovolémie centrale : cavités cardiaques peu remplies, oscillations excessives du septum interauriculaire, variations ventilatoires très importantes, collapsus télésystolique du VG (voir Figures 25.242 et 25.243).
- Dysfonction du VG : après une première phase hyperkinétique, la fonction du VG est altérée (FE basse) dans > 60% des cas ; une IM et des ACS peuvent se manifester ; le VG n’est en général pas dilaté.
- Dysfonction du VD : hypokinésie sévère de la paroi libre du VD dans 30% des cas, dilatation variable de la cavité du VD. En cas d’hypertension pulmonaire (SDRA, PEEP élevée), un coeur pulmonaire aigu peut apparaître (dilatation et dysfonction massives, bascule du septum dans la cavité gauche, insuffisance tricuspidienne).
- Vasoplégie : collapsus télésystolique du VG ; la faible précharge et la tachycardie peuvent faire apparaître des ACS ; la dysfonction du VG et l’insuffisance mitrale peuvent être sous-estimées à cause de la postcharge très basse.
- Sources de la sepsis : endocardite sur valve native pathologique (70% des cas) ou normale (30% des cas), sur prothèse valvulaire, sur cathéter (rechercher une lésion tricuspidienne). L’endocardite se manifeste par :
- Végétations sur la surface d’amont des valves;
- Fistules ou abcès;
- Déhiscence de prothèse et fuite paravalvulaire;
- Insuffisance valvulaire majeure de développement très rapide.
Coeur pulmonaire aigu
Le coeur pulmonaire aigu (CPA) est une situation caractérisée par une élévation brusque de la postcharge du VD et une défaillance ventriculaire droite aiguë (Vidéo).
Le coeur pulmonaire aigu (CPA) est une situation caractérisée par une élévation brusque de la postcharge du VD et une défaillance ventriculaire droite aiguë (Vidéo).
- Embolie pulmonaire (voir Figure 25.246): seule la visualisation directe d’un thrombus dans le tronc de l’artère pulmonaire ou dans l’AP droite (l’AP gauche est invisible à l’ETO à cause du croisement de la bronche-souche gauche) permet d’affirmer le diagnostic. Les autres signes ne sont qu’indirects : dilatation massive et dysfonction aiguë du VD, insuffisance tricuspidienne, bombement du septum interauriculaire dans l’OG, bombement permanent du septum interventriculaire dans le VG, restriction du VG. Si la dysfonction droite est sévère, la PAP est peu élevée et la Vmax de l’IT est basse.
- SDRA, pressions ventilatoires excessives : dysfonction du VD sans origine dans le coeur gauche.
Vidéo: vue 4-cavités au cours d'embolie pulmonaire massive; le VD et l'OD sont dilatés, les septa interventriculaire et interauriculaire sont bombés dans les cavités gauches, qui sont comprimées et très réduites en volume.
Hypoxémie
L’échocardiographie peut diagnostiquer l’origine d’une hypoxémie inexpliquée par le status pulmonaire du patient.
L’échocardiographie peut diagnostiquer l’origine d’une hypoxémie inexpliquée par le status pulmonaire du patient.
- Oedème pulmonaire cardiogène : dysfonction VG, échec de sevrage de la ventilation en pression positive, valvulopathie mitrale ou aortique, pression OG élevée (rapport E/E’ > 14).
- Oedème pulmonaire unilatéral sur IM excentrique.
- Embolie pulmonaire, crise d'hypertension pulmonaire.
- Shunt droit – gauche : FOP, CIA ou shunt intrapulmonaire (voir Chapitre 15) ; une POG élevée peut masquer un shunt D - G.
- Epanchement pleural.
L’hypoxémie grave réfractaire est une indication à l’ETO car celle-ci peut diagnostiquer une embolie pulmonaire (thrombus ou masse lipidique en transit, embol tumoral, air en masse, dysfonction droite) ou un passage droite – gauche par un FOP (Figure 25.252).
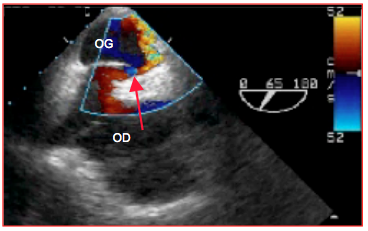
Figure 25.252 : Shunt droit – gauche important par un FOP (flèche) dans une situation d'embolie pulmonaire. Le flux couleur démontre le passage de l'OD à l'OG, et le flux tourbillonnaire qui tournoie dans l'OG.
En cas d’arrêt circulatoire inexpliqué, l’ETO permet un diagnostic étiologique dans 85% des cas [13] et modifie la décision thérapeutique dans 30% des cas [16]. L’ETO pourrait faire partie de l’algorithme de réanimation de l’ACLS : A (airway), B (breathing), C (circulation), D (defibrillation) et E (echocardiography) [4].
Recherche de FOP
Le foramen ovale perméable (FOP) est une anomalie fréquente, puisqu'on le rencontre dans 24% de la population; son incidence à l'examen échocardiographique varie de 5 à 19% [1,10]. La présence d'un FOP au cours d'un SDRA sous ventilation en pression positive et PEEP se traduit par un shunt droit – gauche cyanogène à cause de l'élévation de la POD avec l'augmentation de la postcharge du VD; le rapport PaO2/FiO2 passe de 175 (malades sans FOP) à 110 (malades avec shunt D-G par le FOP) [12].
La recherche d’un FOP fait partie de l’examen standard en vue 4-cavités MO à 0° et en vue bicave à 100°. Elle comprend 3 étapes [15].

Figure 25.252 : Shunt droit – gauche important par un FOP (flèche) dans une situation d'embolie pulmonaire. Le flux couleur démontre le passage de l'OD à l'OG, et le flux tourbillonnaire qui tournoie dans l'OG.
En cas d’arrêt circulatoire inexpliqué, l’ETO permet un diagnostic étiologique dans 85% des cas [13] et modifie la décision thérapeutique dans 30% des cas [16]. L’ETO pourrait faire partie de l’algorithme de réanimation de l’ACLS : A (airway), B (breathing), C (circulation), D (defibrillation) et E (echocardiography) [4].
Recherche de FOP
Le foramen ovale perméable (FOP) est une anomalie fréquente, puisqu'on le rencontre dans 24% de la population; son incidence à l'examen échocardiographique varie de 5 à 19% [1,10]. La présence d'un FOP au cours d'un SDRA sous ventilation en pression positive et PEEP se traduit par un shunt droit – gauche cyanogène à cause de l'élévation de la POD avec l'augmentation de la postcharge du VD; le rapport PaO2/FiO2 passe de 175 (malades sans FOP) à 110 (malades avec shunt D-G par le FOP) [12].
La recherche d’un FOP fait partie de l’examen standard en vue 4-cavités MO à 0° et en vue bicave à 100°. Elle comprend 3 étapes [15].
- Image 2D : la présence d’un anévrysme du septum interauriculaire (débattement > 15 mm), d’une membrane de la fosse ovale excessivement longue ou d’un passage visible entre la membrane et le septum musculaire en vue bicave sont des signes de suspicion, mais leur absence n’exclut nullement la présence d'un FOP.
- Doppler couleur : flux de shunt à prédominance gauche – droite oblique à travers le septum ; régler l’échelle couleur sur des vélocités 20 – 40 cm/s. L'absence de flux couleur n'exclut pas un FOP, qui peut n'apparaître que lors des manœuvres de provocation (voir ci-dessous) (Vidéo).
- Test aux microbulles : l’épreuve de contraste se fait par l'injection rapide, de préférence par voie centrale, de 10 ml NaCl 0.9% dans lesquels on a créé des microbulles par cavitation entre deux seringues réunies par un robinet 3-voies (mouvement de va-et-vient alterné des deux pistons pour forcer le liquide sous pression à travers le passage étroit du robinet). Elle démontre une opacification de l'OD et une apparition immédiate de 3-10 microbulles dans l'OG et dans l'aorte; si ces dernières arrivent dans l'OG plus de 5 cycles cardiaques après leur apparition dans l'OD, elles sont probablement dues au passage transpulmonaire (Vidéo et Figure 25.92) [3].
Vidéo: flux Doppler couleur à travers un foramen ovale perméable; ce flux signale un passage spontané gauche - droit.
Vidéo: test aux microbulles en présence d'un FOP et d'un anévrysme du septum interauriculaire; les bulles passent dans l'OG par bouffées lorsque la POD est supérieure à la POG comme le montre le basculement de la membrane de la fosse ovale. L'arrivée de microbulles dans l'OG traduit un passage droit - gauche.
La vue 5-cavités 0-20° est préférable pour le test aux microbulles, car on voit l’OD (contrôle de l’apparition des microbulles), l’OG et la CCVG (contrôle du passage à gauche); la vue bicave 90-100° offre la meilleure vision de la membrane et de la fosse ovale, mais elle ne permet pas le contrôle du passage à gauche dans la voie d'éjection. Pour favoriser le passage D-G, on réalise deux manœuvres différentes [9].
- Une augmentation de pression dans l’OD en élevant la postcharge du VD par une PEEP importante (20-25 cm H2O) ou un Valsalva;
- Une augmentation de volume de l’OD en relâchant brusquement la pression dans les voies aériennes ; ceci a pour effet d'augmenter le retour veineux vers l'OD mais de freiner momentanément celui vers l'OG.
Le flux couleur démontre l’existence d’un passage gauche – droit. Ce flux peut s’inverser partiellement ou totalement en cas de surpression dans l’OD (embolie pulmonaire, par exemple). Lors du test aux microbulles, la PEEP est l’équivalent d’une augmentation de la postcharge droite; la déconnexion du ventilateur correspond à une baisse de pression intrathoracique comme un inspirium profond. Ces deux manœuvres favorisent le passage droit – gauche par augmentation momentanée de la pression ou du volume dans l'OD par rapport à l'OG. Un test aux microbulles négatif exclut un passage droit – gauche, mais pas l’existence d’un FOP, car celui-ci peut shunter exclusivement gauche – droit si la POG est élevée ou si la POD est très basse. Une technique plus violente pour forcer le passage D-G consiste à demander à l'opérateur de comprimer manuellement l'artère pulmonaire pour augmenter la postcharge du VD et la pression dans l'OD.
Complications de l’infarctus
Outre les ACS, l’échocardiographie met bien en évidence les complications de l'ischémie aiguë qui demandent une prise en charge particulière et urgente: insuffisance mitrale sur akinésie pariétale ou rupture de pilier, rupture pariétale en péricarde libre, communication interventriculaire par nécrose septale, ou thrombus intracavitaire sur une zone akinétique (en général apicale) (voir Chapitre 27, Complications de l’ischémie).
Endocardite
L'endocardite est hautement suspecte chez les patients fébriles souffrant de pathologie valvulaire ou porteurs de matériel prothétique endovasculaire. La sensibilité de l'ETO pour ce diagnostic est ≥ 95% [2]. Le diagnostic échocardiographique est fondé sur un certain nombre d'éléments.
Complications de l’infarctus
Outre les ACS, l’échocardiographie met bien en évidence les complications de l'ischémie aiguë qui demandent une prise en charge particulière et urgente: insuffisance mitrale sur akinésie pariétale ou rupture de pilier, rupture pariétale en péricarde libre, communication interventriculaire par nécrose septale, ou thrombus intracavitaire sur une zone akinétique (en général apicale) (voir Chapitre 27, Complications de l’ischémie).
Endocardite
L'endocardite est hautement suspecte chez les patients fébriles souffrant de pathologie valvulaire ou porteurs de matériel prothétique endovasculaire. La sensibilité de l'ETO pour ce diagnostic est ≥ 95% [2]. Le diagnostic échocardiographique est fondé sur un certain nombre d'éléments.
- Végétations; elles se présentent sous forme de masse sessile ou de filaments; elles sont implantées sur la face d'amont des feuillets valvulaires (Vidéo).
- Déhiscence de prothèse valvulaire; orifice paravalvulaire avec passage de flux au Doppler couleur; la prothèse est animée de mouvements anormaux au cours du cycle cardiaque.
- Abcès; formation kystique sur un feuillet, avec ou sans perforation, cavité fusant dans l'angle mitro-aortique ou en direction du septum depuis la racine de l'aorte.
- Fistule : perforation et passage anormal de flux entre l’aorte, le VG, le VD ou une oreillette.
Vidéo: végétation endocarditique située sur le feuillet postérieur de la valve mitrale.
Source d'embolie
L'embolie systémique est un événement potentiellement catastrophique selon le volume embolisé et selon l'organe touché. L'ETO est le moyen diagnostic préférentiel pour explorer les sources d'embols intracardiaques (Vidéos et Figure 25.253).
L'embolie systémique est un événement potentiellement catastrophique selon le volume embolisé et selon l'organe touché. L'ETO est le moyen diagnostic préférentiel pour explorer les sources d'embols intracardiaques (Vidéos et Figure 25.253).
- Thrombus; la localisation la plus fréquente est l'appendice auriculaire gauche, notamment chez les patients en FA, mais on trouve des thrombus dans le corps de l'OG et dans le VG, essentiellement en regard de zones akinétiques et/ou en cas de bas débit avec stagnation du sang.
- Endocardite; fragments de végétation.
- Tumeurs; fibro-adénome de la valve aortique, parfois fragment de myxome auriculaire.
- Athérome massif, érodé ou flottant dans l'aorte ascendante ou descendante.
- En présence d'un passage D-G (FOP, CIA): thrombus sur cathéter intraveineux, tumeur envahissant le système veineux (hypernéphrome), embolie paradoxale.
Vidéo: thrombus ovoïde dans l'appendice auriculaire gauche chez un patient souffrant d'une obstruction partielle de sa prothèse mécanique mitrale.
Vidéo: vaste thrombus à l'apex du VG, qui est akinétique. Lorsqu'elle est plus petite, cette masse est souvent invisible en vue 4-cavités; elle n'apparaît qu'en 2-cavités ou en long-axe, dans la vue où le long axe du VG est le plus grand.
Vidéo: embolie paradoxale lors d'une embolie pulmonaire massive (embol à cheval sur le septum interauriculaire); en présence d'un FOP, la surpression dans l'OG liée à la défaillance droite peut propulser un thrombus de l'OD dans l'OG.
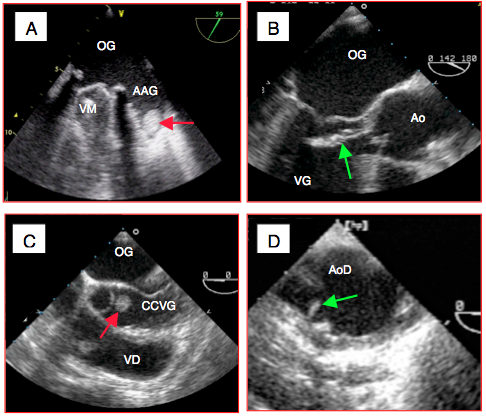
Figure 25.253 : Sources d'embolie systémique. A: thrombus dans l'appendice auriculaire gauche (AAG); la valve mitrale (VM) est une prothèse mécanique. B: végétation endocarditique sur la valve aortique. C: fibro-élastome de la valve aortique. D: athérome mobile dans la partie proximale de l'aorte descendante (AoD).
Un examen ETO est indiqué avant une cardioversion chez les patients en FA depuis ≥ 48 heures et non-anticoagulés.
| Indications propres à l'ETO en SI |
| L'ETO est précieuse pour le diagnostic et la prise en charge de plusieurs situations en soins intensifs: - Choc septique: hypovolémie centrale, dysfonction ventriculaire, source de sepsis - Insuffisance droite aiguë: embolie pulmonaire, SDRA - Hypoxémie réfractaire: insuffisance droite, embolie pulmonaire, shunt D-G, épanchement - Recherche de FOP: flux couleur, test aux microbulles, embolie paradoxale - Recherche d'endocardite - Recherche de source d'embols: thrombus intracardiaque, athérome aortique, tumeur - Complications de l'infarctus |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- AGOUSTIDES JG, WEISS SJ, WEINER J, et al. Diagnosis of patent foramen ovale with multiplane transesophageal echocardiography in adult cardiac surgical patients. J Cardiothorac Vasc Anesth 2004; 18:725-30
- BEAULIEU Y. Bedside echocardiography in the assessment of the critically ill. Crit Care Med 2007; 35(Suppl):S235-49
- BELVIS R, LETA RG, MARTI-FABREGAS J, et al. Almost perfect concordance between simultaneous transcranial Doppler and transesophageal echocardiography in the quantification of right-to-left shunt. J Neuroimaging 2006; 16:133-8
- BREITKREUZ R, WALCHER F, SEEGER SH. Focused echocardiographic evaluation in resuscitation management: Concept of an advanced life support-conformed algorithm. Crit Care Med 2007; 35(Suppl):S150-S161
- DELLINGER RP, LEVY MM, CARLET JM, et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock 2008. Intens Care Med 2008; 34:17-60
- DESHPANDE R, AKHTAR S, HADDADIN AS. Utility of ultrasound in the ICU. Curr Opin Anesthesiol 2014; 27:123-32
- ETCHECOPAR-CHEVREUIL C, FRANCOIS B, CLAVEL M, et al. Cardiac morphological and functional changes during early septic shock. Intens Care Med 2008 ; 34 :250-6
- GRIFFEE M, MERKEL M, WEI K. The role of echocardiography in hemodynamic assessement of septic shock. Crit Care Clin 2010; 26:365-82
- KONSTADT SN, LOUIE EK, BLACK S. Intraoperative detection of foramen ovale by transesophageal echocardiography. Anesthesiology 1994; 74:212-6
- KRASUKI RA, HART SA, ALLEN D, et al. Prevalence and repair of intraoperatively diagnosed patent foramen ovale and association with perioperative outcomes and long-term survival. JAMA 2009; 302:290-7
- MAYO PH, NARASIMHAN M, KOENIG S. Critical care transesophageal echocardiography. Chest 2015; 148:1323-32
- MEKONTSO-DESSAP A, BOISSIER F, LEON R, et al. Prevalence and prognosis of shunting across patent foramen ovale during respiratory distress syndrome. Crit Care Med 2010; 38:1786-92
- MEMTSOUDIS SG, ROSENBERGER P, LOFFLER M, et al. The usefulness of transesophageal echocardiography during intraoperative cardiac arrest in noncardiac surgery. Anesth Analg 2006; 102:1653-7
- PRICE S, VIA G, SLOTH E, et al. Echocardiography practice, training and accreditation in the intensive care: document for the World Interactive Network Focused on Critical Ultrasound (WINFOCUS). Cardiovasc Ultrasound 2008; 6:49 (1-35)
- SILVESTRY FE, COHEN MS, ARMSBY LB, et al. Guidelines fort he echocardiographic assessment of atrial septal defects and patent foramen ovale: from the American Society of Echocardiography and Society for Cardiac Angiography and Interventions. J Am Soc Echocardiogr 2015; 28:910-58
- VAN DER WOUW PA, KOSTER RW, DELAMARRE BJ, et al. Diagnostic accuracy of transesophageal echocardiography during cardiopulmonary resuscitation. J Am Coll Cardiol 1997; 30:780-3
