Les nouveaux anticoagulants oraux (NACO) anti-Xa et anti-thrombine présentent moins de risque hémorragique que les AVK: réduction de l'incidence moyenne des saignements majeurs de 2% (AVK) à 1% (NACO), réduction des hémorragies intracrâniennes de 51% et de la mortalité de 40% [36]. Cependant, leur risque de saignement reste de 1-3.6% par an selon les substances et selon les indications [5]. Si une hémorragie grave sous anticoagulant menace la survie du patient ou si l'urgence de la chirurgie empêche de respecter les délais imposés par l’élimination spontanée de la substance, il est possible de renverser l’effet des anticoagulants, soit avec un antidote spécifique, soit avec des facteurs de coagulation. Ceci n'est pas sans risque, et la manière de procéder doit prendre en compte plusieurs données importantes [41].
- Le risque de la lésion hémorragique. Sont considérés comme saignement majeur sous anticoagulant une baisse d'Hb de 20-50 g/L, une perte sanguine nécessitant la transfusion de > 2 unités de sang ou une hémorragie intracrânienne [34].
- Le risque hémorragique de la chirurgie. La plupart des opérations peut se dérouler sans danger malgré un effet anticoagulant résiduel. Seules les interventions à haut risque hémorragique imposent d’opérer dans des conditions coagulatoires normalisées. Ce sont essentiellement : neurochirurgie intracrânienne ou intrarachidienne, interventions hémorragipares avec hémostase difficile, chirurgie orthopédique ou oncologique majeures, chirurgie uro-génitale majeure (à cause de l’urokinase endogène) [9].
- Le risque thrombo-embolique de la maladie. S’il est élevé, le renversement complet de l’anticoagulation est toujours dangereux. Dans cette situation, il ne s'agit pas de rétablir une coagulation normale, mais de freiner l'anticoagulation à un niveau compatible avec le risque hémorragique de la lésion ou de la chirurgie. Le renversement prophylactique de l’anticoagulation n’est pas recommandé, sauf dans les opérations à très haut risque hémorragique chez des malades à faible risque thrombo-embolique [44].
- Le risque thrombotique de la chirurgie. Celle-ci s’accompagne d’une hypercoagulabilité, d’une activation plaquettaire et d’une inhibition de la fibrinolyse qui augmentent le risque de thrombose vasculaire. L’anamnèse d’accident vasculaire récent et les pathologies cancéreuses présentent un risque particulièrement élevé. La thrombose est 6 fois plus fréquente en chirurgie du cancer qu’en chirurgie générale ou vasculaire [10,11,43].
- Le risque thrombotique des agents utilisés pour l'antagonbisme. Les complexes prothrombiniques activés et le facteur rVIIa peuvent occasionner des thromboses artérielles dans 1 à 20% des cas [21,26].
- Le degré d’urgence. Si le délai d'intervention est trop court pour que l'effet s'atténue de lui-même, l’anticoagulation peut être renversée par un antidote, s’il est disponible. A défaut, on peut recourir à des facteurs de coagulation non-spécifiques.
- Les situations difficiles doivent être réglées au cas par cas avec l'aide d'un hématologue.
Les tests de laboratoire conventionnels sont peu performants pour juger du degré d'anticoagulation sous les NACO (voir Tableau 8.4) [22,40,45]. Le TT et le TP sont sensibles au dabigatran et aux xabans respectivement, mais la corrélation n'est absolument pas quantitative et des valeurs normales n'excluent nullement des taux résiduels significatifs [37]. Le PTT est moins sensible que le TT au dabigatran, et le TP l'est moins à l'apixaban qu'aux autres xabans [7]. Les tests spécifiques pour le dabigatran sont le temps de thrombine dilué (dTT) et le temps d'écarine (Ecarin clotting time); pour les xabans, ce sont les tests anti-Xa calibrés pour chaque agent [6]. On estime qu'un taux résiduel ≤ 30 ng/mL de dabigatran, de rivaroxaban ou d'apixaban, mesuré > 4 heures après la dernière prise du médicament, ne nécessite pas d'intervention et permet d'opérer sans risque [12,31]. Malheureusement, les tests spécifiques ne sont pas universellement disponibles en urgence.
Comme la demi-vie des NACO est courte (en moyenne 8-12 heures), la simple attente est la première mesure à envisager si la situation le permet [5,18,19]. Plus on attend, plus le risque de saignement diminue. Après 24 heures, le taux plasmatique n'est plus que de 25%, et un délai de 48 heures garantit l'absence d'effet (taux résiduel de 6-7%). Comme l'élimination des NACO est en grande partie rénale, ce délai doit être doublé lorsque la clairance de la créatinine est < 50 mL/min. Dans les interventions vitales non-électives, la chirurgie est envisageable dès que le dosage de l'effet anti-Xa correspond à un taux plasmatique < 50 ng/mL [12]. La prise en charge s'accompagne toujours de mesures générales: compression locale, hémostase chirurgicale ou endoscopique, embolisation radio-interventionnelle, administration de volume, éventuellement transfusions de sang en cas d'anémie aiguë ou de plaquettes en cas de thrombopénie. L'antagonisme des anticoagulants peut s'opérer soit par des antidotes spécifiques lorsqu'ils existent, soit par des médicaments et des facteurs de coagulation non-spécifiques.
Antidotes spécifiques
Les anticoagulants classiques possèdent un antidote qui permet d’en renverser intégralement l’effet.
- Héparine non-fractionnée (HNF): protamine. Un mg de protamine (100 UI) neutralise 1 mg d'héparine (100 UI). Habituellement, on administre une dose de protamine correspondant aux 80% de la dose d'héparine.
- Héparines à bas poids moléculaire (HBPM): la protamine est un antagoniste partiel. Une neutralisation de 60% de l’effet anticoagulant est possible à raison de 1 mg de protamine pour 100 UI d’effet anti-Xa (dose maximale : 50 mg), à la condition d’être à moins de 8 heures après l’administration [6,14].
- Agents anti-vitamine K (AVK): vitamine K (Konakion®) intraveineuse (2.5-5.0 mg, éventuellement 10 mg) administrée en > 20 minutes; effet maximal après 12-24 heures [3,10].
La préparation d'antidotes spécifiques pour les NACOs avance à grands pas. Il en existe actuellement trois, dont un est déjà disponible [4,30,37].
- Idarucizumab (Praxbind®, actuellement commercialisé); anticorps monoclonal se liant de manière irréversible avec le dabigatran (affinité 350 fois supérieure à celle de la thrombine). Malgré sa courte demi-vie, il neutralise tout le dabigatran circulant. Normalisation du dTT et de l'ECT, hémostase chirurgicale normalisée dans 94% des cas, délai pour intervention urgente 1.6 heures [33,38].
- Début de l'action: < 5 minutes.
- Demi-vie: initiale 47 min, terminale 10.3 heures; élimination rénale.
- Dosage: 2 x 2.5 g iv en 10 min à 15 minutes d'intervalle.
- Au fur et à mesure que le dabigatran circulant est neutralisé, le dabigatran distribué dans le liquide extracellulaire et dans les tissus rediffuse dans le plasma et oblige à administrer une nouvelle dose d'antagoniste; ce phénomène peut se répéter plusieurs fois.
- Andexanet alfa (Andexxa®); fonctionne comme un leurre du facteur Xa et séquestre les inhibiteurs de ce facteur (xabans) dans un rapport stochiométrique 1:1. L'activité anti-Xa est réduite de 92-94% en 5 minutes et l'effet dure 2 heures [39]; sur une série de 352 malades dont le taux de facteur anti-Xa est en moyenne de 150 ng/mL et qui souffrent d'hémorragie majeure intracrânienne ou digestive, l'hémostase est effective dans 82% des cas; le facteur anti-Xa est abaissé en moyenne à 11 ng/mL [8]. La durée d'action de l'andexanet étant plus courte que celle des xabans, il y a un risque d'effet rebond de l'anticoagulation; l'adminsitration doit alors être répétée [28]. La substance est en voie de commercialisation pour renverser l'effet du rivaroxaban, de l'apixaban et de l'edoxaban; elle a été approuvée par la FDA en avril 2018 et par l'EMA en avril 2019.
- Début de l'action: 2 minutes.
- Demi-vie: initiale 1 heure, terminale 6 heures.
- Dosage 1: 400 mg (bolus iv à 30 mg/min), puis perfusion de 2 heures à 4 mg/min (480 mg) pour l'apixaban, ou pour le rivaroxaban à > 7 heures de la dernière prise.
- Dosage 2: 800 mg puis perfusion de 2 heures à 8 mg/min (960 mg) pour l'edoxaban, ou pour le rivaroxaban à < 7 heures de la dernière prise.
- Ciraparantag (aripazine, PER977); molécule polyvalente contenant 8 sites de fixation covalente par l'H+, efficace pour renverser l'effet des xabans, de l'argatroban, du fondaparinux, du dabigatran et des héparines. Le temps de coagulation est normalisé en 10 minutes [3], et l'hémorragie diminuée de 90% chez l'animal [25]. Les essais cliniques n'étant pas encore terminés, la substance ne sera pas sur le marché avant 1-2 ans.
- Début de l'action: 5-10 minutes.
- Durée d'action de 24 heures.
- Dosage: 100-300 mg en bolus iv.
Les indications de ces antidotes sont les saignements menaçant la survie du patient, particulièrement les hémorragies intracrâniennes, et les interventions chirurgicales majeures urgentes ne pouvant pas être renvoyées de 12-24 heures. Ces antagonistes présentent peu de danger de thrombose secondaire car ils sont sans effet sur les facteurs de coagulation [5]. Dans la mesure où ils seront disponibles, ils seront préférables aux agents non-spécifiques, mais leurs indications resteront limitées aux situations incontrôlables. Ils n'ont aucune indication en cas de surdosage d'un NACO si le malade ne saigne pas, ni au-delà de 24 heures après la dernière prise car le taux circulant est trop faible [47]. Ils inhibent complètement la substance circulante, mais l'hémorragie peut recommencer après quelques heures à cause de la rediffusion sanguine de l'anticoagulant à partir du compartiment extravasculaire. Bien qu'ils normalisent les tests de laboratoire et diminuent efficacement les saignements, ces antidotes ont un effet relatif sur la survie des patients, qui souffrent d'une mortalité élevée liée à la pathologie de base justifiant l'anticoagulation et aux conséquences de l'hématome, notamment intracrânien. D'ailleurs, le devenir des malades hospitalisés en urgence pour hémorragie sous NACO, sans antidote disponible, est comparable à celui des malades saignant sous AVK, pour lequel l'antidote est d'utilisation courante [40,41]. Ajoutées à leur coût extrêmement élevé, ces remarques limitent les indications des antagonistes à un secteur de niche.
Antagonisme non-spécifique
En l'absence d'antidote, on ne peut que recourir à un renversement non-spécifique, après s’être assuré que la calcémie, l’équilibre acido-basique et la température du malade sont normaux (voir Facteurs de coagulation) [21,29,37]. Il est possible d’atténuer les effets de l’anticoagulation par l’appoint de deux substances [15,35,41,46].
- L’acide tranexamique (2 gm iv) ; cet antifibrinolytique peut freiner la production de plasmine et l'activation excessive de la fibrinolyse. Il s'est montré relativement efficace dans des situations telles que l'hémorragie traumatique majeure, la CEC ou le syndrome inflammatoire postopératoire (voir Antifibrinolytiques).
- La desmopressine (0.3 mcg/kg iv) stimule la production de facteur VIII et de facteur von Willebrand par l’endothélium et améliore l’adhésion plaquettaire (voir Plaquettes).
Si ces deux substances n'améliorent pas la situation, l'étape suivante consiste à administrer des facteurs de coagulation. Dans le cas des NACO, malheureusement, l'anticoagulant circulant bloque également les facteurs administrés, ce qui les rend bien moins performants que dans le cas des AVK [13,18,19,30,41,47].
- Complexe prothrombinique (PCC prothrombin complex concentrate); contient les facteurs II, IX, X (préparations à 3 facteurs) et du facteur VII (préparations à 4 facteurs), ainsi que de la protéine C et de la protéine S. Dosage: 25-50 UI/kg. Permet le renversement partiel de l’effet des xabans sur les tests de coagulation in vitro et in vivo, mais inefficace sur le dabigatran [16,27,49]. Les préparations à 4 facteurs sont préférables ; la dose efficace est 50 UI/kg [49]. Les demi-vies des différents facteurs ne sont pas identiques et s’étalent de 5 heures pour le FVII à 60 heures pour le FII.
- Complexe prothrombinique activé (aPCC) ou FEIBA® (Factor eight inhibitor bypass activity), contient les facteurs II, IX, X et VII dont une bonne partie sous forme activée. Dosage: 30-50 UI/kg. Bonne alternative contre l’effet du dabigatran, il est aussi plus efficace que les PCC pour le renversement in vitro du rivaroxaban, mais il présente un risque significatif de thrombose secondaire [32].
- Facteur VII activé (rFVIIa, Novo-Seven®), 90 mcg/kg; le rFVIIa active le facteur X en Xa, ce qui génère davantage de thrombine. Il peut être indiqué pour contrecarrer les anti-Xa. Bien qu’il normalise les tests de coagulation, le rFVIIa ne diminue pas significativement les pertes sanguines [16]. Il présente un risque élevé de thrombose [1]. Bien qu'il puisse être utile en cas d’hémorragie incoercible sur fondaparinux [23], le rVIIa n'affiche aucun succès dans le renversement de l’effet des NACO, et ne devrait plus être envisagé dans cette situation.
- L’ordre d’efficacité croissant pour renverser l’effet des xabans sur les tests de coagulation est : rFVIIa < PCC < aPCC; toutefois l’effet est limité et ne dépasse pas 50% de correction [32].
- Plasma frais congelé: il n'existe aucune évidence que le PFC renverse l'effet des NACO; son utilité majeure est la restauration du volume circulant en accompagnement de transfusions [13,18,47].
- Transfusion de plaquettes en cas de thrombocytopénie ou de traitement antiplaquettaire associé.
Un registre français collectant 732 patients souffrant d'hémorragie sévère sur NACO prouve que le PFC est utilisé dans 38% des cas avec un taux de succès apparent sur l'hémostase d'environ 40%, mais sans diminution notable de la mortalité [2]. Le FEIBA et le rFVIIa sont réservés aux pertes sanguines potentiellement létales qui ne répondent plus aux mesures d'hémostase et de soutien, mais ils n'offrent aucune garantie de succès [47]. Les travaux prouvant l'efficacité des facteurs de coagulation dans l'hémorragie sur NACO sont très limités et peu concluants, particulièrement pour le rFVIIa [5]. Ces agents ne doivent pas être utilisés de manière prophylactique, ni en cas de taux d'anticoagulant suprathérapeutique sans saignement actif incontrôlé, car le danger de thrombose secondaire est bien réel [37]. Le plasma frais décongelé (PFC) a peu de chance d’être efficace car il contient de faibles concentrations des facteurs et fait courir un risque de surcharge hémodynamique pour obtenir l’effet désiré (1-2 litres de PFC sont nécessaires pour normaliser le taux des facteurs). Or il ne s’agit pas ici de compenser la déplétion des facteurs, comme dans le renversement des AVK, mais de surmonter leur inhibition par une substance circulante [1,20,21]. Dans ce cadre, le PFC n'est utile que comme expandeur plasmatique. Le renversement de l'anticoagulation par les NACO est excessivement onéreux: une dose de PCC activé (50 UI/kg) dépasse CHF 5'000.-, et celle de Praxbind® s'élève à CHF 3'400.- [37].
Ces traitements sont basés sur la persistance des saignements et sur les altérations des tests de coagulation (TP, aPTT, TT, thromboélastographie, anti-Xa). En l’absence d’héparine, une valeur anti-Xa < 0.1 U/mL suggère que l’effet a disparu. Un taux résiduel < 50 ng/mL de xaban ou de dabigatran est compatible avec la chirurgie générale, et un taux ≤ 30 ng/mL permet d'opérer dans les situations à haut risque hémorragique [12,41]. Le thromboélastogramme est probablement le test le plus instructif. Bien que la plupart des tests standards soit améliorée, leur éventuelle normalisation par le traitement n’assure malheureusement pas que l’hémostase soit normale en cours d’opération [42]. D’autre part, l’administration de facteurs de coagulation peut améliorer le bilan hémorragique sans que les tests de laboratoire ne soient significativement modifiés [48]. Le couplage est donc assez lâche entre les valeurs de laboratoire et le saignement clinique [13].
A défaut de renverser l’effet anticoagulant, on peut tenter de freiner l’absorption digestive du produit avec du charbon actif (30-50 g) si la dernière prise remonte à moins de 3-6 heures. On peut aussi éliminer la substance par filtration [17,47]:
- Par hémodialyse pour le dabigatran, car sa fixation protéique est modeste (35%); 40-65% de la substance sont éliminés en 4 heures, mais un effet rebond peut survenir à l'arrêt de la dialyse [24]. La mise en place d'une hémodialyse peut être chaotique dans le cadre d'un choc hémorragique.
- Par plasmaphérèse pour le rivaroxaban et l’apixaban, qui sont trop fortement liés aux protéines plasmatiques (80-95%) pour être efficacement dialysés.
Toutefois, cette option est plus théorique que réaliste. L’installation d’une hémodialyse ou d’une plasmaphérèse chez un patient qui saigne abondamment est aléatoire, et la ponction veineuse centrale sous anticoagulation présente des risques évidents d’hémorragie potentiellement désastreuse.
Chez un malade qui saigne sous anticoagulants, l'élévation du TP et du TT, éventuellement du PTT, doit faire suspecter l'utilisation d'un NACO et commander un test anti-Xa et un dTT (Hemoclot™) pour s'en assurer. Répétés à 6 heures d'intervalle si la situation l'autorise, deux dosages successifs permettent de situer le malade sur la courbe d'élimination de la substance et de décider si un antagonisme est requis. La chirurgie est envisageable dès que le dosage de l'effet anti-Xa ou anti-IIa est < 50 ng/mL, ce qui peut être atteint par une simple attente si la situation le tolère. Il est capital de connaître le délai depuis la dernière prise du médicament, qui permet de savoir si l'on est au pic ou au nadir de la concentration circulante, l'âge et la fonction rénale du patient, qui permettent d'évaluer la vitesse d'élimination du produit, ainsi que ses comorbidités et comédications, qui permettent de juger des éventuelles interférences. Un algorithme permet de clarifier l'enchaînement des diverses mesures thérapeutiques (Figure 8.14).
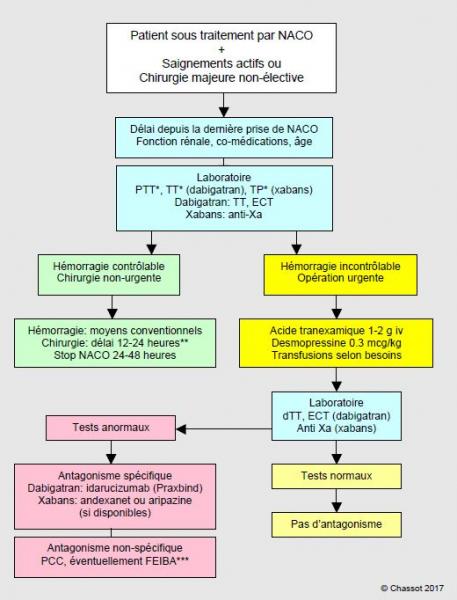
Figure 8.14: Algorithme de prise en charge des malades souffrant d'hémorragie ou devant subir une opération urgente hémorragipare lors d'utilisation des nouveaux anticoagulants oraux (NACO): dabigatran, rivaroxaban, apixaban ou edoxaban.
*: ces tests ont une valeur d'alerte, mais n'ont pas de valeur quantitative; en particulier, une valeur normale n'exclut pas la présence d'un taux significatif de la substance.
**: la demi-vie des NACO est en moyenne de 12 heures; après 24 heures, le taux plasmatique est de 25%, et un délai de 48 heures garantit l'absence d'effet (taux résiduel de 6-7%). La chirurgie standard est envisageable dès que le dosage de l'effet anti-Xa correspond à un taux plasmatique < 50 ng/mL, ce qui peut être atteint par une simple attente si la situation le permet. La chirurgie à risque hémorragique nécessite un taux < 30 ng/mL.
***: le PCC activé (FEIBA) et le rFVVa sont réservés aux hémorragies potentiellement létales.
Moyens conventionnels: compression locale et hémostase chirurgicale ou endoscopique, embolisation radio-interventionnelle, administration de volume (cristalloïdes, expandeurs plasmatiques), charbon actif si ingestion < 4 heures. dTT: temps de thrombine dilué (Hemoclot™). ECT: ecarin coagulation time.
| Renversement de l’effet des anticoagulants |
|
Le but est d’atteindre un niveau d’anticoagulation qui soit un compromis acceptable entre les pertes sanguines spontanées ou peropératoires et le danger de thrombo-embolie. Antagoniser l'anticoagulation n'a pas de sens en dehors de l'hémorragie majeure. Le renversement prophylactique de l’anticoagulation n’est pas recommandé, sauf dans les opérations à très haut risque hémorragique chez les malades à faible risque thrombo-embolique.
Antidotes spécifiques :
- Héparine non-fractionnée : protamine (1 mg protamine pour 1 mg héparine)
- HBPM : la protamine est un antagoniste partiel
- Agents anti-vitamine K : vitamine K (2.5-5 mg iv / 12 h), complexe prothrombinique si
urgence
- Dabigatran: idarucizumab (Praxbind®)
- Autres NACO: antidote (andexanet alfa et aripazine) en voie de commercialisation
Agents non-spécifiques :
- Acide tranexamique (2 gm, 15 mg/kg))
- Desmopressine (0.3 mcg/kg)*
- Complexe prothrombinique (facteurs II, IX, X et une dose variable de facteur VII)**
- Complexe prothrombinique activé (aPCC), FEIBA® (facteurs II, IX, X et VII partiellement
activés)***
- Facteur VII activé (rFVIIa, Novo-Seven®): sauvetage en cas de mort imminente****
- Ordre d’efficacité pour renverser l’effet du rivaroxaban sur les tests de coagulation in vitro:
PCC < rFVIIa < aPCC
- Transfusion de sang en cas d'anémie aiguë et de plaquettes en cas de thrombopénie
* : préférentiellement en cas de dysfonctionnement plaquettaire et de déficit en FVIII ou FvW
** : préférentiellement pour contrer les agents anti-Xa (rivaroxaban, apixaban, edoxaban)
*** : préférentiellement pour contrer les agents anti-thrombine (dabigatran)
**** : l’efficacité du rFVIIa n’est pas prouvée dans ce cadre.
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2019
Références
- AGENO WA, GALLUS AS, WITTKOWSKY A, et al. Oral anticoagulant therapy: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e44S-e88S
- ALBALADEJO P, SAMAMA CM, SIÉ P, et al. Management of severe bleeding in patients treated with direct oral anticoagulants. An observational registry analysis. Anesthesiology 2017; 127:111-20
- ANSEL JE, BAKHRU SH, LAULICHT BE, et al. Use of PER977 to reverse the antocoagulant effet of edoxaban. N Engl J Med 2014; 371:2141-2
- ARBIT B, NISHIMURA M, HSU JC. Reversal agents for direct oral anticoagulants: a focused review. Int J Cardiol 2016; 223:244-50
- ARONIS K, HYLEK EM. Who, when, and how to reverse non-vitamin K oral anticoagulants. J Thromb Thrombolysis 2016; 41:253-72
- BROWN C, JOSHI B, FARADAY N, et al. Emergency cardiac surgery in patients with acute coronary syndromes : a review of the evidence and perioperative inmplications of medical and mechanical therapeutics. Anesth Analg 2011 ; 112 : 277-99
- BROWN KS, ZAHIR H, GROSSO MA; et al. Nonvitamin K antagonist oral anticoagulant activity: challenges in measurement and reversal. Critical Care 2016; 20:273
- CONOLLY SJ, CROWTHER M, EIKELBOOM JW, et al. Full study report of andexanet alfa for bleeding associated with factor Xa inhibitors. N Engl J Med 2019; 380:1326-35
- DOUKETIS JD. Perioperative management of patients who are receiving warfarin therapy: an evidence-based and practical approach. Blood 2011; 117:5044-9
- DOUKETIS JD, BERGER PB, DUNN AS, et al. The perioperative management of antithrombotic therapy. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest 2008; 133:299S-339S
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy : Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ; 141 (2 suppl) : e326S-50S
- DROUET L, BAL DIT SOLLIER C, STEINER T, et al. Measuring non-vitamin K antagonist oral anticoagulant levels: When is it appropriate and which methods should be used ? Int J Stroke 2016; 11:748-58
- EIKELBOOM JW, KOZEK-LANGENECKER S, EXADACTYLOS A, et al. Emergency care of patients receiving non-vitamin K antagonist oral anticoagulants. Br J Anaesth 2018; 120:645-56
- GARCIA DA, BAGLIN TP, WEITZ JI, et al. Parenteral anticoagulants: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e24S-e43S
- GHADIMI K, LEVY JH, WELSBY IJ. Perioperative management of the bleeding patient. Br J Anaesth 2016; 117(suppl 3):iii18-iii30
- GODIER A, MICHOT A, LE BONNIEC B, et al. Evaluation of prothrombin complex concentrate and recombinant activated factor VII to reverse rivaroxaban in a rabbit model. Anesthesiology 2012; 116:94-102
- HANKEY GJ, EIKELBOOM JW. Dabigatran etexilate: a new oral thrombin inhibitor. Circulation 2011; 123: 1436-50
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015 ; 17:1467-507
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. Updated European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Executive summary. Eur Heart J 2017; 38:2137-49
- HOLBROOK A, SCHULMAN S, WITT DM, et al. Evidence-based management of anticoagulant therapy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2):e152S-e184S
- KAATZ S, KOUIDES PK, GARCIA DA ; et al. Guidance on the emergent reversal of oral thrombin and factor Xa inhibitors. Am J Hematol 2012 ; 87:S141-S145
- KOVAKS RJ, FLAKER GC, SAXONHOUSE SJ, et al. Practical management of anticoagulation in patients with atrial fibrillation. J Am Coll Cardiol 2015; 65:1340-60
- KOZEK-LANGENECKER SA, AHMED AB, AFSHARI A, et al. Management of severe perioperative bleeding: Guidelines from the European Society of Anaesthesiology. First update 2016. Eur J Anaesthesiol 2017; 34:332-95
- KUMAR R, SMITH RE, HENRY BL. A review and recommendations for the management of patients with life-threatening dabigatran-associated hemorrhage: A single-center university hospital experience. J Intensive Care Med 2015; 30:462-72
- LAULICHT B, BAKHRU S, JIANG X. Antidote for new oral anticoaulants: mechanism of action and binding specificity of PER977. J Thromb Haemost 2013; 11:75
- LEVI M, LEVY JH, ANDERSEN HF, et al. Safety of recombinant activated factor VII in randomized clinical trials. N Engl J Med 2010 ; 363 : 1791-800
- LEVI M, MOORE KT, CASTILLEJOS CF, et al. Comparison of three-factor and four-factor prothrombin complex concentrates regarding reversal of the anticoagulant effects of rivaroxaban in healthy volunteers. J Thromb Haemost 2014; 12:1428-36
- LU G, DEGUZMMAN FR, HOLLENBACH SJ, et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med 2013; 19:446-53
- MAJEED A, SCHULMAN S. Bleeding and antidotes in new oral anticoagulants. Best Pract Res Clin Haematology 2013 ; 26 :191-202
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- MUECK W, SCHWERS S, STAMPFUSS J. Rivaroxaban and other novel oral anticoagulants : pharmacokinetics in healthy subject, specific patient populations and relevance of coagulation monitoring. Thrombosis Journal 2013; 11: 10
- PERZBORN E, HEITMEIER S, LAUX V, BUCHMULLER A. Reversal of rivaroxaban-induced anticoaguéation with prothrombin complex concentrate, activated prothrombin complex concentrate and recombinant activated factor VII in vitro. Thrombos Res 2014 ; 133 :671-81
- POLLACK CV, REILLY PA, VAN RYN J, et al. Idarucizumab for dabigatran reversal – Full cohort analysis. N Engl J Med 2017; 377:431-41
- PURRUCKER JC, STEINER T. Management of acute stroke in patients on oral anticoagulants. Curr Op Neurol 2017; 30:1-7
- RAMIREZ RJ, SPINELLA PC, BOCHICCHIO GV. Tranexamin acid update in trauma. Crit Care Clin 2017; 33:85-99
- RUFF CT, GIUGLIANO RP, BRAUNWALD E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomized trials. Lancet 2014; 383:955-62
- RUFF CT, GIUGLIANO RP, ANTMAN EM. Management of bleeding with non-vitamin K antagonist oral anticoagulants in the era of specific reversal agents. Circulation 2016; 134:248-61
- SCHIELE F, VAN RYN J, Canada K, et al. A specific antidote for dabigatran : functional and structural characterization. Blood 2013; 121:3554-62
- SIEGAL DM, CURNUTTE JT, CONNOLLY SJ, et al. Andexanet alfa for reversal of factor Xa inhibitor activity. N Engl J Med 2015; 373:2413-24
- SINGER AJ, QUINN A, DASGUPTA N, et al. Management and outcomes of bleeding events in patients in the emergency department taking warfarin or a non-vitamin K antagonist oral anticoagulant. J Emerg Med 2017; 52:1-7
- SPAHN DR, BEER JH, BORGEAT A, CHASSOT PG, et al. New oral anticoagulants in anesthesiology. Transf Med Hemother 2019; 46:282-93
- SPAHN DR, KORTE W. Novel oral anticoagulants. New challenges for anesthesiologists in bleeding patients. Anesthesiology 2012 ; 116 :9-11
- TAFUR AJ, WYSOKINSKI WE, McBANE R, et al. Cancer effect on periprocedural thromboembolism and bleeding in anticoagulated patients. Ann Onc 2012; 23:1998-2005
- TOTH P, MAKRIS M. Prothrombin complex concentrate-related thrombotic risk following anticoagulation reversal. Thromb Haemost 2012; 107:599
- TUMMALA R, KAVTARADZE A, GUPTA A, GHOSH RK. Specific antidotes against direct oral anticoagulants: A comprehensive review of clinical trials data. Int J Cardiol 2016; 214:292-8
- WEBER CF, DIETRICH W, SPANNAGL M, et al. A point-of-care assessment of the effects of desmopressin on impaired platelet function using Multiple Electrode whole-blood Aggregometry in patients after cardiac surgery. Anesth Analg 2010 ; 110 :702-7
- WEITZ JI, POLLACK CV. Practical management of bleeding in patients receiving non-vitamin K antagonists oral anticoagulants. Thromb Haemost 2015; 114:1113-26
- WEITZ JI, QUINLAN DJ, EIKELBOOM JW. Periprocedural management and approach to bleeding in patients taking dabigatran. Circulation 2012; 126:2428-32
- ZAHIR H, BROWN KS, VANDELL AG, et al. Edoxaban effects on bleeding following punch biopsy and reversal by 4-factor prothrombin complex concentrate. Circulation 2015 ; 131:82-90
