L’ETO diagnostique l’étiologie d’un effondrement hémodynamique peropératoire dans les trois quarts des cas, de manière peu invasive et sans avoir à déplacer le malade; le traitement prévu est modifié dans un tiers des cas sur les données de l'écho [6,15,29,34]. Le taux de découverte fortuite allant de 3% à 20%, il est de première importance de toujours réaliser un examen complet, même en urgence [31]. Avec un peu d’expérience, un examen rapide peut être conduit en moins de 3 minutes en suivant les schémas des Figures 25.147, Figures 25.148 et Figures 25.149. Après avoir réalisé ces 12 vues et avoir acquis une vue d’ensemble de la situation cardiologique, on porte son attention sur les points spécifiques susceptibles d’apporter la réponse à la question en suspens. Les principaux diagnostics différentiels facilités par l’ETO sont l’insuffisance ventriculaire, l’hypovolémie, l’obstruction dynamique de la CCVG, le syndrome coronarien aigu, la tamponnade, l’embolie pulmonaire ou la décompensation d’une valvulopathie.
Défaillance ventriculaire
La défaillance peut porter sur le ventricule gauche, le ventricule droit ou les deux (Vidéo). L'image écho-cardiographique de l'insuffisance gauche aiguë est caractéristique.
Vidéo: insuffisance biventriculaire; les 4 cavités sont dilatées; les 2 ventricules sont hypocontractiles et arrondis, le septum est dyskinétique. L'échelle permet d'apprécier l'augmentation de volume du coeur puisque l'apex est à 14 cm de l'oesophage.
Défaillance ventriculaire
La défaillance peut porter sur le ventricule gauche, le ventricule droit ou les deux (Vidéo). L'image écho-cardiographique de l'insuffisance gauche aiguë est caractéristique.
Vidéo: insuffisance biventriculaire; les 4 cavités sont dilatées; les 2 ventricules sont hypocontractiles et arrondis, le septum est dyskinétique. L'échelle permet d'apprécier l'augmentation de volume du coeur puisque l'apex est à 14 cm de l'oesophage.
- La différence de position des parois en télédiastole et en télésystole est faible, la contractilité est diminuée (FE < 0.35), l'épaississement de paroi en systole est minime;
- Le VG est dilaté et arrondi dans la mesure où il souffre d'une insuffisance chronique;
- Le débattement des feuillets mitraux au cours du cycle cardiaque est faible;
- La présence de contraste spontané dans l'OG et/ou le VG signe un bas débit;
- L'apparition ou l'aggravation d'une insuffisance mitrale de type restrictif traduit l'excès de tension sur les cordages en systole qui empèche les feuillets de rejoindre leur point de coaptation et les maintient en-dessous du plan de l'anneau mitral à cause de la faible contraction de la paroi ventriculaire où sont implantés les piliers.
L'insuffisance droite aiguë présente des images analogues pour le ventricule droit (Figure 25.241).
- La dilatation du VD est immédiate lorsqu'il faiblit face à une surcharge de volume (insuffisance tricuspidienne, shunt G-D, assistance ventriculaire gauche) ou de pression (embolie pulmonaire, crise d'hypertension pulmonaire); il peut aussi s'agir d'une baisse de contractilité (ischémie, sepsis). Sa surface devient équivalente ou supérieure à celle du VG dans la vue 4-cavités.
- Le septum interventriculaire bombe vers la gauche en diastole (surcharge de volume) et/ou en systole (surcharge de pression).
- La dilatation et la non-pulsatilité respiratoire de la veine cave inférieure traduit l'élévation de la pression auriculaire droite.
- La contractilité de la paroi est faible; elle est évaluée au niveau de la paroi libre, car la chambre d'admission et l'apex partagent des fibres circulaires avec le VG et conservent une contraction supérieure au reste du VD en cas de défaillance; d'autre part, la CCVD possède une contractilité supérieure au corps du ventricule [7].
- Présence ou aggravation d'une insuffisance tricuspidienne; la Vmax de l'IT permet le calcul de la PAPsyst: PAPs = 4 (Vmax IT)2 + POD.
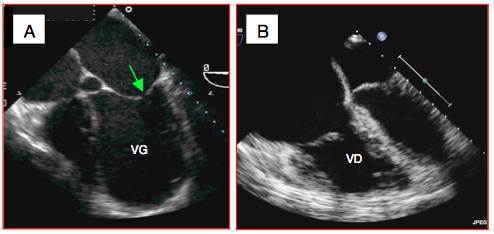
Figure 25.241 : Défaillance ventriculaire. A: défaillance du VG; le ventricule est dilaté, l'apex est arrondi, la paroi est mince. La valve mitrale n'occlut pas en systole (flèche) et son point de coaptation est situé en-dessous du plan de l'anneau. B: défaillance du VD; la surface du VD est supérieure à celle du VG en 4-cavités, l'OD est très dilatée, les cavités gauches sont comprimées; la paroi du VD est hypertrophiée, traduisant une surcharge de pression chronique.
La présence d'une dysfonction diastolique est importante à connaître pour deux raisons: 1) elle implique une élévation de la PVC et de la PAPO pour les mêmes volumes de remplissage, donc la possibilité d'une hypovolémie à pression de remplissage normale; et 2) elle rend les mesures de flux inopérantes pour l'évaluation de la volémie [1].
Hypovolémie
L'hypovolémie est la cause la plus fréquente d'instabilité hémodynamique peropératoire (voir Chapitre 27, Evaluation de la volémie, où se trouvent toutes les illustrations concernant cette section). L'ETO est une technique privilégiée pour ce diagnostic, car son approche ne dépend pas de la compliance des cavités. En effet, la courbe de compliance, qui représente la relation pression/volume, est pratiquement horizontale à bas remplissage; les variations du volume se traduisent donc par des variations minimes ou nulles de la pression (PVC ou PAPO) (voir Figure 25.251). L'ETO offre quatre modalités différentes pour évaluer la volémie.
- Mesures bidimensionnelles; elles ont l'avantage d'être indépendantes de la compliance. En vue court-axe transgastrique, la surface télédiastolique (Std) du VG est directement proportionnelle au degré de remplissage du ventricule; une Std < 6.0 cm2/m2 (femme) ou < 7.0 cm2/m2 (homme) est en général un signe d'hypovolémie (Figure 25.242) [32]. Cette mesure est un excellent moyen pour suivre l'évolution d'un patient au cours d'une intervention, mais elle n'est pas un repère fiable en valeur absolue, car sa variation interindividuelle est très large: elle va de 7 à 20 cm2/m2 selon les patients [5]. Lorsque le volume ventriculaire est faible, le VG collabe sur lui-même en télésystole et les piliers peuvent se toucher (kissing papillary muscles), mais ce phénomène se rencontre également lorsque la postcharge est excessivement basse (vasoplégie) (Tableau 25.15) [19]. Le diamètre de la VCI est < 1.0 cm en respiration spontanée et < 1.5 cm sous ventilation en pression positive [36].
- Flux de remplissage; la vélocité d'un flux est proportionnelle au gradient de pression instantané entre la cavité d'amont et la cavité d'aval; elle tend à baisser lorsque la pression de remplissage diminue. Pour le VG, les flux de remplissage sont le flux veineux pulmonaire et le flux mitral. En hypovolémie, la POG diminue; de ce fait la Vmax de la composante systolique du flux veineux pulmonaire augmente (la POG est sa pression d'aval) et celle du flux mnitral E diminue (la POG est sa pression d'amont). Mais la mesure des flux est biaisée par deux phénomènes pour le diagnostic d'hypovolémie: 1) étant proportionnels à la pression, les flux sont liés au volume par la compliance, et 2) les flux sont intimement liés à la fonction diastolique et leurs variations sont indissociables des celles dues à la dysfonction diastolique. D'autre part, les mesures non-invasives de la POG comme le rapport E/E' (Vmax flux mitral / Vmax déplacement de l'anneau mitral) ont été conçues pour évaluer celle-ci lorsqu'elle est élevée, et ne sont pas valides lorsqu'elle est basse [3]. Les flux de remplissage sont donc des marqueurs inadéquats pour le diagnostic d'hypovolémie.
- Indices dynamiques sous ventilation en pression positive (VPP); comme il se trouve sur la partie ascendante de sa courbe de Starling, un malade hypovolémique accuse de larges variations de son volume systolique, donc de sa pression artérielle systolique, en relation avec les variations de pression endothoracique modifiant son retour veineux; l'amplitude de ces variations est directement proportionnelle au degré d'hypovolémie [24]. En ETO, il est facile de visualiser le flux à travers la valve aortique en vue transgastrique long-axe 120° ou en vue transgastrique profonde 5 cavités 0°; une variation respiratoire de la Vmax de ce flux > 15% est un signe d'hypovolémie [10,33]. En vue transgastrique long-axe 60-100° avec pivotement de la sonde vers la droite, il est possible de suivre l'évolution du diamètre de la veine cave inférieure en mode TM; une variation respiratoire en VPP > 15% est un marqueur d'hypovolémie [9,38]. Cette donnée est très utilisée pour le diagnostic d'hypovolémie en échocardiographie transthoracique par voie sous-xyphoïdienne, mais la valeur-seuil en ETT et respiration spontanée est une variation ≥ 50%. Cet indice n'est pas fiable en cas de syndrome du compartiment abdominal. La variation du diamètre de la veine cave supérieure est aisée à mesurer en ETO en vue court-axe de l'aorte ascendante 0°; elle est > 30% en l'hypovolémie [37]. Ces indices dynamiques impliquent toutefois un volume courant important (10-12 mL/kg) pour être pleinement valables.
- Mouvements du septum interauriculaire; la membrane de la fosse ovale est une structure souple et flaccide qui oscille librement en fonction des variations de la pression dans chaque oreillette. Elle subit deux oscillations au cours du cycle cardiaque: 1) pendant les pics de pression "a" et "v", le septum est poussé dans l'OD par la surpression physiologique de l'OG; 2) pendant les descentes "x" et "y" le septum est repoussé dans l'OG parce que la pression y est alors plus basse que dans l'OD. Lorsque les oreillettes manquent de volume, l'amplitude des oscillations de la membrane interauriculaire augmente: elle faseye librement entre deux cavités vides; cette amplitude est directement corrélée à la volémie [27]. En ventilation en pression positive et normovolémie, l'inspirium du respirateur comprime les poumons, pousse le sang dans l'OG et remplit suffisamment celle-ci pour tendre le septum et en effacer ses oscillations. En hypovolémie, au contraire, le volume est insuffisant pour remplir l'OG et le faseyement de la membrane interauriculaire continue aux deux temps du ventilateur; ce comportement est bien corrélé à l'hypovolémie (Vidéo et Figure 25.243) [16].
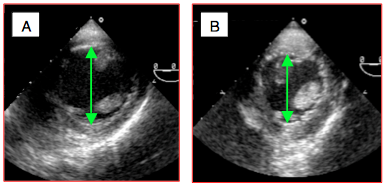
Figure 25.242 : Vue transgastrique court-axe du VG en télédiastole chez le même patient. A: le patient est normovolémique. B: le patient est hypovolémique; le diamètre a diminué.
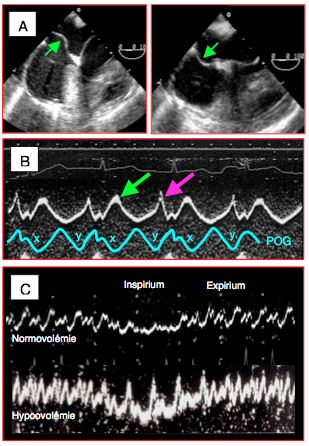
Figure 25.243 : Signes d'hypovolémie au niveau du septum interauriculaire. A: grande amplitude de débattement de la membrane de la fosse ovale au cours des oscillations physiologiques pendant le cycle cardiaque (ce septum n'est pas anévrysmal). B: oscillations du septum interauriculaire en mode TM; le septum bascule normalement dans l'OG au cours de la descente "x" en systole et au cours de la descente "y" en diastole, lorsque la pression est plus basse dans l'OG que dans l'OD. C: au cours du cycle respiratoire en ventilation en pression positive, l'amplitude des oscillations septales est très diminuée pendant l'inspirium. En hypovolémie, elles sont plus amples et continuent aux deux temps respiratoires.
Vidéo: vue 4-cavités centrée sur les oreillettes montrant la grande amplitude des oscillations cardiogéniques du septum interauriculaire en cas d'hypovolémie.

Sténose dynamique de la chambre de chasse
La sténose sous-aortique dynamique, communément appelée "effet CMO" par analogie à la cardiomyopathie obstructive, est un phénomène lié à l'hypovolémie que seule l'échocardiographie peut diagnostiquer (voir Chapitre 13, Cardiomyopathie hypertrophique) [12]. En effet, elle se présente comme une hypotension réfractaire à pression de remplissage élevée empirant avec les agents inotropes. Normalement, la zone de coaptation des feuillets mitraux est maintenue éloignée postérieurement de la chambre de chasse, mais elle peut être déplacée antérieurement par une diminution du volume de la cavité ventriculaire en systole (hypovolémie, HVG concentrique, vasoplégie), par une course excessive de la paroi postérieure (stimulation béta) ou par une restriction de l'anneau mitral (après plastie chirurgicale). Ceci a plusieurs effets en systole [13].
- Le point d'occlusion de la valve mitrale est déplacé antérieurement; il se situe entre l'extrémité du feuillet postérieur et le corps du feuillet antérieur; la surface d'occlusion des feuillets est perdue.
- La partie distale du feuillet antérieur flotte dans la cavité ventriculaire en systole.
- Cette partie libre est déplacée en direction de la CCVG lorsque la pression s'élève dans le VG en protosystole.
- Le feuillet mitral antérieur est aspiré dans la CCVG par effet Venturi lorsque l'éjection commence.
- La valve mitrale s'ouvre en mésosystole: IM méso-télésystolique.
- Le volume systolique chute en méso-systole au point qu'il n'est plus suffisant pour maintenir la valve aortique ouverte: les cuspides collabent dès la mi-systole. Au Doppler spectral, la partie ascendante de la courbe de flux subit une cassure et l'enveloppe se rétrécit (image "en dague").
Le résultat est une subobstruction de la CCVG par l'extrémité distale du feuillet antérieur appelée SAM (systolic anterior motion). Le diagnostic échocardiographique se base sur plusieurs points (Vidéo et Figure 25.244) [12].
- Image du SAM en vue 4-cavités ou 5-cavités 0-30° ou long-axe 120° de la CCVG: la partie distale du feuillet antérieur est coudée et vient obstruer la CCVG;
- Vmax du flux dans la CCVG > 2.5 m/s;
- Déformation "en dague" (dagger-shape) du flux aortique au Doppler spectral;
- IM méso-télésystolique;
- Collapsus méso-télésystolique des cuspides aortiques en mode TM à partir d'une vue court-axe 40° ou long-axe 120° de la valve aortique; cette image est la plus pathognomonique et sert de critère thérapeutique.
Vidéo: subobstruction de la chambre de chasse gauche par la partie distale du feuillet mitral antérieur (SAM) dans un cas d'HVG et d'hypovolémie sévère (vue long-axe 140° de la CCVG).
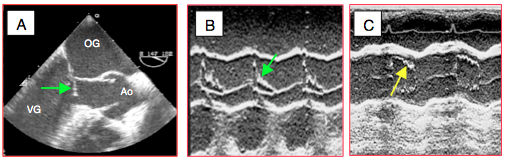
Figure 25.244 : Sténose dynamique de la chambre de chasse gauche. A: image de SAM (systolic anterior motion) du feuillet antérieur de la valve mitrale venant obstruer la CCVG en cours de systole (vue long-axe du VG 140°). B: collapsus des cuspides aortiques en mode TM de la valve aortique à 40° ou 120° (flèche verte); il est dû à la chute du volume systolique lorsque l'obstruction dynamique débute en mésosystole. C: après traitement (volume, vasopresseur, béta-bloqueur), le SAM a disparu et la valve aortique reste ouverte pendant toute la durée de la systole (flèche jaune).
L'"effet CMO" survient en général sur une combinaison de différents éléments: cavité du VG de petite taille (HVG concentrique), hypovolémie, baisse de postcharge (vasoplégie, status post-RVA pour sténose), sur-stimulation béta-adrénergique, status après plastie mitrale restrictive. L'ETO permet de réorienter la prise en charge: augmentation de la volémie (perfusions), augmentation des RAS (vasoconstricteur alpha), et baisse de la stimulation béta (stop catécholamines, béta-bloqueur).
Ischémie aiguë
L'ETO permet de mettre en évidence plusieurs phénomènes liés à une ischémie et occasionnant une hypotension ou un choc cardiogène à l'occasion d'un syndrome coronarien aigu.
- Altérations majeures de la cinétique segmentaire (ACS); une diminution de 50% du flux coronarien provoque une hypokinésie, un infarcissement de > 35% de l'épaisseur de paroi induit une akinésie. Les ACS ne sont clairement visibles que dans des occlusions ou subocclusions tronculaires; une ischémie sous-endocardique diffuse n'a pas de traduction sur la cinétique segmentaire. Les ACS se caractérisent par la réduction de la contraction radiaire et par celle de l’épaississement de paroi ; ce dernier est le paramètre le plus discriminant pour l’ischémie segmentaire (Vidéo). L'absence d'ACS n'exclut pas le diagnostic d'ischémie active.
- Insuffisance mitrale; l'ischémie myocardique donne souvient lieu à une IM dans laquelle les feuillets de la valve sont normaux. La régurgitation est la traduction d'un problème sous-jacent dans le ventricule. Cette IM relève de plusieurs mécanismes (Vidéo et Figure 25.227) [30].
- Restriction asymétrique des feuillets sur akinésie pariétale locale;
- Restriction symétrique des feuillets sur cardiomyopathie ischémique dilatée;
- Rupture partielle ou totale de muscle papillaire;
- Dilatation de l'anneau mitral sur akinésie basale.
- Rupture pariétale sur occlusion totale d'un vaisseau non-collatéralisé; la survie n'est possible que si le péricarde est cloisonné et contient localement la tamponnade.
- Rupture du septum interventriculaire et CIV aiguë.
- Cardiomyopathie de stress ou maladie de Takotsubo avec ballonisation apicale (2% des cas).
Vidéo: akinésie latérale complète suite à une occlusion de l'artère circonflexe.
Vidéo: insuffisance mitrale restrictive due à la déformation du VG par une akinésie antéro-latérale.
Tamponnade
L'accumulation liquidienne dans le péricarde est bien visible à l'ETO. Elle s'accompagne de quelques signes classiques de compression des chambres cardiaques (Vidéos et Figure 25.245) [21,28].
L'accumulation liquidienne dans le péricarde est bien visible à l'ETO. Elle s'accompagne de quelques signes classiques de compression des chambres cardiaques (Vidéos et Figure 25.245) [21,28].
- Epaisseur de l'épanchement; il est sévère lorsqu'elle est > 2 cm;
- Danse du cœur au sein de l'épanchement;
- Collapsus des parois de l'OD (télédiastole), de l'OG (télédiastole) et du VD (protodiastole); le collapsus auriculaire est très sensible mais peu spécifique, le collapsus du VD est moins sensible mais plus spécifique.
- Variation respiratoire du flux mitral > 25%.
Vidéo: épanchement liquidien circonférentiel en vue 4-cavités; le coeur donne l'impression de "danser" dans le liquide; la compression porte surtout sur l'OG.
Vidéo: épanchement liquidien circonférentiel en vue court-axe transgastrique; le VG flotte sur le liquide.
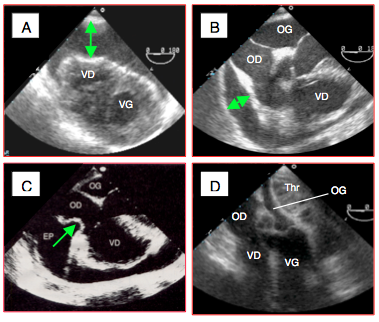
Figure 25.245 : Tamponnade. A: vue transgastrique d'un épanchement sanguin de > 2 cm après un traumatisme thoracique. B: épanchement circonférentiel en vue 4-cavités. C: invagination de la paroi de l'OD. D: thrombus (Thr) postopératoire comprimant l'OG.
La situation postopératoire est différente parce que le liquide clair est remplacé par du sang partiellement coagulé, des caillots et de la fibrine. De ce fait, la danse du cœur est absente et le collapsus pariétal rarement présent; la compression est localisée à une seule cavité dans la moitié des cas [2]. D'autre part, la variation respiratoire excessive du flux mitral est normalisée en ventilation mécanique [8]. Comme un thrombus peut se cacher n'importe où dans le péricarde, particulièrement dans les zones déclives postéro-inférieures chez un malade couché, il est capital d'explorer le cœur sous tous les angles, en vues mi-oesophagiennes, transgastriques et basales. Après la chirurgie des gros vaisseaux, les caillots peuvent se former autour de l'aorte et de l'artère pulmonaire et comprimer cette dernière ou le toit de l'OG. Souvent, la lésion n'est pas visible en vue 4-cavités (voir Chapitre 27 Tamponnade).
Embolie pulmonaire
L'échocardiographie n'est pas le moyen qui permet d'affirmer ou d'exclure une embolie pulmonaire; sa sensibilité pour le diagnostic ne dépasse pas 60-70% et sa spécificité 80-90% [25,34]. Mais il offre un certain nombre d'éléments permettant de suspecter le diagnostic, pour autant que l'obstruction au flux pulmonaire soit supérieure à 30% de l'arbre artériel (Vidéos et Figure 25.246) [14].
- Dilatation aiguë du VD, déplacement du septum interauriculaire dans l'OG et du septum interventriculaire dans le VG (forme en "D" du VG en court-axe); rapport des surfaces VD/VG en 4-cavités > 0.9 [11]. L'absence de ces signes de surcharge de pression exclut pratiquement une embolie massive.
- Hypokinésie de la paroi libre avec préservation de la contractilité apicale (signe de McConnell) [18,22].
- Présence de thrombus en transit dans les cavités droites et/ou dans l'AP (tronc de l'AP ou AP droite proximale) dans 25 à 55% des cas [26]; leur absence n'exclut aucunement le diagnostic. Le thrombus est une masse d'échogénicité voisine de celle du myocarde, flottant dans le courant sanguin ou partiellement attachée à la paroi, et visible sous de multiples angles de vue. En présence d'un FOP, la soudaine augmentation de pression dans l'OD peut propulser un thrombus à travers le septum interauriculaire et causer une embolie systémique catastrophique.
- Insuffisance tricuspidienne avec une Vmax de 3.0-4.0 m/s, correspondant à une PAPsyst de 40-60 mmHg; une pression supérieure signe une hypertrophie droite et un processus chronique.
- Phase d'accélération du flux dans l'AP réduite à 85 ms (valeur normale 120 ms) [14].
- Présence du signe "60/60": la durée d'accélération du flux systolique de l'AP voisine 60 ms et le gradient de pression de l'insuffisance tricuspidienne est proche de 60 mmHg, ce qui est la pression maximale que peut développer un VD normal de manière aiguë.
Vidéo: vue 4-cavités au cours d'embolie pulmonaire massive; le VD et l'OD sont dilatés, les septa interventriculaire et interauriculaire sont bombés dans les cavités gauches, qui sont comprimées et très réduites en volume.
Vidéo: gros embol en transit dans l'OD lors d'une embolie pulmonaire massive (vue 4-cavités basse); il est situé devant la valve tricuspide.
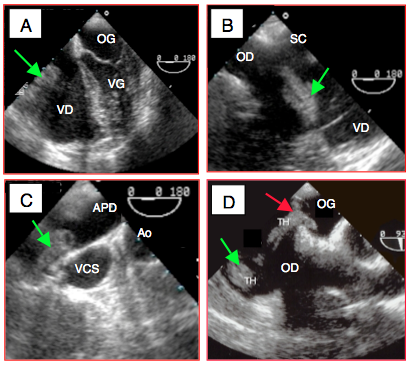
Figure 25.246 : Embolie pulmonaire. A: dilatation massive du VD et de l'OD, le VG est comprimé, l'apex est formé par le VD; thombus dans l'OD (flèche). B: thrombus en transit dans l'OD. C: thrombus dans l'AP droite; cette image n'est pas toujours visible. D: thrombus enclavé dans un foramen ovale perméable et prêt à basculer dans l'OG (flèche rouge).
En peropératoire, les embols ne sont pas que de nature thrombogène. Ils peuvent avoir d'autres origines (Vidéos et Figure 25.247).
- Embolie graisseuse; particulièrement fréquente pendant le fraisage et l'enclouage d'os longs comme le fémur en cas de fracture pathologique.
- Embolie gazeuse en neurochirurgie en position assise (fosse postérieure).
- Embolie gazeuse par introduction accidentelle d'air en voie veineuse.
Vidéo: embol graisseux tournoyant dans l'OD lors d'une pose de prothèse de hanche.
Vidéo: embolie gazeuse lors de chirurgie de la fosse postérieure en position assise.
Vidéo: embolie gazeuse massive sur introduction accidentelle d'air par une voie veineuse sous pression.
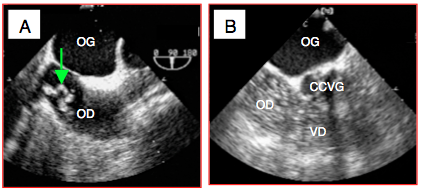
Figure 25.247 : Embolies peropératoires. A: embolie graisseuse au cours d'un enclouage du fémur pour fracture pathologique; présence d'un gros embol lipidique qui tournoie dans l'OD. B: embolie gazeuse par injection accidentelle d'air depuis une voie veineuse périphérique; les cavités droites sont remplis de bulles, mais l'OG en est libre car tout a pu être filtré dans les poumons.
Valvulopathie décompensée
Une valvulopathie pré-existante peut occasionner une décompensation ventriculaire soudaine. En cas de choc cardiogène, les souffles baissent d'intensité à l'auscultation, même si la sténose ou l'insuffisance est sévère. L'échocardiographie est très utile pour pointer le diagnostic de décompensation valvulaire aiguë (Figure 25.248) [17].
- Rupture de cordage dans une maladie de Barlow et apparition soudaine du basculement d'un feuillet dans l'OG (flail leaflet) avec une insuffisance mitrale majeure et excentrique. L'insuffisance est sévère si la vena contracta est > 7 mm et la surface de l'orifice de régurgitation > 40 mm2.
- Rupture partielle ou totale de muscle papillaire sur infarctus antérieur ou inférieur et IM massive; présence d'un fragment de pilier à l'extrémité de cordages oscillant entre le VG et l'OG (Vidéo). La largeur de l'orifice de régurgitation et la défaillance du VG font que la Vmax de l'IM est basse et que le flux couleur sous-estime largement son importance.
- Insuffisance aortique massive sur destruction de la valve aortique par une endocardite (Vidéo). L'insuffisance est sévère si la vena contracta est > 6 mm et la surface de l'orifice de régurgitation > 30 mm2.
- Fuite paravalvulaire sur une prothèse; le jet de régurgitation est situé en-dehors de l'anneau de la prothèse; la régurgitation est sévère si l'orifice représente > 20% de la circonférence de la valve.
Vidéo: rupture totale du muscle papillaire antérieur causant un basculement complet des feuillets mitraux dans l'OG en systole; on voit un morceau de pilier osciller à l'extrémité du feuillet antérieur.
Vidéo: insuffisance aortique massive remplissant tout le VG en diastole sur destruction de la valve par une endocardite aiguë.
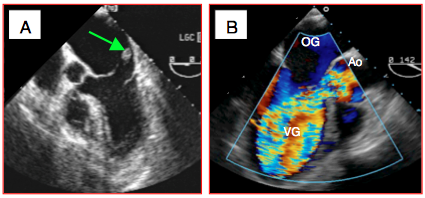
Figure 25.248 : Exemples de valvulopathies décompensées. A: rupture de pilier mitral occasionnant une IM massive; la tête du pilier antérieur flotte au bout du feuillet basculé dans l'OG en systole. B: insuffisance aortique massive sur endocardite aiguë; l'IA remplit la quasi-totalité du VG en diastole (la valve mitrale est ouverte).
L'insuffisance valvulaire aiguë n'est pas accompagnée par une dilatation de la chambre de réception comme c'est le cas dans les lésions chroniques; la pression dans cette chambre (POG ou PtdVG) est donc beaucoup plus élevée [17]. Une flambée d'endocardite peut non seulement léser gravement une valve, mais elle peut encore occasionner des fuites majeures par un abcès périvalvulaire ou par des perforations au sein des feuillets. Un abcès péri-aortique peut créer un shunt gauche-droit en fuyant dans l'OD ou le VD.
Douleur thoracique
L'ETO ouvre la voie du diagnostic différentiel des douleurs thoraciques accompagnées d'hypotension sévère ou de choc cardiogène. A côté du syndrome coronarien aigü sous ses diverses formes (STEMI, N-STEMI, angor instable), il existe d'autres pathologies dont la mise en évidence est capitale car leur traitement est foncièrement différent (Vidéo et Figure 25.249).
- Dissection aortique: présence d'une membrane flottant dans l'aorte ascendante (flap) avec des points de rupture (passage de la vraie à la fausse lumière au Doppler couleur). L'écho permet d'évaluer l'extension de la lésion dans l'aorte descendante, et la différenciation de la vraie lumière (expansion en systole, flux rapide) par rapport à la fausse lumière (flux lent, contraste spontané ou thrombus, en général plus grande).
- Anévrysme aortique en voie de rupture: dilatation de l'aorte (diamètre de l'ascendante > 5 cm, diamètre de la crosse > 4 cm, diamètre de la descendante > 3.5 cm), flux ralenti (contraste spontané), tamponnade.
- Hématome intramural: épaississement de la paroi aortique avec cavité et thrombus.
- Athérome térébrant: plaque athéromateuse ulcéreuse pénétrant dans la paroi aortique.
- Péricardite aiguë: épaississement échogène du péricarde, signes de compression des chambres cardiaques.
Vidéo: dissection A dont la déchirure (flap) située dans l'aorte ascendante bascule à travers la valve aortique en diastole.
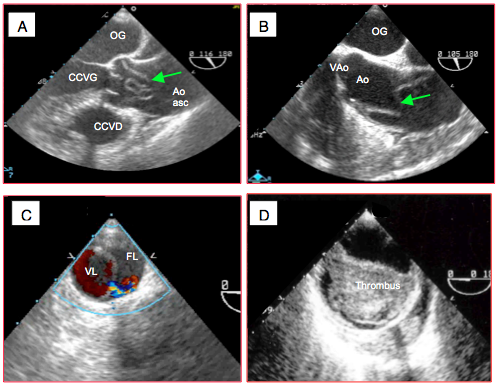
Figure 25.249 : Pathologies aortiques aiguës. A et B: vues d’une dissection A de l’aorte ascendante; la flèche verte indique la membrane (flap) qui flotte dans la lumière aortique. C: dissection de l'aorte descendante; en systole, on aperçoit un passage de sang (jet de couleur) entre la vraie lumière (VL) et la fausse lumière (FL), dans laquelle le flux est lent (présence de contraste spontané indiquant la stase). D: anévrysme de l'aorte descendante (diamètre 6.5 cm) avec thrombus intraluminal.
Arrêt cardiaque
L'ETO présente l'immense avantage de pouvoir se dérouler au cours d'un massage cardiaque externe (MCE) sans gêner les réanimateurs, alors que la voie transthoracique n'est possible qu'en vue sous-xyphoïdienne ou en interrompant les compressions sternales; d'autre part, les images transoesophagiennes sont d'excellente qualité, alors que celles prise de l'extérieur sont en général médiocres. De ce fait, l'examen échocardiographique permet de poser un diagnostic étiologique dans 64% des situations et de modifier la décision thérapeutique dans 30% des cas [23]. En observant la contraction propre des ventricules pendant la réanimation, il permet de différencier une asystolie totale d'une dissociation électro-mécanique et d'une défaillance systolique avec faible contractilité résiduelle. Ce diagnostic différentiel est important car la mortalité de la première situation voisine 100%; l'écho permet d'interrompre la réanimation lorsque les circonstances sont sans espoir [4]. Dès que l'hémodynamique est rétablie après un arrêt sur tachycardie ou fibrillation ventriculaire, il est recommandé de rechercher des anomalies de la cinétique segmentaire ou des lésions structurelles comme une cardiomyopathie obstructive susceptibles d'expliquer l'arythmie [20]. Mais le bas débit hémodynamique peut à lui seul induire des pathologies qui sont sans rapport avec la cause de l'arrêt: présence de thrombus intracardiaque dû à la stagnation du sang ou altérations de la cinétique segmentaire liées à la désorganisation rythmique, par exemple [35]. Plusieurs causes potentiellement réversibles sont aisément mises en évidence par l'ETO [20].
- Défaillance totale du VG et/ou du VD.
- Tamponnade; l'épanchement péricardique est situé entre le cœur et l'aorte descendante, alors que l'épanchement pleural est antéro-latéral par rapport à celle-ci.
- Embolie pulmonaire; dilatation et défaillance du VD accompagnée ou non de la présence de thrombus en transit dans les cavités droites et l'AP.
- Pneumothorax sous tension; un drainage immédiat s'impose.
- Hypovolémie sévère; c'est plutôt un diagnostic par exclusion face à des cavités cardiaques qui paraissent vides.
- Pathologies secondaires à une ischémie aiguë: rupture myocardique, rupture de muscle papillaire, CIV. Ces lésions ne sont pas faciles à diagnostiquer et à localiser dans les conditions d'une réanimation, mais leur prise en charge chirurgicale rapide est souvent la seule chance de survie.
L'observation du cœur à l'écran montre en outre le degré d'efficacité du MCE. En général, le ventricule droit est correctement vidé par la compression sternale et le flux pulmonaire bien maintenu. Mais la situation est différente pour le ventricule gauche; il présente habituellement peu de variations de volume entre la compression et le relâchement, et la valve mitrale ne se ferme pas correctement au cours de la pseudo-systole. Le pouls palpé en périphérie est souvent dû à l'effet de la compression thoracique sur le volume intrathoracique plutôt qu'à un effet propulsif depuis le VG (Vidéo).
Vidéo: enregistrement ETO peropératoire au cours du massage cardiaque externe d'un malade souffrant d'un infarctus massif du VG (obstruction du tronc commun). La compression sternale est efficace sur le VD, mais non sur le VG, qui est inerte et dont les feuillets mitraux ne bougent pas (absence de débit).
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
Vidéo: enregistrement ETO peropératoire au cours du massage cardiaque externe d'un malade souffrant d'un infarctus massif du VG (obstruction du tronc commun). La compression sternale est efficace sur le VD, mais non sur le VG, qui est inerte et dont les feuillets mitraux ne bougent pas (absence de débit).
| ETO et instabilité hémodynamique |
| Même en urgence et même en limitant le nombre de vues, l'examen doit toujours être complet. L'ETO est particulièrement utile pour le diagnostic différentiel de l'état de choc: - Décompensation ventriculaire droite ou gauche - Hypovolémie - Obstruction sous-aortique dynamique - Tamponnade - Valvulopathie aiguë décompensée - Embolie pulmonaire - Ischémie aiguë - Dissection ou rupture aortique - Diagnostic différentiel des douelurs thoraciques avec effondrement hémodynamique |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- ARQUES S, ROUX E, LUCCIONI R. Current clinical applications of spectral tissue Doppler echocardiography (E/E’ ratio) as a noninvasive surrogate of left ventricular diastolic pressures in the diagnosis of heart failure with preserved left ventricular systolic function. Cardiovasc Ultrasound 2007; 5:16
- BOMMER WJ, FOLLETTE D, POLLOCK M, et al. Tamponade in patients undergoing cardiac surgery: A clinical-echocardiographic diagnosis. Am Heart J 1995; 130:1216-23
- BREITKREUZ R, WALCHER F, SEEGER SH. Focused echocardiographic evaluation in resuscitation management: Concept of an advanced life support-conformed algorithm. Crit Care Med 2007; 35(Suppl):S150-S161
- CHARDOLI M, HEIDARI F, RABIEE H, et al. Echocardiography integrated ACLS protocol versus conventional cardiopulmonary resuscitation in patients with pulseless electrical activity cardiac arrest. Clin J Traumatol 2012; 15:284-7
- CHEUNG AT, SAVINO JS, WEISS SJ, et al. Echocardiographic and hemodynamic indexes of left ventricular preload in patients with normal and abnormal ventricular function. Anesthesiology 1994; 81:376-87
- COLREAVY FB, DONOVAN K, LEE KY; et al. Transesophageal echocardiography in critically ill patients. Crit Care Med 2002; 30:989-96
- DENAULT AY, HADDAD F, JACOBSOHN E, et al. Perioperative right ventricular dysfunction. Curr Opin Anaesthesiol 2013; 26:71-81
- FAEHNRICH JA, NOONE RB, WHITE WD, et al. Effects of positive-pressure ventilation, pericardial effusion, and cardiac tamponade on respiratory variation in transmitral flow velocities. J Cardiothorac Vasc Anesth 2003; 17:45-50
- FEISSEL M, MICHARD F, FALLER JP, TEBOUL JL. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med 2004; 30:1834-7
- FEISSEL M, MICHARD F, MANGIN I, et al. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock. Chest 2001; 119:867-73
- FRÉMONT B, PACOURET G, JACOBI D, et al. Prognostic value of echocardiographic right/left ventricular end-diastolic diameter ratio in patients with acute pulmonary embolism: results from a monocenter registry of 1,416 patients. Chest 2008; 133:358-62
- HYMEL BJ, TOWNSLEY MM. Echocardiographic assessment of systolic anterior motion of the mitral valve. Anesth Analg 2014; 118:1197-201
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- KJAERGAARD J, SCHAADT BK, LUND JO, et al. Quantification of right ventricular function in acute pulmonary embolism: relation to extent of pulmonary perfusion defects. Eur J Echocardiogr 2008; 9:641-5
- KNEESHAW JD. Transoesophageal echocardiography (TOE) in the operating room. Br J Anaesth 2006; 97:77-84
- KUSOMOTO FM, MUHIUDEEN IA, KUECHERER HF, et al. Response of the interatrial septum to transatrial pressure gradients and its potential for predicting pulmonary capillary wedge pressure: an intraoperative study using transesophageal echocardiography in patients during mechanical ventilation. J Am Coll Cardiol 1993; 21:721-8
- LANCELLOTTI P, PRICE S, EDVARDSEN T, et al. The use of echocardiography in acute cardiovascular care: Recommendations of the European Association of CardioVascular Imaging and the Acute Cardiovascular Care Association. Eur Heart J Cardiovasc Imaging 2015; 16:119-46
- LAU G, THER G, SWANEVELDER J. McDonnell's sign in acute pulmonary embolism. Anesth Analg 2013; 116:982-5
- LEUNG JM, LEVINE EH. Left ventricular end-systolic cavity obliteration as an estimate of intraoperative hypovolemia. Anesthesiology 1994: 81:1102-9
- LEVITOV A, FRANKEL HL, BLAIVAS M, et al. Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients – Part II: Cardiac ultrasonography. Critical Care Med 2016; 44:1206-27
- MATERAZZO C, PIOTTI P, MEAZZA R, et al. Respiratory changes in transvalvular flow velocities versus two-dimensional echocardiographic findings in the diagnosis of cardiac tamponade. Ital Heart J 2003; 4:186-92
- McCONNEL MV, SOLOMON SD, RAYAN ME, et al. Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol 1996; 78:469-73
- MEMTSOUDIS SG, ROSENBERGER P, LOFFLER M, et al. The usefulness of transesophageal echocardiography during intraoperative cardiac arrest in noncardiac surgery. Anesth Analg 2006; 102:1653-7
- MICHARD F. Changes in arterial pressure during mechanical ventilation. Anesthesiology 2005; 103:419-28
- PRICE S, PLATZ E, CULLEN L, et al. Echocardiography and lung ultrasonography for the assessment and management of acute heart failure. Nat Rev Cardiol 2017; 14:427-40
- ROSENBERGER P, SHERNAN SK, BODY SC; et al. Utility of intraoperative transesophageal echocardiography for diagnosis of pulmonary embolism. Anesth Analg 2004; 99:12-6
- ROYSE CF, ROYSE AG, SOEDING PF, BLAKE DW. Shape and movement of the interatrial septum predicts change in pulmonary capillary wedge pressure. Ann Thorac Cardiovasc Surg 2001; 7:79-83
- SCHAIRER JR, BISWAS S, KETEYIAN SJ, et al. A systematic approach to evaluation of pericardial effusion and cardiac tamponade. Cardiol Rev 2011; 19:233-8
- SCHULMEYER MC, SANTELICES E, VEGA R, et al. Impact of intraoperative transesophageal echocardiography during noncardiac surgery. J Cardiothorac Vasc Anesth 2006; 20:768-71
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- SHILLCUTT SK, MARKIN NW, MONTZINGO CR, et al. Use of rapid „rescue“ perioperative echocardiography to improve outcomes after hemodynamic instability in noncardiac surgical patients. J Cardiothorac Vasc Anesth 2012; 26:362-70
- SKARVAN K, LAMBERT M, FILIPOVIC M, SEEBERGER M. Reference values for left ventricular function in subjects under general anesthesia and controlled ventilation assessed by two-dimensional traoesophageal echocardiography. Eur J Anaesthesiol 2001; 18:713-22
- SLAMA M, MASSON H, TEBOUL JL, et al. Respiratory variations of aortic VTI: A new index of hypovolemia and fluid responsiveness. Am J Physiol Heart Circ Phys 2002; 283:H1729-33
- SUBRAMANIAM B, KYUNG WP. Impact of TEE in noncardiac surgery. Int Anesthesiol Clin 2008; 46:121-36
- VAN DER WOUW PA, KOSTER RW, DELAMARRE BJ, et al. Diagnostic accuracy of transesophageal echocardiography during cardiopulmonary resuscitation. J Am Coll Cardiol 1997; 30:780-3
- VEGAS A, DENAULT A, ROYSE C. A bedside clinical and ultrasound approach to hemodynamic instability – Part II: bedside ultrasound in hemodynamic shock: continuing professional development. Can J Anaesth 2014; 61:1008-27
- VIEILLARD-BARON A, AUGARDE R, PRIN S, et al. Influence of superior vena caval zone condition on cyclic changes in right ventricular outflow during respiratory support. Anesthesiology 2001; 95:1083-8
- ZHANG Z, XU X, YE S, XU L. Ultrasonographic measurement of the respiratory variation in the inferior vena cava diameter is predictive of fluid responsiveness in critically ill patients: systemtic review and meta-analysis. Ultrasound Med Biol 2014; 40:845-53
