L'hémofiltration consiste à interposer dans le circuit de CEC un appareil constitué de fibres semi-perméables micropores contenues dans un cylindre (surface d’échange ≥ 1 m2). Ce système filtre l'eau, les électrolytes et les protéines les plus petites (poids moléculaire < 30-50 kDa) (Figure 7.14).
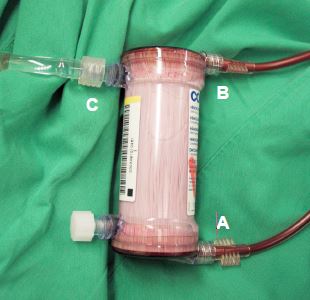
Figure 7.14 : Système d'hémofiltration. On distingue les tubules microporeux de filtration à l'intérieur de l'appareil. A: entrée du sang sous la pression du circuit artériel. B: sortie du sang hémofiltré vers le circuit veineux. C: hémofiltrat rejeté.
Le système repose sur le principe de la convection: c'est la pression hydrostatique, et non une différence de concentration, qui provoque les échanges à travers la membrane. Les plaquettes, l'albumine et les facteurs de coagulation sont conservés, alors que les médiateurs inflammatoires hydrosolubles (TNF, IL-6, IL-8, IL-10) et le complément (C3a, C5a) sont éliminés avec l’hémofiltrat qui est rejeté [2,6]. L'héparine est partiellement filtrée. Différents montages sont possibles (Figure 7.15).
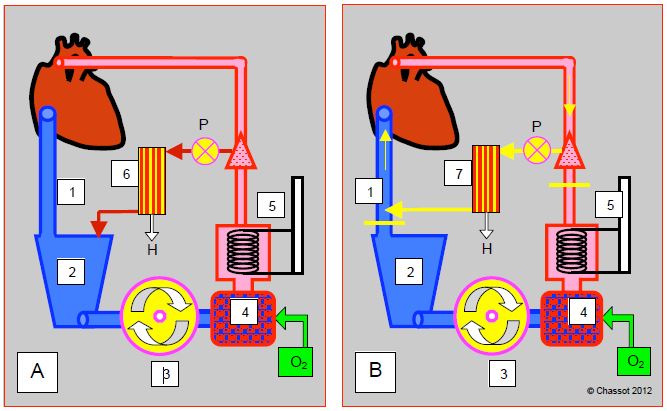
Figure 7.15 : Schéma des différents systèmes d'hémofiltration. A : hémofiltration conventionnelle en cours de CEC. Le sang est capté sur la ligne artérielle (avec ou sans pompe P), traverse l’hémofiltre (6) et retourne dans le réservoir veineux (2) ; H : hémofiltrat rejeté. B : hémofiltration modifiée post-CEC (MUF modified ultrafiltration). Le sang est capté sur la ligne artérielle (canule aortique), hémofiltré (7) et renvoyé dans la canule veineuse d’où il regagne l’OD. Deux clamps (traits jaunes) isolent ce circuit par rapport au réservoir veineux, à la pompe et à l’oxygénateur. La pompe P est facultative. 1 : canule veineuse. 2 : réservoir veineux. 3 : pompe principale. 4 : oxygénateur. 5 : échangeur thermique. 6 : hémofiltration conventionnelle en cours de CEC. 7 : hémofiltration modifiée artério-veineuse. H : hémofiltrat rejeté. P : pompe alimentant l’hémofiltrateur.
- Ultrafiltration conventionnelle (UFC); le sang est capté sur la ligne artérielle, habituellement avec l’aide d’une pompe, traverse l’hémofiltre et retourne dans le réservoir veineux; le débit est réglé de manière à ne pas amputer le débit artériel de CEC qui retourne au patient. Le système ne fonctione correctement que si le volume du réservoir veineux est suffisant. Même s’il réduit l’excédent liquidien total, son efficacité est limitée par la redilution au sein de la CEC du volume précédemment concentré.
- Ultrafiltration continue (UF à balance zéro : UFBZ); si l’on maintient l’ultrafiltration en continu pour extraire un maximum de déclencheurs inflammatoires, il faut remplacer le large volume hydro-électrolytique qui est hémofiltré par un apport équivalent pour assurer un volume circulant adéquat. On monte une pompe à double canal sur la sortie de l’hémofiltrat; elle assure simultanément l’éjection de l’hémofiltrat et l’apport de remplacement dans une proportion de 1/1. Ce système est utilisé essentiellement en pédiatrie [3].
- Ultrafiltration modifiée (UFM) (MUF modified ultrafiltration) mise en route après la fin de la CEC. Le sang est capté sur la ligne artérielle (canule aortique), aspiré par la pompe du circuit de l’UF (15-30 mL/kg/min), hémofiltré et renvoyé dans la canule veineuse d’où il regagne l’OD, parce que la canule veineuse en direction du réservoir est clampée. Le circuit du sang est réduit à : aorte – pompe d’UF – appareil d’UF – canule veineuse – OD. Le reste de la CEC (réservoir, pompe maîtresse, oxygénateur, etc) est hors-circuit. L’UFM retarde la décanulation et l’administration de la protamine d'environ 20 minutes en moyenne, et réclame beaucoup d’attention pour maintenir le remplissage de la CEC et la volémie du patient [5].
L'intérêt de la procédure est d'éliminer l'excès de liquide hydro-électrolytique comme le ferait un diurétique, et de rétablir l'hématocrite du patient. Le système permet de soustraire du volume circulant jusqu'à 180 mL par minute (4-5 L H2O par heure) pour un débit de 500 mL/min. Certains perfusats utilisés pour compenser les pertes liquidiennes contiennent beaucoup de lactate (Lactosol®); il est normal que la lactatémie du patient soit élevée en fin de CEC sans que cela représente une acidose métabolique.
L’hémofiltration corrige deux inconvénients majeurs de la CEC : l’excédent liquidien et le syndrome inflammatoire. Les indications préférentielles sont les situations où les capacités d'élimination hydrique des patients sont réduites, et les situations où l'accumulation d'eau et de Na+ est importante: longue CEC, bilan hydrique très positif en cours de CEC, insuffisance cardiaque congestive, insuffisance rénale, fonctions pulmonaires abaissées, malade en excès liquidien, jeunes enfants. Le délai pour l'extubation de ces derniers, leurs pertes sanguines et leur gradient alvéolé-capillaire sont très améliorés par l'hémofiltration [3]. Mais l’hémofiltration est de plus en plus vue comme un moyen de réduire la charge en déclencheurs inflammatoires, de diminuer le taux de transfusions et de freiner le développement des coagulopathies, de l’œdème interstitiel, de l’hypertension pulmonaire et de l’insuffisance multi-organique postopératoires [1,4,6].
| Hémofiltration |
|
Sous ses différentes formes, l’hémofiltration réduit l’excédent liquidien propre à la CEC et évacue les déclencheurs inflammatoires hydrosolubles. Elle diminue l’œdème interstitiel postopératoire, les besoins transfusionnels, le syndrome inflammatoire systémique et l’insuffisance multi-organique.
Par rapport aux systèmes de lavage sanguin (CellSaver™) qui les éliminent, elle conserve les plaquettes, l’héparine, les protéines plasmatiques et une bonne partie des facteurs de coagulation.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- BOODHWANI M, WILLIAMS K, BABAEV A, et al. Ultrafiltration reduces blood transfusion following cardiac surgery: a meta-analysis. Eur J Cardiothorac Surg 2006; 30:892-7
- JOURNOIS D, BOURDARIAS B. Hémofiltration en chirurgie cardiaque. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris, Arnette Groupe Liaison SA, 2004, 377-85
- JOURNOIS D, ISRAEL-BIET E, POUARD P, et al. High volume, zero-balance hemofiltration to reduce delayed inflammatory response to cardiopulmonary bypass in children. Anesthesiology 1996; 85:965-1003
- LUCIANI GB, MENON T, VECCHI B, et al. Modified ultrafiltration reduces morbidity after adult cardiac operations: a prospective randomized clinical study. Circulation 2001: 104:1253-9
- MYERS GJ, LEADON RB, MITCHELL LB, et al. Simple modified ultrafiltration. Perfusion 2000; 15:447-52
- SEARLES B, DARLING E. Ultrafiltration in cardiac surhery. In: MONGERO LB, BECK JR (eds). On bypass. Advanced perfusion techniques. Totowa (NJ, USA): Humana Press 2010, 193-210
