Nosologie
La dissection aortique est une déchirure qui progresse dans la média; elle peut être due à une dégénérescence structurelle (Marfan), à une lésion intimale à partir d’un athérome ulcéré ou d’un traumatisme, ou à une rupture de vasa vasorum au sein de la paroi. Elle s’étend en fonction directe de la force d’éjection du VG, de la pression artérielle différentielle et de la fréquence cardiaque. La déchirure primaire est située à un point de stress maximal: racine de l’aorte dans 68% des cas, isthme dans 24% [14]. La prévalence est de 3:100’000 habitants par an. La mortalité de la dissection aortique est de 50% à 48 heures et de 90% à 3 mois [12].
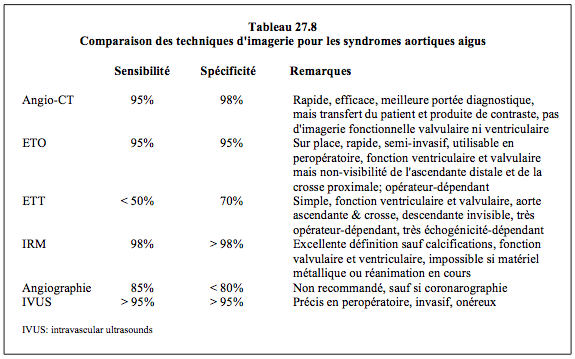
L’ETO est particulièrement efficace pour le diagnostic de dissection, puisqu’il a une sensibilité de 86-100%, une spécificité de 85-95% et une valeur prédictive négative de 85-100% [3,9]. La baisse de la spécificité est liée au diagnostic différentiel parfois difficile avec les artéfacts de reverbération qui sont fréquents (50% des cas) et donnent des images très ressemblantes à une membrane de dissection; ces artéfacts sont responsables de faux-positifs dans 3.5% des cas [9]. L’ETO a l’avantage d’être rapide, de se pratiquer au lit du malade et de visualiser les flux ou l'insuffisance aortique, mais le passage de la sonde peut induire une poussée hypertensive et sa manipulation peut mettre en danger la paroi très fragile de la dissection descendante qui appuie contre l’oesophage [11,21,28]. Le CT-scan spiralé est un examen moins opérateur-dépendant que l'ETO; il apporte une vue détaillée de la totalité de l'aorte et de ses branches, mais il impose un déplacement du malade et l'utilisation d'un produit de contraste. L'IRM offre la meilleure définition de ce type de lésion, mais elle se prête mal à un examen d'urgence et reste incompatible avec la réanimation (Tableau 27.8) [11,21,28].
La classification de Stanford est la plus couramment utilisée; elle divise les dissections en 2 groupes selon la localisation de la déchirure primaire (Figure 27.109) [5].
- Type A (70% des cas): déchirure dans l’aorte ascendante, dissection englobant l’ascendante et pouvant se prolonger dans la crosse et la descendante; le traitement est chirurgical et consiste à contrôler la déchirure initiale (remplacement de l’aorte ascendante par une prothèse tubulaire).
- Type B (30% des cas): déchirure située à l’isthme et dissection s’étendant dans la descendante; l'aorte ascendante est épargnée. Le traitement est médical, la chirurgie étant réservée aux cas accompagnés d’anévrysme ou d’ischémie viscérale.
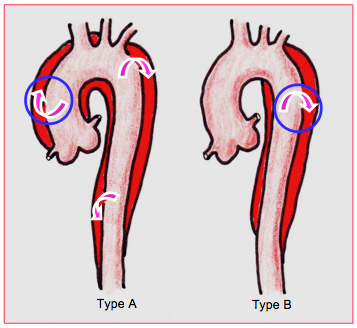
Figure 27.109 : Classification de Stanford de la dissection aortique. Type A (70% des cas) : orifice de rupture dans la partie proximale de l’aorte ascendante ; des orifices secondaires existent le plus souvent ; la dissection peut s’étendre à la crosse et à la descendante. Type B (30% des cas) : la rupture primaire est à l’isthme et la dissection s’étend distalement sur la descendante; l'ascendante est épargnée. Cette classification est basée sur l’impact chirurgical.
Imagerie transoesophagienne
Les images ETO de la dissection sont caractéristiques et souvent spectaculaires. On voit une membrane (flap) danser au sein de la lumière aortique; elle sépare la vraie lumière de la fausse (Vidéos) [18].
Vidéo: dissection A dont la membrane (flap) traverse l'aorte ascendante en vue long-axe.
Vidéo: membrane de dissection dans l'aorte descendante; la vraie lumière s'expand en systole et repousse la membrane dans la fausse lumière.
Au Doppler couleur, on remarque un flux inégal dans les deux chenaux. Mais pour être utile, l’examen ETO doit préciser certains éléments [20].
Vidéo: dissection A dont la membrane (flap) traverse l'aorte ascendante en vue long-axe.
Vidéo: membrane de dissection dans l'aorte descendante; la vraie lumière s'expand en systole et repousse la membrane dans la fausse lumière.
Au Doppler couleur, on remarque un flux inégal dans les deux chenaux. Mais pour être utile, l’examen ETO doit préciser certains éléments [20].
- Diagnostic différentiel avec des artéfacts; la membrane a des limites claires, elle est à l’intérieur de la lumière aortique et bien visible dans au moins 2 plans orthogonaux, elle ondule et oscille avec les pulsations et sépare des flux différents au Doppler couleur (Vidéo) (Figure 27.110), alors que les side-lobes (liés aux calcifications pariétales) et les reverbérations (en général de la paroi de l'OG ou de l'artère pulmonaire droite) franchissent les limites anatomiques où les flux et se meuvent indépendamment des structures (Figure 27.111). Ils sont présents chez plus de 25% des patients [11]. Toutefois, une image linéaire intra-luminale ne peut pas être retenue comme seul critère diagnostique de dissection [9].
- Rupture primaire; située aux endroits de plus grand stress pariétal, soit dans la partie proximale de l’aorte ascendante (dissection A, 1-3 cm au-dessus des sinus de Valsalva) soit à l’isthme (dissection B), la déchirure est souvent visible en 2D, car elle mesure en général > 5 mm (Vidéos). A défaut, le Doppler couleur peut mettre en évidence un flux turbulent à cet endroit (Figure 27.112) [13]. La localisation de la (des) déchirure(s) définit le type de dissection; elle est une indication précieuse pour l’opérateur.
- Sites de réentrée et ruptures secondaires; pertuis de passage aller-et-retour entre la vraie et la fausse lumière, en général dans la crosse ou la descendante (Vidéos et Figure 27.113). Le flux couleur va de la vraie vers la fausse lumière en systole (limite de Nyquist 0.2-0.5 m/s); en diastole, il s'équilibre entre les deux lumières, avec une tendance générale à passer de la fausse vers la vraie où la pression diastolique de l'aorte est inférieure à la pression du sang accumulé dans la fausse lumière (Figure 27.114).
- Distinction entre la vraie lumière et la fausse lumière; la vraie lumière s’expand en systole (visible notamment en mode TM), son flux est plus rapide au Doppler couleur, et elle est en général la plus petite. La fausse lumière présente un bas débit et souvent du contraste spontané; elle est en général plus grande. Le flux aux déchirures et fénestrations passe de la vraie à la fausse lumière en systole (Vidéo et Figure 27.115). La position de la lumière n'est pas un critère car la dissection est spiralée et torsadée; la lumière change de quadrant tout au long de la dissection. La distinction entre vraie et fausse lumière est capitale pour contrôler que la canule de CEC ou le mandrin de l’endoprothèse soient bien dans la vraie lumière.
- Extension distale de la dissection dans la crosse et dans l'aorte descendante.
- Extension proximale de la dissection en direction de la racine aortique; elle détermine la pathologie coronarienne, le type d'insuffisance aortique, et le mode de reconstruction chirurugicale [22].
- Degré I: la dissection s'arrête à la jonction sino-tubulaire.
- Degré II: la dissection s'étend dans un, deux ou les trois sinus de Valsalva jusqu'au niveau des ostia coronariens.
- Degré III: la dissection dépasse le niveau des coronaires et détruit toute l'architecture de la racine aortique.
- Insuffisance aortique (40-75% des cas); en se basant sur la classification de l'insuffisance aortique (IA) utilisée pour les plasties de la valve (voir Figure 11.59) [7,22], on peut retenir quatre mécanismes différents dans l'IA liée à la dissection (Vidéos) (Figure 27.116 et Figure 27.117) [22].
- Type Ia: dilatation de la jonction sino-tubulaire et traction excessive sur les commissures des cuspides; la fuite est centrale.
- Type Ib: dilatation d'un ou des sinus de Valsalva entrainant une perte de coaptation des cuspides; la fuite est centrale ou asymétrique.
- Type II: désinsertion partielle d'une ou de plusieurs cuspides par la progression proximale de la membrane; la zone concernée prolabe et le jet d'insuffisance est excentrique, en direction opposée à la cuspide prolabante.
- Type III: prolapsus de la membrane à travers la valve aortique; les cuspides ne peuvent plus se déployer en diastole; le jet d'IA est variable et souvent multiple. Elle est sévère dans 45% des cas [17]. L’ETO doit en élucider le mécanisme afin de prévoir la stratégie opératoire (remplacement, plastie, resuspension, etc); la valve peut être préservée dans plus de 80% des dissection A [16,23].
- Obstruction coronarienne; la membrane peut disséquer l’origine des coronaires, le plus souvent celle de la CD (10-20% des cas), ou obstruer un ostium en le recouvrant (Figure 27.117). Un ou les deux troncs coronariens peuvent être alimentés par la vraie ou par la fausse lumière. L'ETO 3D est particulièrement performant pour définir l'interférence de la membrane avec la lumière coronarienne [26].
- Implantation des gros vaisseaux (artères de la gerbe, tronc coeliaque, mésentérique supérieure); il est important de définir si leur flux provient de la vraie ou de la fausse lumière, et si la dissection se prolonge à l’intérieur d’un vaisseau; la membrane peut obstruer l’orifce des gros vaisseaux ou s’insinuer à l’intérieur et y compromettre la perfusion. Ces notions sont souvent difficiles à mettre en évidence à l’ETO, qui est moins performant que l'angio-CT de ce point de vue. Au Doppler couleur, on recherche la présence de flux dans les troncs coronariens, dans les carotides (voir Figure 27.98), dans le tronc coeliaque et dans l'artère spinale antérieure (limite de Nyquist 0.2-0.4 m/s) (Figure 27.118) [25,29].
- Dissection étendue de l’aorte descendante; recherche de grosses artères intercostales qu’il est prudent de réimplanter pour garantir la perfusion médullaire.
- Présence d’épanchement péricardique, d’hémopéricarde ou de tamponnade (30% des cas); présence d’épanchement pleural gauche (voir Figure 27.65).
- Fonction ventriculaire gauche, éventuelles altérations de la cinétique segmentaire sur ischémie coronarienne.
Vidéo: triple chenal dans la crosse aortique avec la vraie lumière au centre en vue long-axe.
Vidéo: vue long-axe de la racine aortique avec une membrane de dissection A dont la déchirure est visible en systole; en diastole, la membrane plonge vers la valve aortique.
Vidéo: vue court-axe d'une dissection dans l'aorte descendante.
Vidéo: flux Doppler couleur dans la crosse aortique montrant le passage entre la vraie et la fausse lumière.
Vidéo: vue court-axe de l'aorte descendante montrant un passage entre la vraie et la fausse lumière (ré-entrée); la vrai lumière s'expand en systole.
Vidéo: membrane de dissection A plongeant à travers la valve aortique en diastole et causant une insuffisance aortique.
Vidéo: insuffisance aortique majeure au flux Doppler couleur lors d'une dissection A.
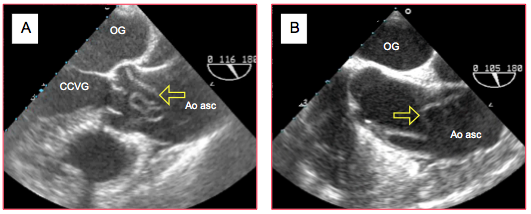
Figure 27.110 : Dissection de type A. Exemples de membranes intimales flottant dans la racine de l'aorte (flèches jaunes).
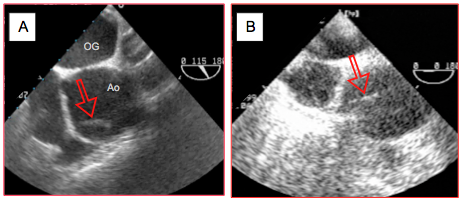
Figure 27.111 : Artéfacts dans l’aorte ascendante. A: reverbération (flèche rouge). B: side-lobe (flèche rouge). Ces artéfacts se meuvent indépendamment des structures qui les contiennent et traversent les barrières anatomiques. Ils ne se présentent pas de la même manière selon différents plans de coupe, raison pour laquelle toute pathologie doit être recherchée dans deux vues orthogonales.
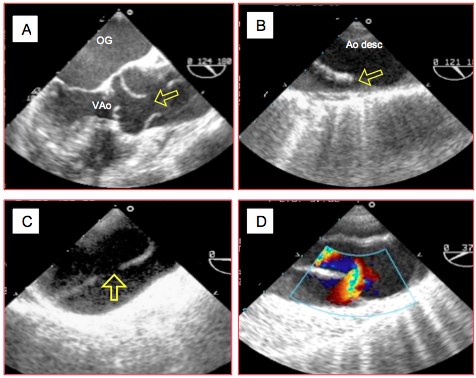
Figure 27.112 : Sites de déchirure. A: déchirure proximale d'une dissection A atteignant le niveau des ostia coronariens dans les sinus de Valsalva. B: déchirure d'une dissection B à l'isthme, dans la partie proximale de l'aorte descendante. C: déchirure proximale située dans la crosse aortique. D: flux couleur tourbillonnant permettant de repérer l'endroit de la déchirure, en l'occurrence dans la crosse.
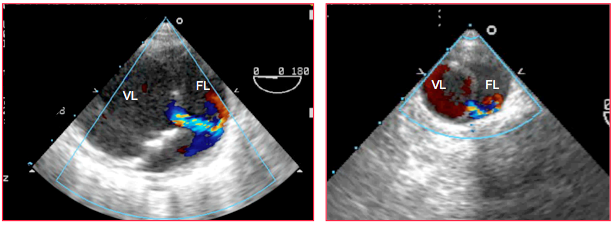
Figure 27.113 : Dissection aortique. Jets de réentrée entre la vraie lumière (VL) et la fausse lumière (FL) dans l’aorte descendante.
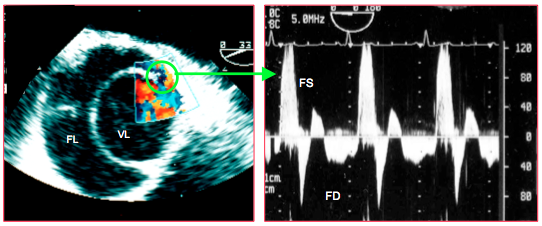
Figure 27.114 : Flux spectral du jet de réentrée à travers une déchirure secondaire dans l’aorte descendante. En systole, le flux va de la vraie vers la fausse lumière; FS: flux systolique. En diastole, le flux correspond à une équilibration de pression entre les deux lumières; il fait un va-et-vient mais il prédomine de la fausse vers la vraie lumière; FD: flux diastolique.
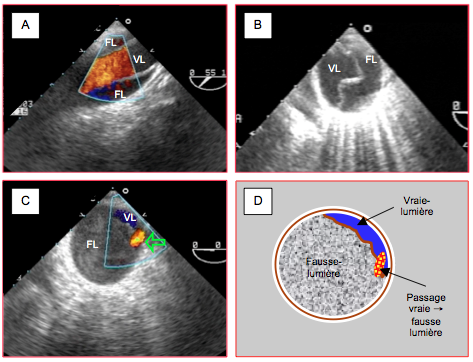
Figure 27.115 : Distinction entre la vraie (VL) et la fausse lumière (FL) dans une dissection A. A : crosse de l’aorte ; la Vmax du flux est plus élevée dans la vraie lumière (turbulences orange) que dans la fausse (flux laminaire bleu foncé). B : aorte descendante ; la FL tend à être plus grande que la VL ; la VL est pulsatile, elle s’expand en systole. C : aorte descendante ; la VL est un mince croissant situé entre 12 et 3 heures ; il existe un fort contraste spontané dans la fausse lumière ; l’orifice de réentrée est marqué par un flux tourbillonnaire . D : schéma de C.
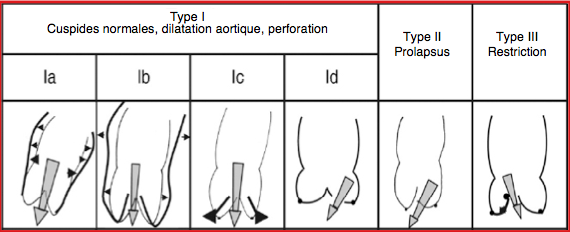
Figure 11.59: Les différents types anatomo-pathologiques d’insuffisance aortique classés selon le degré de mobilité des cuspides, avec l’illustration des mécanismes en cause [7]. Type I : mouvement des cuspides normaux, dilatation de la racine aortique; jet central. Type Ia : dilatation de la jonction sino-tubulaire; défaut de suspension des cuspides. Type Ib : dilatation des sinus de Valsalva, effacement de la jonction sino-tubulaire, écartement des commissures empêchant la coaptation des cuspides. Type Ic : dilatation de l’anneau aortique. Type Id : perforation de cuspide (jet variable). Type II : excès de tissu et de mouvement d’une ou des cuspides, prolapsus; jet excentrique. Type III : mouvement restrictif des cuspides, rétraction, fibrose, calcifications; jet variable. Le type 1c ne se rencontre pas dans la dissection aortique, car celle-ci est stoppée à la jonction entre la paroi aortique et la musculature de la chambre de chasse. Il n'y a pas non plus de perforation des cuspides (type 1d).

Figure 27.116 : Schéma des quatres mécanismes de l'insuffisance aortique (IA) dans la dissection A, en vues court-axe et long-axe; la silhouette normale de la racine aortique est représentée en gris, la fuite aortique en jaune et la dissection en bleu. A: IA type Ia; la dissection dilate la jonction sino-tubulaire mais ne va pas au-delà. La traction sur les commissures empêche la copatation des cuspides; la fuite est centrale. B: IA type Ib; la dissection envahit les sinus de Valsalva et dilate tout l'appareil de suspension des cuspides. La fuite est sévère; elle est centrale ou excentrique selon le degré de symétrie de la dissection. C: IA type II (prolapsus); la désinsertion d'une cuspide la fait prolaber en diastole. La fuite est excentrique. D : IA type III (restriction); la membrane s'insinue entre les cuspides en diastole et les empêche de se déployer normalement.

Figure 27.117 : Illustrations d'insuffisance aortique dans la dissection A. A : insuffisance aortique par bascule de la membrane protrudant à travers la valve aortique en diastole (flèche). B : insuffisance aortique d’origine double; on voit une IA centrale (flèche verte) due à la non-coaptation de la valve parce que la membrane s’y introduit en diastole, et deux petites IA (flèches jaunes) dues à des ruptures de la membrane. C: membrane de dissection s'infiltrant dans l'ostium coronarien droit. D: schéma d'une désinsertion des cuspides coronaire gauche et non-coronaire par une dissection; les deux cuspides prolabent en diastole.
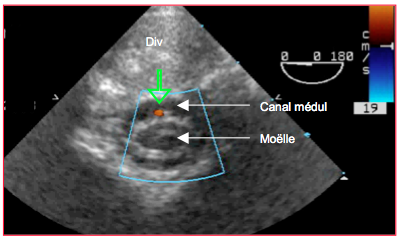
Figure 27.118 : Contrôle du flux médullaire. En pivotant la sonde vers l’arrière, on aperçoit le canal médullaire et la moëlle épinière entre les corps vertébraux ; cette observation ne peut être faite que si les disques intervertébraux (Div) sont assez translucides, soit jusque vers 30-35 ans. En abaissant l’échelle du flux couleur à 0.2 m/s, on voit le flux dans l’artère spinale antérieure (flèche verte).
Si la perfusion des viscères est assurée et que la paroi aortique résiste, la dissection peut s’installer dans la chronicité. La membrane s’épaissit et se fibrose; elle donne une image plus échodense et moins souple à l’ETO (Vidéo). Au Doppler couleur, il n’est pas rare de voir un flux quasi-identique dans les deux lumières (aorte en "double canon") avec des passages par des orifices de réentrée au Doppler couleur (Figure 27.119) [10]. Ce phénomène présente un risque chirurgical particulier, parce que certains viscères sont vascularisés par une lumière et certains par l'autre; une longue fénestration est souvent la seule option.
Vidéo: dissection A dans l'aorte descendante lors d'une situation chronique; la membrane est épaisse, la fause lumière est remplie de contraste spontané.
Vidéo: dissection A dans l'aorte descendante lors d'une situation chronique; la membrane est épaisse, la fause lumière est remplie de contraste spontané.
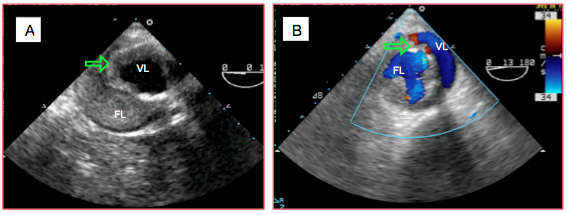
Figure 27.119 : Dissection chronique dans l’aorte descendante. A : la membrane est fibrosée, épaissie et peu mobile (flèche); la fausse lumière est thrombosée. B : dans cet autre cas, les flux sont identiques dans les deux lumières en systole.
La dissection de type B est caractérisée par une déchirure initiale dans la partie proximale de l’aorte descendante (Vidéos et Figure 27.120). Contrairement à la dissection de type A, cette lésion n’est pas une indication chirurgicale en urgence pour autant que les viscères et la moëlle ne souffrent pas d’ischémie. Si c’est le cas, la technique première est une fénestration de la membrane par voie percutanée. Une dissection B aiguë peut survenir après canulation de CEC par voie fémorale, parce que le flux rétrograde dans l'aorte abdominale et descendante peut s'infiltrer entre des plaques athéromateuses et disséquer a retro jusqu'à la crosse (Vidéo).
Vidéo: vue long-axe de l'aorte descendante dans un cas de dissection B.
Vidéo: vue court-axe de l'aorte descendante dans un cas de dissection B.
Vidéo: dissection B aiguë après canulation fémorale pour une CEC; les deux lumières sont perméables. Présence d'un discret flux aller-retour entre les deux lumières par une petite déchirure.
Vidéo: vue long-axe de l'aorte descendante dans un cas de dissection B.
Vidéo: vue court-axe de l'aorte descendante dans un cas de dissection B.
Vidéo: dissection B aiguë après canulation fémorale pour une CEC; les deux lumières sont perméables. Présence d'un discret flux aller-retour entre les deux lumières par une petite déchirure.
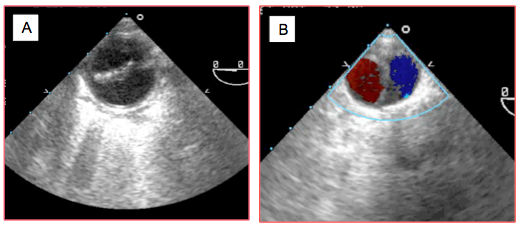
Figure 27.120 : Dissection de type B. A : aorte descendante en court-axe au niveau de l'isthme; on voit la membrane à l’origine de la déchirure. B : dissection rétrograde de toute l'aorte descendante suite à une canulation de CEC fémorale; les deux lumières sont perfusées sans souffrance apparente des viscères.
Dans la majorité des cas, le diagnostic de dissection ou de syndrome aortique aigu est suspecté dans une situation d'urgence. Dans ce contexte de stress, il est capital de respecter une séquence précise dans l'examen ETO [6,15].
- Diagnostic de la membrane intimale (flap) flottant dans la lumière de l'aorte ascendante et/ou descendante; exclusion des artéfacts.
- Recherche de l'orifice d'entrée proximal (2D et flux couleur) et de fénestrations distales (crosse, aorte descendante).
- Définition de la vraie et de la fausse lumière.
- Extension proximale de la membrane (jonction sino-tubulaire, sinus de Valsalva); mesures d'une éventuelle dilatation de la racine aortique.
- Recherche d'une insuffisance aortique (importance et direction du jet couleur) et de son mécanisme (prolapsus de la membrane, extension de la dissection dans la racine des cuspides, dilatation de la racine aortique).
- Visualisation des ostia coronariens, extension de la membrane dans un tronc coronarien ou obstruction d'un ostium.
- Recherche du flux dans les vaisseaux de la gerbe (sous-clavière gauche et carotide gauche, rarement tronc brachio-céphalique).
- Recherche d'un épanchement péricardique et/ou pleural gauche.
- Evaluation de la fonction ventriculaire segmentaire et globale.
Avec l'examen ETO, l'échocardiographeur doit tenter de répondre à un certain nombre de questions dont la réponse oriente la thérapeutique.
- S'agit-il d'une dissection A ou B ?
- Quel est le site de la déchirure proximale ?
- Existe-t-il d'autres déchirures ou d'autres orifices de ré-entrée ?
- Quelle est la vraie et quelle est la fausse lumière ?
- Existe-t-il une insuffisance aortique ?
- Si oui, quel en est le mécanisme ? Peut-on conserver la valve ?
- La perfusion des coronaires et des vaisseaux de la gerbe est-elle préservée ?
- Présence de tamponnade et/ou d'épanchement pleural ?
- Quelle est la fonction ventriculaire ?
- Existe-t-il des altérations de la cinétique segmentaire du VG ou du VD ?
- La canule artérielle de CEC ou le mandrin d'endoprothèse sont-ils dans la vraie lumière ?
En postopératoire, l'examen ETO doit contrôler l'exclusion de la rupture d'entrée et l'absence de flux dans la fausse lumière, avec un débit normal dans la vraie lumière. La valve aortique ne doit pas présenter une insuffisance résiduelle > mineure. En cas d'implication des coronaires, la contractilité segmentaire ne doit pas présenter d'anomalie [11].
Syndrome aortique aigu
La dissection est le principal représentant du syndrome aortique aigu, qui comprend aussi l'hématome intramural et l'ulcère athéromateux térébrant (presqu'exclusivement dans l'aorte descendante) (Figure 27.121). La répartition est d'environ 75% de dissections 15% d'hématomes et 10% d'ulcères [4,8]. Ce sont des pathologies menaçant la survie qui ont une présentation clinique commune et un pronostic sombre [27].
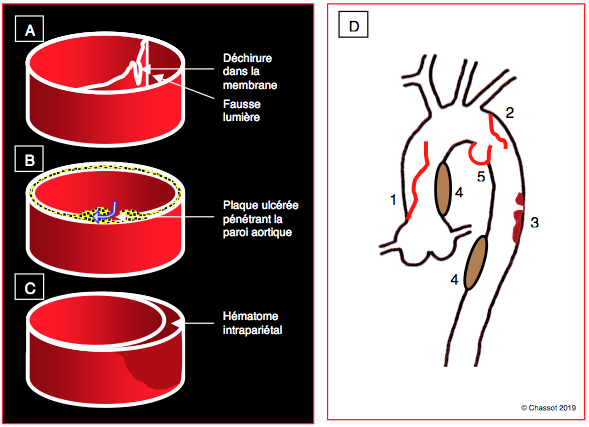
Figure 27.121 : Lésions pariétales aortiques caractéristiques du syndrome aortique aigu. A : dissection ; une membrane sépare la vraie et la fausse lumières ; l’origine est une déchirure intimale. B : une plaque athéromateuse ulcérée pénètre dans la paroi aortique et érode les couches ; elle peut provoquer une dissection ou une rupture. C : hématome intrapariétal sur rupture de vasa vasorum ; il cause une dissection au sein de la paroi mais sans contact avec le flux sanguin [2]. D: localisations les plus fréquentes. 1: dissection A. 2: dissection B. 3: ulcère térébrant. 4: hématome intramural (60% dans l'aorte descendante). 5: rupture traumatique.
L'hématome intramural est une variante de dissection. Il ressemble à une dissection dont la fausse-lumière serait thrombosée (VIdéo). Il se présente comme un épaississement circulaire ou en croissant de la paroi, sans flux à l'intérieur et sans communication avec la lumière aortique; il a un aspect lamellé ou vacuolaire. Son extension en longueur est d'une dizaine de centimètres. Il est mieux détecté par le CT-scan et l'IRM que par l'ETO, mais l'utilisation de produit de contraste (SonoVue™, Optison™) permet à l'échocardiographie d'avoir une sensibilité > 98% pour le diagnostic d'hématome intramural et d'ulcère térébrant [1]. Il existe deux types d'hématome [19].
- Type I: paroi interne lisse, diamètre < 3.5 cm, épaisseur de paroi > 0.5 cm;
- Type II: surface interne irrégulière, diamètre > 3.5 cm, épaisseur de paroi > 0.6 cm.
Ils se rencontrent préférentiellement dans l'aorte descendante. Le traitement est chirurgical, car le risque de rupture ou de dissection est de 46% à 30 jours [2,24].
Vidéo: vue long-axe de la racine aortique avec un hématome intramural de la paroi antérieure. La ressemblance avec une dissection thrombosée est frappante.
Vidéo: vue long-axe de la racine aortique avec un hématome intramural de la paroi antérieure. La ressemblance avec une dissection thrombosée est frappante.
| Dissection de l’aorte thoracique |
|
Membrane oscillant avec les pulsations à l’intérieur la lumière aortique, visible dans au moins 2 plans orthogonaux, et séparant des vélocités différentes au Doppler couleur
Recherche des orifices et des insertions de la membrane
Recherche d’IA et de flux dans les vaisseaux issus de l’aorte
Vraie lumière: expansion en systole, flux systolique rapide, en général plus petite
Fausse lumière: compression en systole, flux lent, contraste spontané, en général plus grande
Type A : déchirure primaire dans l’aorte ascendante
Type B : déchirure primaire à l’isthme ou dans l’aorte descendante
|
| Messages pour le chirurgien en cas de dissection aortique |
|
Dissection de type A ou B
Localisation de la rupture primaire et des sites de réentrée
Localisation de la vraie et de la fausse lumière sur tout le trajet de l’aorte
Débit aortique dans la vraie et la fausse lumière (Vmax au flux couleur, échelle 0.3-0.5 m/s)
Sites d’implantation de la membrane
Extension de la dissection dans les vaisseaux et dans la valve aortique
Présence d’IA et mécanisme (orifice de régurgitation, prolapsus/désinsertion, direction du jet)
Taille de l’anneau aortique, des sinus de Valsalva et de la jonction sino-tubulaire
Epanchement péricardique et/ou pleural, tamponnade
Fonction VG, altérations de la cinétique segmentaire
En début de CEC: observation du flux (cavitation) dans la vraie lumière
Guidage du mandrin d'endoprothèse dans la vraie lumière
|
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- AGRICOLA E, SLAVICH M, BERTOGLIO L, et al. The role of contrast enhanced transesophageal echocardiography in the diagnosis and the morphological and functional characterization of acute aortic syndromes. Int J Cardiovasc Inaging 2014; 30:31-38
- ANDRITSOS M, DESAI ND, GREWAL A, et al. Innovations in aortic disease management: The descending aorta. J Cardiothorac Vasc Anesth 2010; 24:523-9
- CHIRILLO F, CAVALLINI C, LONGHINI C, et al. Comparative diagnostic value of transesophageal echocardiography and retrograde aortography in the evaluation of thoracic aortic dissection. Am J Cardiol 1994; 74:590-8
- CLOUGH RE, NIENABER CA. Management of acute aortic syndrome. Nat Rev Cardiol 2015; 12:103-14
- DAILY PO, TRUEBLOOD HW, STINSON ED, et al. Management of acute aortic dissections. Ann Thorac Surg 1970; 10:237-45
- EDWARDS JK, LESHNOWER BG, DUGGAN M, et al. Detailed 2-dimensional and 3-dimensional transesophageal evaluation of the aortic root and aortic valve in complex type A dissection. Anesth Analg 2017; 124:1105-8
- EL KHOURY G, GLINEUR D, RUBAY J, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- EVANGELISTA A; FLASCHKAMPF FA, ERBEL R, ET AL. Echocardiography in aortic diseases: EAE recommendations for clinical practice. Eur J Echocardiogr 2010; 11:645-58
- EVANGELISTA A, SALAS A, RIBERA A, et al. Long-term outcome of aortic dissection with patent false lumen: predictive role of entry tear size and location. Circulation 2012; 125:3133-41
- GOLDSTEIN SA, EVANGELISTA A, ABBARA S, et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American Society of Echocardiography and the European Association of Cardiovascular Imaging: endorsed by the Society of Cardiovascular Computed Tomography and Society for Cradiovascular Magnetic Resonance. J Am Soc Echocardiogr 2015; 28:119-82
- HIRST AE, JOHNS WJ, KIME SW. Dissecting aneurysm of the aorta: a review of 505 cases. Medicine 1958; 37:243
- KHALIL A, HELMY T, POREMBKA DT. Aortic pathology: aortic trauma, debris, dissection, and aneurysm. Crit Care Med 2007; 35(8 suppl):S392-400
- LARSON EW, EDWARDS WD. Risk factors for aortic dissection: a necropsy study of 161 cases. Am J Cardiol 1984; 53:849-55
- MACKNIGHT BM, MALDONADO Y, AUGOUSTIDES JG, et al. Advances in imaging for the management of acute aortic syndromes: focus on transesophageal echocardiography and type-A aortic dissection for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2016; 30:1129-41
- MAZZUCOTELLI JP, DELEUZE PH, BAUFRETON C, et al. Preservation of the aortic valve in acute aortic dissection: long-term echocardiographic assessment and clinical outcome. Ann Thorac Surg 1993; 55:1513-7
- MOVSOWITZ HD, LEVINE RA, HILGENBERG AD, et al. Transesophageal echocardiographic description of the mechanisms of aortic regurgitation in acute type A aortic dissection: implications for aortic valve repair. J Am Coll Cardiol 2000; 36:884-90
- NIENABER CA, VON KODOLITSCH Y, NICOLAS V, et al. The diagnosis of thoracic aortic dissection by noninvasive imaging procedures. N Engl J Med 1993; 328:1-7
- NIENABER CA, VON KODOLITSCH Y, PETERSEN B, et al. Intramural hemorrhage of the thoracic aorta. Diagnosis and therapeutic implications. Circulation 1995; 92:1465-72
- NOWAK-MACHEN M. The role of transesophageal echocardiography in aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:317-29
- PATEL HJ, DEEB GM. Ascending and arch aorta. Pathology, natural history and treatment. Circulation 2008; 118:188-95
- PATEL PA, BAVARIA JE, GHADIMI K, et al. Aortic regurgitation in acute type-A aortic dissection: a clinical classification for the perioperative echocardiographer in the era of the functional aortic annulus. J Cardiothorac Vasc Anesth 2018; 32:586-97
- PRODROMO J, D'ANCONNA G, AMADUCCI A, et al. Aortic valve repair fort aortic insufficiency: a review. J Cardiothorac Vasc Anesth 2012; 26:923-32
- ROBBINS RC, McMANUS RP, MITCHELL RS, et al. Management of patients with intramural hematoma of the thoracic aorta. Circulation 1993; 88(Suppl II)1-10
- SALERNO P, JACKSON A, SHAW M, et al. Transesophageal echocardiographic imaging of the branches of the aorta: A guide to obtaining these images and their clinical utility. J Cardiothorac Vasc Anesth 2009; 23:694.701
- SASAKI S, WATANABE H, SHIBAYAMA K, et al. Three.dimensional transesophageal echocardiographic evaluation of coronary involvement in patients with acute type A aortic dissection. J Am Soc Echocardiogr 2013; 26:837-45
- SHEIKH AS,, ALI K. Acute aortic syndromes. Circulation 2013; 128:1122-7
- SHIGA T, WAJIMA Z, APFEL C, et al. Diagnostic accuracy of transesophageal echocardiography, helical computed tomography, and magnetic resonance imaging for suspected thoracic aortic dissection. Arch Intern Med 2006; 166:1350-6
- VOCI P, TRITAPEPE L, TESTA G, et al. Imaging of the anterior spinal artery by transesophageal color Doppler ultrasonography. J Cardiothorac Vasc Anesth 1999; 13:586-9
