Outre les artéfacts liés aux interférences des ultrasons, déjà traités dans le chapitre sur la physique (voir Artéfacts physiques), l'examen échocardiographique peut révéler de bizarres structures qui sont des effets de coupe ou des variantes anatomiques. Leur connaissance est importante, car elles peuvent être confondues avec une tumeur, un thrombus ou une endocardite et engendrer de faux diagnostics ou des traitements inutiles. Certaines font partie des variations anatomiques de l'oreillette droite, comme la crista terminalis, la valve d'Eustache ou la valve de Thébésius (voir Figure 25.126); mais elles peuvent parfois prendre des allures inhabituelles.
- Bande modératrice gauche ; ligament fibreux qui traverse la cavité du VG entre le septum et la paroi latérale au niveau médioventriculaire ; anomalie peu fréquente (Figure 25.151).
- Bande modératrice droite ; travée musculaire normale, parfois très développée, qui traverse le VD entre le septum et sa paroi libre dans le tiers apical du ventricule (Vidéo).
Vidéo: bande modératrice du VD en vue 4-cavités (hypertrophie dilatative du VD dans un cas de surcharge de volume par une CIA).
- Valve d’Eustache ; repli endocardique de l’OD qui dirigeait le sang foetal oxygéné de la VCI vers le foramen ovale et l’OG. Elle régresse pendant les premiers mois de vie, mais peut persister sous une forme plus ou moins développée entre l’abouchement de la VCI et le bord inférieur de la fosse ovale ; elle est parfois très flottante (Vidéo et Figure 25.152A).
Vidéo: vue bicave (80-110°); la valve d'Eustache flotte à l'abouchement de la veine cave inférieure dans l'OD (à gauche à l'écran).
- Réseau de Chiari ; développement exagéré des trabéculations de l’OD qui forment un entrelac libre et fin dans la cavité auriculaire. Les hasards de ses mouvements et du plan de coupe peuvent donner des images étranges (Figure 25.152B).
- Pilier et cordage aberrants ; bien que leur nombre et leur position ne changent pas, les piliers peuvent avoir des formes et des longueurs variables ; un prolongement musculaire peut s’étendre le long de cordages. Des cordages de 2ème ordre ou de 3ème ordre peuvent s’insérer très antérieurement à la base du feuillet mitral antérieur et traverser la chambre de chasse du VG, où ils donnent l’image d’une masse flottant dans le courant sanguin ; suivant l’angle de vue, ils peuvent faire croire à un SAM ou à une endocardite (Vidéo et Figure 25.152C).
Vidéo: extension musculaire et cordage aberrants issus du pilier antérieur, insérés à la base du feuillet mitral et flottant dans la chambre de chasse du VG. - Invagination de l’appendice auriculaire ; après manipulation de l’OG au cours d’une intervention cardiaque, il peut arriver que l’appendice auriculaire gauche se retourne comme un doigt de gant et s’invagine à l’intérieur de l’oreillette où il apparaît comme une masse de 1-2 cm qui semble y flotter (Vidéo et Figure 25.152D). Le chirurgien le ressort facilement.
Vidéo: invagination de l'appendice auriculaire gauche qui apparaît comme une masse dans l'OG en fin de CEC.
- Ligament de Marschall; ce recessus entre la VPSG et l'AAG avec un nodule de graisse épicardique ressemble à une tumeur ou à un thrombus pédiculé, alors qu'il s'agit d'une structure anatomique normale (Vidéo et Figure 25.69).
Vidéo: le recessus situé entre la veine pulmonaire supérieure gauche et l'appendice auriculaire gauche donne l'impression d'être une tumeur pendulaire au sein de l'OG à cause du lobule de graisse épicardique échogène qu'il contient.
- Nodule d'Arantius; la partie centrale des bords libres des cuspides aortiques présente un petit renforcement fibreux qui est une structure anatomique normale.
- Excroissance de Lambl; petite formation pédiculée fine, filiforme et hypermobile, de nature dégénérative, qui se développe sur la face ventriculaire des valvules aortiques ou la face auriculaire des feuillets mitraux, le long de leur ligne de coaptation. Elle mesure 1-5 mm de longueur et 1 mm d'épaisseur, et ressemble à un minuscule fibro-élastome ou à une végétation. Elle est présente dans 0.9% de la population mais est peu emboligène (Figure 25.153) [2,3]. Elle ne mérite aucune sanction thérapeutique lorsqu'elle est asymptomatique.
- Anévrysme du septum interauriculaire; la membrane de la fosse ovale est excessivement longue et flotte entre les deux oreillettes. L’anévrysme septal est défini par une base de > 15 mm et un débattement entre l’OG et l’OD de > 15 mm [1]. Cette anomalie est fréquemment associée à un foramen ovale perméable (FOP), mais aussi à une communication interauriculaire (CIA) et à un prolapsus mitral. Associé ou non au FOP, l’anévrysme du septum représente en lui-même un certain risque de thrombo-embolie systémique ; il semble associé à un taux plus élevé d’accidents vasculaires cérébraux (Vidéo et Figure 25.154) [4].
Vidéo: anévrysme du septum interauriculaire oscillant au cours du cycle cardiaque en fonction des variations de pression entre l'OG et l'OD.
- Lipomatose septale; une infiltration de graisse dans la partie musculaire du septum interauriculaire donne une image en sablier très brillante. La fosse ovale et le septum membraneux restent toujours libres de gaisse. Cette anomalie est plus fréquente chez les obèses et peut être confondue avec une infiltration tumorale (Figure 25.155) [5].
- Graisse épicardique; la parie antérieure du sillon auriculo-ventriculaire droit est souvent envahie de graisse qui donne une image très échogène.
- Sinus transverse; la réflexion du péricarde entre l'aorte ascendante, l'oreillette gauche et l'artère pulmonaire droite forme un récessus d'allure triangulaire en vue long-axe de l'aorte ascendante à 120°. Il peut être pris pour un kyste ou un abcès; en présence d'épanchement péricardique, le Doppler couleur peut même faire apparaître un léger mouvement liquidien si l'échelle de vélocité est basse (Vidéo et Figure 25.89C).
Vidéo: vue long-axe de l'aorte ascendante, avec l'image en court-axe de l'artère pulmonaire droite; entre les deux apparaît un espace triangulaire, qui est le sinus transverse.
- Cavitation; l'arrivée massive de cristalloïde à température ambiante (environ 20°C) dans le sang à 37° provoque le passage en phase gazeuse de l'air dissous dans le liquide froid lorsqu'il se réchauffe. Ce phénomène anodin se traduit par l'apparition de microbulles. Le contraste spontané, par contre, est un phénomène lié au bas débit dans une cavité et n'est jamais normal (Vidéos et Figure 25.156).
Vidéo: cavitation, sous forme de microbulles apparaissant dans l'OD lors d'une perfusion accélérée de cristalloïde froid. Ce phénomène ne présente aucun risque.
Vidéo: contraste spontané dans l'OG dû au bas débit systémique en cas de défaillance gauche.
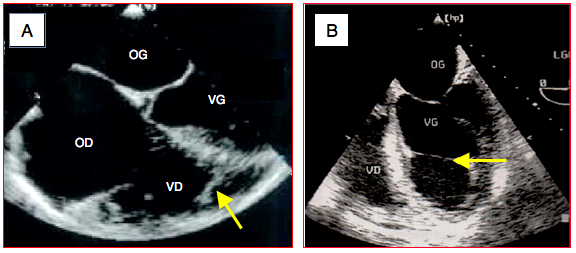
Figure 25.151 : Bande modératrice. A: bande modératrice musculaire du VD qui relie le septum à la paroi libre. B: bande fibreuse à travers la cavité du ventricule gauche (vue 4-cavités mi-oesophage).
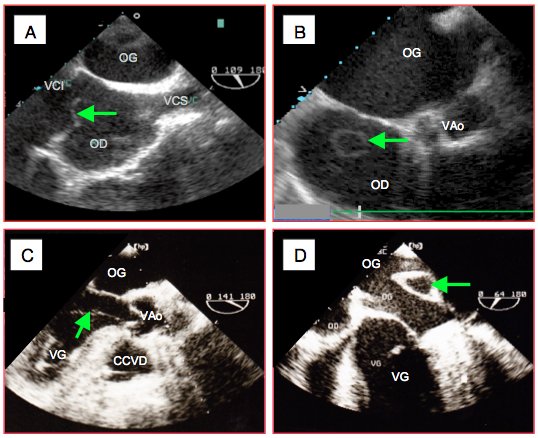
Figure 25.152 : Variantes anatomiques. A : membrane d’Eustache (flèche) à l’abouchement de la veine cave inférieure (VCI). B: effet de coupe d'un réseau de Chiari. C : cordage aberrant de la valve mitrale (cordage de 3ème ordre) traversant la chambre de chasse du VG. D : invagination peropératoire de l’appendice auriculaire gauche.
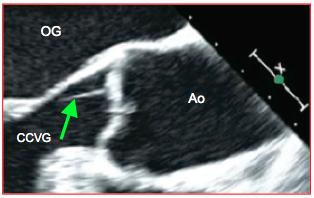
Figure 25.153 : Excroissance de Lambl; fin filament attaché à la face ventriculaire d'une cuspide aortique (flèche verte).

Figure 25.154 : Anévrysme du septum interauriculaire; comme il oscille librement entre les deux oreillettes au cours du cycle cardiaque, il peut donner des images bizarres selon le plan de coupe.
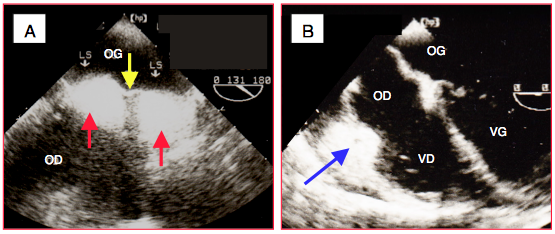
Figure 25.155 : Lipomatose auriculaire. A: lipomatose septale; les deux parties musculaires du septum interauriculaire sont envahie de graisse très échogène (flèches rouges), alors que la partie membraneuse (membrane de la fosse ovale, flèche jaune) en est dépourvue. B: graisse épicardique dans le sillon auriculo-ventriculaire droit (flèche bleue). LS: lipomatose septale.
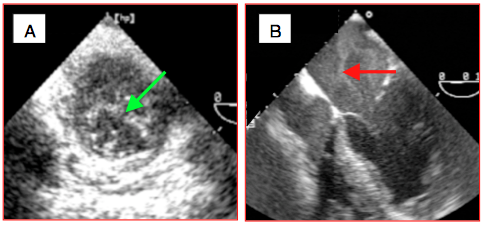
Figure 25.156 : Cavitation et contraste. A: début de CEC dans l'aorte descendante; en se réchauffant, le cristalloïde froid libère en phase gazeuse les gaz dissous à basse température, d'où l'apparition de microbulles (flèche verte). B: image de contraste spontané (flèche rouge) dans l'OG d'un malade en défaillance ventriculaire gauche et en bas débit cardiaque.
La ligature de l’appendice auriculaire gauche (AAG) est réalisée au cours d’une intervention chirurgicale pour limiter le risque de thombus et d’embolie en cas de FA ou de dilatation de l’OG. Elle n’est jamais serrée, pour éviter une nécrose secondaire qui romprait la paroi. Dans le postopératoire, on peut voir un petit flux couleur très accéléré qui entre et sort de l’AAG lorsque le patient est en rythme sinusal; il peut faire croire à une fuite ou à une fistule. Cette image n’apparaît pas lorsque l’AAG est occlus à l’agrafeuse.
La plèvre gauche est bien visible en avant de l’aorte descendante lorsqu’on visualise cette dernière en court axe ; on peut y observer un épanchement contenant du liquide, des caillots ou des filaments de fibrine ondulant avec les mouvements respiratoires ; une atélectasie de la base pulmonaire apparaît comme une masse hépatisée contenant des points brillants qui sont de l’air alvéolaire. L’épanchement pleural se différencie de l’épanchement péricardique par sa situation en avant de l’aorte descendante, alors que le second est situé entre l’OG et l’aorte. La plèvre droite, située à la droite de l’OD, est moins bien visible en ETO. En pivotant la sonde vers l’arrière, on peut voir les vertèbres. Jusqu’à environ 35-40 ans, les disques intervertébraux sont peu fibrosés et relativement translucides aux ultrasons. En glissant le plan de coupe à 0° entre deux vertèbres, on aperçoit aisément le canal médullaire et la moëlle épinière, avec la dure-mère et les ligaments suspenseurs (Vidéos et Figure 25.157). La pulsatilité de la moëlle reflète sa perfusion artérielle; le flux dans l’artère spinale antérieure apparaît au Doppler couleur.
Vidéo: vue transverse du canal médullaire et de la moëlle épinière, qui est clairement pulsatile.
Vidéo: le Doppler couleur met en évidence le flux dans l'artère spinale antérieure.
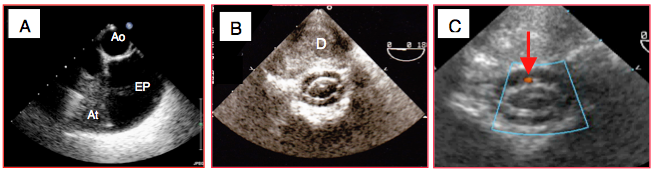
Figure 25.157 : Images particulières. A: épanchement pleural gauche (EP); il est situé devant l'aorte descendante. At: atélectasie pulmonaire. B: vue en court axe de la moëlle épinière, avec la dure-mère et le canal vertébral. D : corps du disque intervertébral. C: avec le flux couleur, on aperçoit l’artère spinale antérieure (flèche).
| Anomalies et artéfacts |
| L'examen échocardiographique peut révéler de bizarres structures qui sont des effets de coupe ou des variantes anatomiques. Leur connaissance est importante, car elles peuvent être confondues avec une tumeur, un thrombus ou une endocardite et engendrer de faux diagnostics ou des traitements inutiles. Au niveau auriculaire: valve d'Eustache, réseau de Chiari, ligament de Marshall, anévrysme du septum, lipomatose septale. Au niveau ventriculaire: bande modératrice, cordages aberrants. Au niveau valvulaire: nodule l'Arantius, excroissance de Lambl. Au niveau péricardique: sinus transverse, graisse épicardique. |
© CHASSOT PG, BETTEX D. Avril 2019; dernière mise à jour, Avril 2020
Références
- HANLEY PC, TAJIK AJ, HYNES JK, et al. Diagnosis and classification of atrial septal aneurysm by two-dimensional echocardiography: report of 80 consecutive cases. J Am Coll Cardiol 1985; 6:1370-6
- JAFFE W, FIGUEREDO VM. An example of Lambl's excrescences by transesophageal echocardiography: a commonly misinterpreted lesion. Echocariography 2007; 24:1086-9
- LEITMAN M, TYOMKIN V, PELEG E, et al. Clinical significance and prevalence of valvular strands during routine echo examinations. Eur Heart J Cardiovasc Imaging 2014; 15:1226-30
- MAS JL, ARQUIZAN C, LAMY C, et al. Recurrent cerebrovascular events associated with patent foramen ovale , atrial septal aneurysm, or both. N Engl J Med 2001; 345:1740-4
- O'CONNOR S, RECAVARREN R, NICHOLS LC, et al. Lipomatous hypertrophy of the interatrial septum: an overview. Arch Pathol Lab Med 2006; 130:397-9
