Pendant des années, la crainte d'une hémorragie excessive a fait interrompre tout traitement antiplaquettaire une dizaine de jours avant une intervention chirurgicale ou endoscopique. Comme ils protègent efficacement contre les thromboses de stent et les récidives d'infarctus ou d'ictus, qu'advient-il lorsqu'on supprime brusquement les antiplaquettaires ?
Interruption dans le cadre médical
Il y a une douzaine d'années, une étude prospective a montré que l’interruption de l'aspirine dans les 3 semaines précédentes double le risque d'infarctus et de décès lors de syndrome coronarien aigu [11]. Une méta-analyse groupant 50'279 patients à risque de maladie coronarienne et sous prévention secondaire par de l'aspirine révèle que le taux de complications cardiaques est triplé (OR 3.14) après l’interruption du traitement ; ce risque est encore bien plus grand chez les porteurs de stents (OR 89.78) [5]. Le délai entre la thrombose de stent et l’arrêt de l’aspirine est en moyenne de 7 jours, traduisant une probable relation de cause à effet [18]. Ce danger existe quel que soit le délai depuis la revascularisation, puisqu’on a rapporté de nombreux cas de thromboses tardives de stents lors de l’arrêt de l’aspirine pendant 5-10 jours, et ce jusqu’à 10 ans après leur implantation [14,23,26,42,74]. Lors de prévention secondaire après AVC, le risque d’accident ischémique cérébral est triplé si l’on interrompt l’aspirine (OR 3.4) [39].
Au cours des 3 premiers mois après un événement coronarien, l’arrêt du clopidogrel est le facteur pronostique indépendant le plus significatif pour la thrombose de stent, avec un hazard ratio (HR) de 4.6 à 57.13 [1,19,32,62]. Le délai entre l’interruption du clopidogrel et la thrombose de stent est de 9 jours, alors qu’il est de 104 jours au-delà de 6 mois [60]. Si l’on arrête le clopidogrel une dizaine de jours avant la chirurgie, on opère donc le malade au moment du plus haut risque d’accident coronarien ! Lorsque l'arrêt du clopidogrel est précoce (à 30 jours), la mortalité globale à 1 an des porteurs de stents actifs de 1ère génération est 10 fois supérieure à celle des malades qui ont continué à prendre le médicament pendant une année [65]. Par la suite, le risque diminue (OR 2.6 entre 6 et 12 mois), mais même lorsqu’elle a lieu dans les délais prescrits (> 1 an), l’interruption de la bithérapie triple le risque d’infarctus, de thrombose de stent et d’AVC dans les 3 mois qui suivent son arrêt, malgré la poursuite de l’aspirine [7,29,41,43]. L’interruption de l’antiplaquettaire est donc associée à des accidents cardiovasculaires quelle que soit la durée du traitement, bien que la corrélation soit maximale pendant les 3 premiers mois (Figure 29.21) [24].
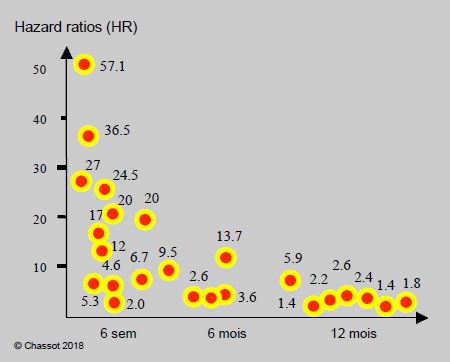
Figure 29.21 : Représentation graphique du risque (HR hazard ratio) de thrombose de stent, d’infarctus, d’AVC et de décès lié à l’interruption du clopidogrel, en fonction du délai entre la pose de stent (DES 1ère génération) et l’arrêt de ce dernier (données de 22 études différentes). Les données sont assez disparates selon les études, notamment à cause de la proportion variable de chirurgie majeure et de chirurgie mineure; les collectifs de chirurgie vasculaire lourde donnent les taux de complication les plus élevés. Elles montrent néanmoins que l’interruption de la bithérapie est associée à des accidents cardio-vasculaires quelle que soit la durée du traitement, mais que la corrélation devient faible au-delà de 6-12 mois (incidence 1-2%) alors qu’elle est maximale pendant les 6 premières semaines et significative pendant les 6 premiers mois [24]. La forme logarithmique de la courbe est identique à celle des Figures 29.22, 29.23 et 29.24.
La nature de l’interruption a un impact significatif sur les complications : celles-ci sont 2 à 7 fois plus fréquentes lors d’un arrêt "sauvage" que lors d’un arrêt préopératoire momentané (+ 41%) ou d’un arrêt programmé en fonction du plan thérapeutique (- 37%). Le risque d’accident cardiovasculaire est nettement augmenté dans la période qui suit l’interruption : OR 7.04 à 7 jours, 2.17 à 30 jours et 1.3 au-delà d’un mois [43]. Heureusement, l’incidence de thrombose de stent reste faible : dans une revue de 5’681 cas de DES, elle s’élève de 0.43% sous bithérapie et à 1.0% lors de sa suspension temporaire (17 jours). Mais sa mortalité est dramatique : dans cette étude, elle est de 29% [34]. Dans l'ensemble des publications cardiologiques, la mortalité liée à la thrombose de stent est tout aussi catastrophique : elle oscille entre 19% et 45% (moyenne 25%). Le renvoi d'une opération élective à 6 ou 12 mois pour permettre une durée optimale de la bithérapie doit donc s'accompagner d'un délai d'au moins un mois entre la fin du traitement et la date de l'intervention pour éviter la période de rebond dans l'agrégabilité plaquettaire.
Les DES de 1ère génération sont très dépendants de la bithérapie pendant les 6 premiers mois. A long terme, ils le sont tout autant de l’aspirine. La revue des thromboses tardives de stents actifs chez 161 patients montre que le délai entre la thrombose de stent et l’arrêt de l’aspirine et du clopidogrel est de 7 jours, alors qu’il est de 122 jours lorsqu’on arrête le clopidogrel mais qu’on maintient l’aspirine [18]. Il est donc concevable d’interrompre le clopidogrel pendant quelques jours à partir de 6 mois chez les malades qui n’ont pas souffert de SCA, pourvu que l’on continue l’aspirine [18,37]. Le risque de complications cardiaques est peu augmenté (HR 1.3) ; il l’est davantage si l’on interrompt l’aspirine (HR 1.9) ou les deux médicamenst (HR 2.7) [21]. Les mêmes constatations s'appliquent aux DES biorésorbables.
La plupart du temps, la bithérapie antiplaquettaire est interrompue à cause de saignements [21]. Des hémorragies majeures et mineures surviennent dans respectivement 3.0% et 5.6% des cas de bithérapie pendant la première année [47]. Or la présence d’hémorragies significatives est en soi un facteur de complications cardiaques. La survenue de saignements majeurs est clairement associée à une augmentation des accidents cardiovasculaires et de la mortalité (HR 4.09-4.2) [44,47]. La raison en est double: l'hémorragie contraint à diminuer ou à suspendre la bithérapie, et la transfusion d'érythrocytes stimule l'agrégabilité plaquettaire [63].
Les DES de nouvelle génération sont plus rapidement endothélialisés et présentent une thrombogénicité réduite. La durée de la bithérapie peut donc être raccourcie et son interruption peut survenir plus tôt en fonction du risque hémorragique propre du patient [6,22,36,45,46,53,69,70,75].
- DES 2ème-3ème génération avec risque ischémique faible mais risque hémorragique très élevé ou opération vitale impérative: 1-3 mois.
- DES 2ème-3ème génération et risque ischémique faible (stent simple, coronaropathie stable, pas de SCA): 6 mois.
- DES 2ème-3ème génération et risque ischémique modéré sur SCA, DES biorésorbables ou DES 1ère génération: 12 mois.
- DES 2ème-3ème génération et risque ischémique élevé (SCA avec infarctus, thrombose préalable, stent complexe, diabète), DES 1ère génération à risque, mais risque hémorragique faible: prolongation > 12 mois. Chez les patients sous ticagrelor, il est possible de remplacer la dose quotidienne de 180 mg par une dose de 120 mg au-delà de 12 mois.
- DES 2ème-3ème génération avec risque ischémique et hémorragique très élevés: 3-6 mois. Dans cette dangereuse combinaison, les BMS ne semblent plus forcément préférables, car même avec une bithérapie raccourcie à 1 mois les DES de nouvelles générations comme le biolimus A9 sans polymère offrent un avantage en terme de thrombose de stent, de revascularisation et de mortalité par rapport aux BMS (HR 0.42, 0.49 et 0.75, respectivement) [2,13,68].
Ces recommandations mettent en balance le risque thrombotique avec le risque hémorragique, qui augmente parallèlement à l'intensité et à la durée de la bithérapie, en gardant néanmoins à l'esprit que la mortalité liée à une thrombose coronarienne est plus importante que celle liée à une hémorragie [40]. Elles restent néanmoins relativement fragiles (classe IIa-IIb, degré d'évidence B-C) [36,70,75]. Avec les nouveaux stents et l'usage extensif du ticagrelor, on voit s'installer une dichotomie: soit la situation est favorable et la bithérapie peut être réduite à 3 mois, soit la situation est dangereuse et la bithérapie doit être prolongée à long terme, voire indéfiniment.
Cesser la bithérapie après 3 ou 6 mois dans une situation à bas risque et une coronaropathie stable n’est malheureusement pas un scénario extrapolable sans restriction à la période périopératoire, qui est une période à haut risque accompagnée d’un syndrome inflammatoire massif et d’une hyperactivité thrombocytaire puissante. La faisabilité d’un traitement de seulement 1, 3 ou 6 mois avec les nouveaux stents n’est en aucun cas un argument pour interrompre une thérapie en cours afin de programmer une intervention chirurgicale dans des délais raccourcis. D'autre part, le manque d’expérience avec les nouveaux stents dans le périopératoire oblige à rester très prudent. Le raccourcissement du délai à 1-3 mois ne concerne que des cas de coronaropathie stable sans SCA ni infarctus pour des opérations vitales hémorragipares dont le renvoi met la vie du malade en danger. Dans les autres situations, le maintien de la bithérapie en cours pendant 6-12 mois et un délai équivalent pour toute intervention élective restent de rigueur.
Après un ictus, la double thérapie n’apporte de protection supplémentaire qu’avec l’association aspirine et dipyridamole, mais non aspirine et clopidogrel; on peut donc interrompre le clopidogrel dans ce cas.
| Interruption des agents antiplaquettaires dans le cadre médical |
|
L’arrêt des antiplaquettaires est un facteur indépendant majeur de risque cardiovasculaire et le principal déclencheur de la thrombose de stent, tout particulièrement pendant les 6 premiers mois après implantation. La mortalité de la thrombose de stent est en moyenne 25%. Le délai moyen entre l’interruption des antiplaquettaires et l’accident thrombotique est de 7-9 jours. Le risque est d’autant plus élevé qu’on est proche de l’événement coronarien ; il est maximal pendant les 4 premières semaines. Entre 1 et 3 mois après BMS ou PAC, entre 1 et 6 mois après DES de 2ème-3ème génération, et entre 6 et 12 mois après DES de 1ère génération, le risque est intermédiaire. Il correspond à celui d’une coronaropathie stable au-delà de 3 mois après BMS ou PAC, de 6 mois après DES de 2ème-3ème génération et de 12 mois après DES de 1ère génération.
L'interruption de la bithérapie, même à la fin de sa durée normale, s'accompagne momentanément d'un effet rebond et d'une hyperagrégabilité plaquettaire.
|
Interruption dans le cadre chirurgical
La situation est plus dangereuse dans le contexte chirurgical, à cause de l’hypercoagulabilité, du syndrome inflammatoire postopératoire et de l’instabilité hémodynamique. En effet, le patient devient particulièrement vulnérable à cause de quatre phénomènes [49].
- Réduction du débit coronarien par une sténose serrée (> 75%) entraînant un déséquilibre du rapport DO2/VO2 lors d’épisodes d’hypotension, de tachycardie ou de bas débit peropératoires ; ce phénomène est responsable de la moitié des infarctus periopératoires [66].
- Lésion endothéliale due à une plaque instable, dont le degré d’obstruction est faible mais dont la rupture est responsable de l'autre moitié des infarctus postopératoires.
- Thrombogénicité élevée à cause de la réaction inflammatoire systémique (SIRS : systemic inflammatory response syndrome), de l’activation plaquettaire et de la fibrinolyse liées au stress opératoire; en chirurgie oncologique, il s’y ajoute un syndrome paranéoplasique caractérisé par une hypercoagulabilité.
- Vulnérabilité myocardique déterminée par l’étendue de la zone à risque, sa localisation, son degré de collatéralisation et sa susceptibilité aux arythmies graves.
Lorsqu'ils sont prescrits après un événement coronarien, les antiplaquettaires sont une excellente protection contre les complications cardiovasculaires périopératoires. Comparés à ceux qui ont un traitement continu, les patients qui ont arrêté le clopidogrel 7 jours avant un enclouage du col fémoral ont un taux d’accidents coronariens presque 7 fois supérieur (OR 6.7) ; le SCA, dont l’incidence est de 32%, survient entre le 4ème et le 8ème jour après l’arrêt ; 71% des anciens infarctus ont récidivé [12]. Dans un registre de 666 patients, l’arrêt des antiplaquettaires est le principal prédicteur d’accident cardio-vasculaire périopératoire (OR 25.8), et le maintien de l’aspirine réduit significativement le risque cardiaque (OR 0.27) [57]. En chirurgie vasculaire majeure, l'interruption du clopidogrel augmente de 10 fois le risque de thrombose de stent, d'infarctus et de mortalité par rapport à sa continuation [59].
La place de l'aspirine en périopératoire est illustrée par une petite étude randomisée (220 patients) qui a montré que cette substance diminue le risque relatif d’accident cardiovasculaire de cinq fois (OR 5.5) par rapport au placebo (réduction absolue 7.2%) [52]. Cependant, l'arrêt de l’aspirine avant la chirurgie a fait récemment l’objet de trois études contrôlées qui tendent à démontrer que cette interruption ne modifie guère le pronostic.
- Le taux de complications cardiovasculaires à 30 jours (11% vs 10.3%) et le risque hémorragique peropératoire (6.9% vs 6.8%) sont identiques chez 291 patients randomisés entre aspirine et placebo la veille de l’intervention [38].
- Le taux d’infarctus et de décès est identique (7.0% vs 7.1%, HR 0.99) chez 10'010 patients randomisés entre aspirine et placebo (POISE 2) ; le risque hémorragique est un peu augmenté dans le groupe aspirine (HR 1.23). Mais le 56% des ces patients n’était pas sous aspirine avant l’étude, qui a correspondu pour eux à une prévention primaire ; or on sait que l’impact clinique de celle-ci est quasi-nul. D’autre part, 65% des patients étaient sous anticoagulants prophylactiques périopératoires [15].
- La mortalité et le taux de complications cardiaques ne sont pas significativement abaissés (OR 0.94) comparé au placebo par une dose d'aspirine préopératoire (100 mg) en chirurgie de revascularisation coronarienne, mais le taux de reprise pour hémostase passe de 1.8% à 2.1% et celui de tamponnade de 0.4% à 1.1% [48].
Il faut noter que les deux premières études ne comprennent pas de malades à haut risque ni sous bi-thérapie, puisqu’elles ont exclu les patients porteurs de stents ou ayant souffert d’un SCA dans un délai d’un an, et que la troisième, qui ne porte que sur une dose unique d'aspirine, affiche un taux d'infarctus global de 14.8%, ce qui laisse à penser que d'autres facteurs que l'antiplaquettaires entrent en ligne de compte [27]. Une étude observationnelle portant sur 847 patients et comprenant pour moitié des cas de chirurgie mineure ne trouve pas de différence significative dans le risque cardiaque des malades opérés sous bi-thérapie, sous monothérapie ou sans traitement antiplaquettaire; malheureusement, aucune différentiation n'est faite dans le délai entre la PCI et l'intervention en-dessous de 12 mois [31]. Comme déjà mentionné, des études basées sur des registres de vastes populations stentées subissant des interventions non-cardiaques mineures, tendent à démontrer que le type de stent et le maintien ou l’arrêt des antiplaquettaires créent peu de différence dans la morbi-mortalité, mais que celle-ci est plutôt liée au risque cardiaque propre du malade [28,67]. Lors d'interventions majeures par contre, la continuation de la bithérapie est un élément fondamental dans la prévention des accidents cardio-vasculaires [57]. Plus la chirurgie est lourde et physiologiquement stressante, plus la protection des antiplaquettaires est importante.
Le risque opératoire est d’autant plus élevé que le délai entre l’événement coronarien et l’opération est plus court, parce que la lésion est par nature instable tant qu’elle n’est pas complètement cicatrisée, c’est-à-dire totalement recouverte d’un endothélium normal. Après PCI et stent passif, les risques de thrombose, d’infarctus et de mortalité sont de 15-35% pendant les 6 premières semaines ; l’incidence décroît à 5-10% dès 6 semaines et devient inférieure à 2% au-delà de 3 mois [61,62]. Après des PAC, le taux de complications ischémiques et de mortalité en cas de chirurgie non-cardiaque est de 10-30% pendant 4-6 semaines ; il est d'environ 5% entre 2 et 3 mois, et de 1% au-delà de 3 mois [8]. Après des stents actifs de 1ère génération, les risques sont plus élevés et les délais plus longs à cause de la très lente endothélialisation [58,73] : le taux d’accidents cardiaques périopératoires est de 20-40% pendant le premier mois et plus du double pendant la 1ère semaine (HR 27.3) [4]; il descend à 6-15% à 3 mois, 5-8% à 6 mois et 2% dès 12 mois [25]. Après les DES de 2ème génération, le taux de mortalité et d'infarctus est de 17%, 10% et 3% lorsque le délai entre la revascularisation et la chirurgie est respectivement de 3 mois, 6 mois et 12 mois; dans cette étude, le maintien ou l'interruption préopératoire des antiplaquettaires ne modifie pas l'incidence d'infarctus, qui survient le plus souvent dans le territoire stenté [64]. Six semaines après des BMS ou des PAC et 6 mois après des DES, le risque devient celui d’une coronaropathie contrôlée (risque intermédiaire de 3-6%, équivalent à 2 facteurs de risque du Revised Cardiac Index) [35]. Il faut attendre 3 mois après des BMS ou des PAC, 3 à 6 mois après des DES de nouvelle génération et 12 mois après des DES de 1ère génération pour que le risque atteigne son plancher (équivalent à 1 facteur de risque) (Figure 29.22) [58,71,73].
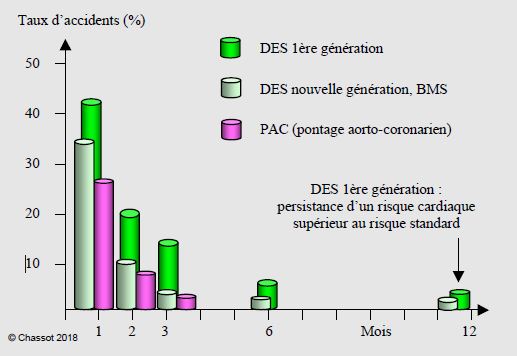
Figure 29.22 : Evolution du risque d’accidents cardiaques périopératoires (mortalité, infarctus, thrombose de stent) chez les malades revascularisés, en fonction du délai entre la revascularisation et l’opération non-cardiaque. Le risque est d’autant plus grand que le délai est plus bref. Une opération vitale peut être conduite dès 1 mois après BMS ou PAC, 1-3 mois après DES 2ème-3ème génération et 6 mois après DES 1ère génération (sous bithérapie) (environ 5% d’accidents cardio-vasculaires) [35,58,71,73].
Dans la quasi-totalité des études publiées, l'arrêt des antiplaquettaires pour permettre une opération dans les 4 premières semaines après PCI et pose de stent s'est soldé par des résultats catastrophiques. Lorsque l'intervention est majeure, la mortalité va de 20% à 75% [20,50,59,62]; le risque d'accident cardiaque est 20 fois plus élevé que lorsque la chirurgie a lieu au-delà de 2 mois [72]. Dans une série danoise de 4'303 patients stentés, le taux d'infarctus et la mortalité sont multipliés par 5 lorsque l'intervention de chirurgie non-cardiaque a lieu pendant le premier mois après la revascularisation (OR 4.82 et 5.87, respectivement) en comparaison des malades non-ischémiques qui ont eu les mêmes opérations [17]. Deux études présentent une vision plus optimiste, essentiellement parce qu'elles contiennent une forte proportion de chirurgie mineure (respectivement 65% et 77%), mais la période précoce y reste dangereuse même si l'incidence d'accidents ischémiques est plus basse. La première portant sur 28'029 patients démontre un taux de morbi-mortalité cardiaque de 12% dans les 6 premières semaines après pose de stent, de 6.4% entre 6 semaines et 6 mois, de 4.2% entre 6 et 12 mois et de 3.5% au-delà d’un an [28]. La deuxième (9'391 patients stentés appariés au double de patients non-stentés) révèle une incidence de complications cardiaques peropératoires de 10-12% pendant les 2 premiers mois après la revascularisation, comparé à 4% dans la population générale [30]. Dans cette situation à risque faible, l’urgence, la présence d’un SCA dans les 6 mois précédents, et les comorbidités du malade ont autant de poids que le délai entre la pose de stent et la chirurgie. Mais quel que soit le mode de revascularisation et le type de chirurgie, le premier mois après l'intervention est la période à plus haut risque et rien ne doit être entrepris pendant ces 4-6 premières semaines [69,70]. Même en respectant le maintien des antiplaquettaires, les premiers mois sont quatre fois plus dangereux qu'au-delà du 6ème mois [56].
Cette chronologie impose des délais entre la revascularisation et une opération non-cardiaque subséquente ; ils sont résumés dans le Tableau 29.8 (voir aussi Recommendations pour la chirurgie non-cardiaque) [10,16,36].

Comme le risque thrombotique est aggravé par la phase d'hypercoagulabilité postopératoire et par l'effet rebond sur l'agrégabilité plaquettaire lors de l'interruption des antiplaquettaires [41,43], il est prudent de prévoir un délai minimum d'un mois entre la fin programmée d'une bithérapie et une intervention chirurgicale élective. Lorsque le traitement antiplaquettaire est suspendu, la mortalité devient directement liée au délai entre la revascularisation et la chirurgie (Figure 29.23) [3,9,33,55,62].
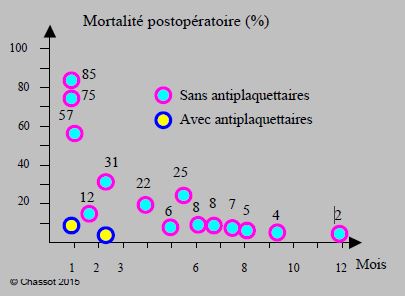
Figure 29.23 : Mortalité des complications cardiovasculaires post-opératoires chez les patients porteurs de stents coronariens dont le traitement antiplaquettaire a été interrompu avant une opération non-cardiaque, en fonction du délai entre la revascularisation et la chirurgie. Courbe construite à partir de 14 études observationnelles (29’941 patients) [16]. Deux d’entre elles ont des données comparatives pour les malades opérés sous antiplaquettaires (points jaunes) ; leur mortalité est de 5% et de 0%. Dans une seule étude [28], l’arrêt ou la continuation des antiplaquettaires ne crée pas de différence, mais les 2/3 de ses cas relèvent d'une chirurgie mineure ambulatoire.
Le profil du taux d’infarctus et de thrombose de stent postopératoires est différent selon le type de stents [50]. Alors qu’il baisse rapidement dans les 3 premiers mois pour les stents passifs (BMS) et n’est plus que 2.8% à 6 mois, il reste plus constant (environ 6%) pendant toute la première année pour les stents actifs (DES) de 1ère génération (Figure 29.24) [51,54]. Mais la mortalité de la thrombose de stent reste très élevée dans ces deux études: 50% et 65%. Le comportement des DES de nouvelle génération, type Biolimus A9, est probablement voisin de celui des BMS.
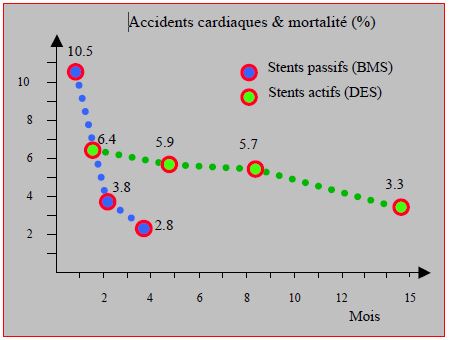
Figure 29.24 : Incidence des accidents cardiaques (infarctus ou thrombose de stent) et de la mortalité postopératoire globale en fonction du délai entre la revascularisation (stents passifs et stents actifs de 1ère génération) et la chirurgie non-cardiaque [51,54]. La mortalité secondaire à la thrombose de stent est respectivement de 50% et de 65% pour les DES et les BMS.
L'accélération des délais avec les DES de nouvelle génération ne doit pas balayer le principe de précaution qui prévaut dans les situations à risque. En effet, avec une mortalité moyenne de 25% et un taux d’infarctus jusqu’à 60% [34], la thrombose de stent sur arrêt périopératoire des antiplaquettaires est un évènement extrêmement dangereux, même s’il est moins fréquent qu’on ne l’a cru. Dans une situation chirurgicale, le risque est aggravé par la phase d'hypercoagulabilité postopératoire, et par le taux de complication cardiaque propre à l'intervention. A cela s'ajoute l'effet rebond sur l'aggrégabilité plaquettaire lors de l'interruption de la bithérapie, même en cas de continuation de l'aspirine. Le risque de thrombose augmente de 2 à 3 fois dans les semaines qui suivent cet arrêt [34,41,43]. De ce fait, il est conseillé de respecter un décalage d'environ un mois entre la fin de l'inhibition P2Y12 et une chirurgie élective. Il apparaît donc que seules des situations exceptionnelles peuvent justifier l’interruption des antiplaquettaires (chirurgie en espace clos ou très hémorragique) [27]. Sans eux, la situation passe d’un état correspondant à une coronaropathie stable à un état de coronaropathie instable [10,16].
| Interruption des agents antiplaquettaires dans le cadre chirurgical |
|
A cause de la réaction inflammatoire systémique, de l’activation plaquettaire et de l'inhibition de la fibrinolyse liées au stress opératoire, la situation est encore plus grave en périopératoire que dans le contexte cardiologique. La mortalité de la thrombose de stent y est en moyenne de 35%. L’incidence d’accidents cardiovasculaires est maximale pendant les 4-6 semaines qui suivent l'événement coronarien et la pose de stent. Pour les DES de 1ère génération, le risque reste élevé pendant 12 mois. Au-delà de 6-12 mois (selon le type de stent), le niveau de risque rejoint l'incidence de complication cardiovasculaire qui est normale pour le type d'opération et pour les comorbidités du malade.
Suspendre les antiplaquettaires en préopératoire transforme une coronaropathie stabilisée en syndrome instable. Seules des situations exceptionnelles peuvent justifier l’interruption des antiplaquettaires. Si le clopidogrel, le prasugrel ou le ticagrelor sont arrêtés, l’aspirine doit être maintenue.
|
© CHASSOT PG, DELABAYS A, SPAHN D Mars 2010, dernière mise à jour Novembre 2019
Références
- AIROLDI A, COLOMBO A, MORICI N, et al. Incidence and predictors of drug-eluting stent thrombosis during and after discontinuation of thienopyridine treatment. Circulation 2007 ; 116 :745-54
- ARIOTTI S, et al. Is bare-metal stent implantation still justifiable in high bleeding risk patients undergoing percutaneous coronary intervention ?: a pre-specified analysis from the ZEUS trial. JACC Cardiovasc Interv 2016; 9:426-36
- ARTANG R, DIETER RS. Analysis of 36 reported cases of late thrombosis in drug-eluting stents placed in coronary arteries. Am J Cardiol 2007; 99:1039-43
- BERGER PB, KLEINMAN NS, PENCINA MJ, et al. Frequency of major noncardiac surgery and subsequent adverse events in the year after drug-eluting stent placement. J Am Coll Cardiol Intv 2010; 3:920-7
- BIONDI-ZOCCAI GGL, LOTRIONTE M, AGOSTINI P, et al. A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50 279 patients at risk for coronary artery disease. Eur Heart J 2006; 27:2667-74
- BITTL JA, BABER U, BRADLEY SM, et al. Duration of dual antiplatelet therapy: a systematic review for the 2016 ACC/AHA guideline focused update on duration of antiplatelet therapy in patients with coronary artery disease: a report of the ACC/AHA task force on clinical practice guidelines. J Am Coll Cardiol 2016; 68:1116-39
- BOGGON R, VAN STAA TP, TIMMIS A, et al. Clopidogrel discontinuation after acute coronary syndromes: frquency, predictors and associations with death and myocardial infarction – A hospital registry-primary care linked cohort (MINAP-GPRD). Eur Heart J 2011; 32:2376-86
- BREEN P, LEE JW, POMPOSELLI F, PARK KW. Timing of high-risk vascular surgery following coronary artery bypass surgery: A 10-year experience from an academic medical centre. Anaesthesia 2004; 59:422-7
- BROTMAN DJ, BAKHRU M, SABER W, et al. Discontinuation of antiplatelet therapy prior to low-risk noncardiac surgery in patients with drug-eluting stents: A retrospective cohort study. J Hosp Med 2007; 2:378-84
- CHASSOT PG, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction. Br J Anaesth 2007; 99:316-28
- COLLET JP. MONTALESCOT G, BLANCHET B, et al. Impact of prior use or recent withdrawal of oral antiplatelet agents on acute coronary syndromes. Circulation 2004; 110:2361-7
- COLLYER TC, REYNOLDS HC, TRUYENS E, et al. Perioperative management of clopidogrel therapy: the effects on in-hospital cardiac morbidity in older patients with hip fractures. Br J Anaesth 2011; 107:911-5
- COLOMBO A, GIANNINI F, BRIGUORI C. Should we still have bare-metal stents available in our catheterization laboratory ? J Am Coll Cardiol 2017; 70:607-19
- DE SOUZA DG, BAUM VC, BALLERT NM. Late thrombosis of a drug-eluting stent presenting in the perioperative period. Anesthesiology 2007 ; 106 :1057-9
- DEVEREAUX PJ, MRKOBRADA M, SESSLER DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med 2014 ; 370 :494-503
- EBERLI D, CHASSOT PG, SULSER T et al. Urologic surgery and antiplatelet drugs after cardiac and cerebrovascular accidents. J Urol 2010; 183:2128-36
- EGHOLM G, KRISTENSEN SD, THIM T, et al. Risk associated with surgery within 12 months after coronary drug.eluting stent implantation. J Am Coll Cardiol 2016; 68:2622-32
- EISENBERG MJ, RICHARD PR, LIBERSAN D, et al. Safety of short-term discontinuation of antiplatelet therapy in patients with drug-eluting stents. Circulation 2009; 119:1634-42
- EISENSTEIN EL, ANSTROM KJ, KONG DF, et al. Clopidogrel use and long-term clinical outcomes after drug-eluting stent implantation. JAMA 2007; 297:159-68
- FERRARI E, BENHAMOU M, CERBONI P, MARCEL B. Coronary syndromes following aspirin withdrawal: a special risk for late stent thrombosis. J Am Coll Cardiol 2005; 45:456-9
- FERRARIS VA, SAHA SP, OESTREICH JH, et al. 2012 update to the Society of Thoracic Surgeons Guidelines on use of antiplatelet drugs in patients having cardiac and noncardiac operations. Ann Thorac Surg 2012 ; 94 :1761-81
- FRANCHI F, ROLLINI F, ANGIOLILLO DJ. Antithrombotic therapy for patients with STEMI undergoing primary PCI. Nat Rev Cardiol 2017; 14: 361-79
- FUJIMOTO H, ISHINURA R, TAO S, et al. Two cases of acute coronary syndrome that occurred by preoperative discontinuation of antiplatelet therapy in the chronic phase after stent implantation. J Cardiol 2009; 54:470-4
- GAGLIA MA, WAKSMAN R. Systematic review of thienopyridine discontinuation and its impact upon clinical outcomes. Eur Heart J 2011; 32:2358-64
- GANDHI NK, ABDEL-KARIM AR, BANERJEE S, et al. Frequency and risk of noncardiac surgery after drug-eluting stent implantation. Catheter Cardiovasc Interv 2011; 77:972-6
- GARCIA RODRIGUEZ LA, CEA-SORIANO L, MARTIN-MERINO E, et al. Discontinuation of low-dose aspirin and risk of myocardial infarction: case-control study in UK primary care. BMJ 2011; 343:d4094
- GERSTEIN NS, CAREY MC, CIGARROA J, SCHULMAN PM. Perioperative aspirin management after POISE-2: some answers, but question remain. Anesth Analg 2015; 120:570-5
- HAWN MT, GRAHAM LA; RICHMAN JS, et al. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013; 310:1462-72
- HO PM, PETERSON ED, WANG L, et al. Incidence of death and acute myocardial infarction associated with stopping clopidogrel after acute coronary syndrome. JAMA 2008; 299:532-9
- HOLCOMB CN, GRAHAM LA, RICHMAN JS, et al. The incremental risk of coronary stents on postoperative adverse events. Ann Surg 2016; 263:924-30
- HOWELL SJ, HOEKS SE, WEST RM, et al. Prospective observational cohort study of the association between antiplatelet therapy, bleeding and thrombosis in patients with coronary stents undergoing noncardiac surgery. Br J Anaesth 2019; 122:170-9
- IAKOVOU I, SCHMIDT T, BONIZZONI E, et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293 :2126-30
- KIM HL, PARK KW, KWAK JJ, et al. Stent-related cardiac events after noncardiac surgery: Drug-eluting stent vs bare-metal stent. Int J Cardiol 2008; 123:353-4
- KOVACIC JC, LEE P, KARAJGIKAR R, et al. Safety of temporary and permanent suspension of antiplatelet therapy after drug eluting stent implantation in contemporary "real-world" practice. J Interven Cardiol 2012; 25:482-92
- LEE TH, MARCANTONIO ER, MANGIONE CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LEVINE GN, BATES ER, BITTL JA, et al. 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68:1082-115
- LLAU JV, FERRANDIS R, SIERRA P, et al. Prevention of the renarrowing of coronary arteries using drug-eluting stents in the perioperative period: an update. Vasc Health Risk Manag 2010; 6:855-67
- MANTZ J, SAMAMA CM, TUBACH F, et al. Impact of preoperative maintenance or interruption of aspirin on thrombotic and bleeding events after elective non-cardiac surery: the multicentre, randomized, blinded, placebo-controlled, STRATAGEM trial. Br J Anaesth 2011; 107:899-910
- MAULAZ AB, BEZERRA BC, MICHEL P, et al. Effect of discontinuing aspirin therapy on the risk of brain ischemic stroke. Arch Neurol 2005; 62:1217-20
- MAURI L, ELMARIAH S, YEH RW, et al. Causes of late mortality with dual antiplatelet therapy after coronary stents. Eur Heart J 2016; 37:378-85
- MAURI L, KEREIAKES DJ, YEH RW, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371:2155-66
- McFADDEN EP, STABILE E, REGAR E, et al. Late thrombosis in drug-eluting coronary stents after discontinuation of antiplatelet therapy. Lancet 2004; 364:1519-21
- MEHRAN R, BABER U, STEG PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary interventions. PARIS: 2 years results from a prospective observational study. Lancet 2013; 382:1714-22
- MEHRAN R, POCOCK S, NIKOLSKY E, et al. Impact of bleeding on mortality after percutaneous coronary intervention results from a patient-level pooled analysis of the REPLACE-2, ACUITY, and HORIZONS-AMI trials. JACC Cardiovasc Interv 2011; 4:654-64
- MIYAZAKI Y, SUWANNASOM P, SOTOMI Y, et al. Single or dual antiplatelet therapy after PCI. Nat Rev Cardiol 2017; 14:294-303
- MONTALESCOT G, BRIEGER D, DALBY AJ, et al. Duration of dual antiplatelet therapy after coronary stenting. J Am Coll Cardiol 2015; 66:832-47
- MUSUMECI G, ROSSINI R, LETTIERI C, et al. Prognostic implications of early and long-term bleeding events in patients on one-year dual antiplatelet therapy following drug-eluting stent implantation. Catheter Cardiovasc Interv 2012; 80:395-405
- MYLES PS, SMITH JA, FORBES A, et al. Stopping vs continuing aspirin before coronary artery surgery. N Engl J Med 2016; 374:728-37
- NAGHAVI M, LINBBY P, FALK E, et al. From vulnerable plaque to vulnerable patient. A call for new definitions and risk assessment strategies. Part I. Circulation 2003; 108:1764-72
- NEWSOME LT, WELLER RS, GERANCHER JC, et al. Coronary artery stents: II. Perioperative considerations and management. Anesth Analg 2008; 107:570-90
- NUTALL GA, BROWN MJ, STOMBAUGH JW, et al. Time and cardiac risk of surgery after bare-metal stent percutaneous coronary intervention. Anesthesiology 2008; 109:588-95
- OSCARSSON A, GUPTA A, FREDRIKSON M, et al. To continue or discontinue aspirin in the perioperative period: a randomized, controlled trial. Br J Anaesth 2010; 104:305-12
- PALMERINI T, STONE GW. Optimal duration of dual antiplatelet therapy after drug-eluting stent implantation: conceptual evolution based on emerging evidence. Eur Heart J 2016; 37:353-64
- RABBITTS JA, NUTALL GA, BROWN MJ, et al. Cardiac risk of noncardiac surgery after percutaneous coronary intervention with drug-eluting stents. Anesthesiology 2008;109: 596-604
- RHEE SJ, YUN KH, LEE SR, et al. Drug-eluting stents thrombosis during perioperative period. Int Heart J 2008; 49:135-42
- ROSSINI R, ANGIOLILLO DJ, MUSUMECI G, et al. Antiplatelet therapy and outcome in patients undergoing surgery following coronary stenting: results of the Surgery After Stenting trial. Catheter Cardiovasc Interv 2017; 89:E13-E25
- ROSSINI R, MUSUMECI G, CAPODANNO D, et al. Perioperative management of oral antiplatelet therapy and clinical outcomes in coronary stent patients undergoing surgery. Results of a multicentre registry. Thromb Haemost 2015; 113:272-82
- SAVONITTO S, CARACCIOLO M, CATTANEO M, DE SERVI S. Management of patients with recently implanted coronary stents on dual antiplatelet therapy who need to undergo major surgery. J Thromb Haemost 2011; 9:2133-42
- SCHOUTEN O, VON DOMBURG RT, BAX JJ, et al. Noncardiac surgery after coronary stenting: Early surgery and interruption of antiplatelet therapy are associated with an increase in major adverse cardiac events. J Am Coll Cardiol 2007; 49:122-4
- SCHULTZ S, SCHUSTER T, MEHILL J, et al. Stent thrombosis after drug-eluting stent implantation: incidence, timing, and relation to discontinuation of clopidogrel therapy over a 4-year period. Eur Heart J 2009; 30:2714-21
- SERRUYS PW, KUTRYK MJB, ONG ATL. Coronary artery stents. N Engl J Med 2006; 354:483-95
- SHARMA AK, AJANI AE, HAMWI SM, et al. Major noncardiac surgery following coronary stenting: When is it safe to operate? Catheter Cardiovasc Interv 2004; 63:141-5
- SILVAIN J, ABTAN J, KEMEIS M, et al. Impact of red blood cell transfusion on platelet agregation and inflammatory response in anemic coronary and noncoronary patients: the TRANSFUSION-2 study. J Am Coll Cardiol 2014; 63:1289-96
- SMITH BB, WARNER MA, WARNER NS, et al. Cardiac risk of noncardiac surgery after percutaneous coronary intervention with second-generation drug-eluting stents. Anesth Analg 2019; 128:621-8
- SPERTUS JA, KETTELKAMP R, VANCE C, et al. Prevalence, predictors, and outcomes of premature discontinuation of thienopyridine therapy after drug-eluting stent placement. Circulation 2006; 113:2803-9
- STONE GW, MAEHARA A, LANSKY AJ, et al. A prospective netural-history study of coronary atherosclerosis. N Engl J Med 2011; 364:226-35
- TOKUSHIGE A, SHIOMI H, MORIMOTO T, et al. Incidence and outcome of surgical procedures after coronary bare-metal and drug-eluting stent implantation: a report from the CREDO-Kyoto PCI/CABG registry cohort-2. Circ Cardiovasc Interv 2012; 5:237-46
- URBAN P, MEREDITH IT, ABIZAID A, et al. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med 2015; 373:2038-47
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur J Cardio-Thorac Surg 2017; 00:1-45
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Hesrt J 2018; 39:213-54
- VAN KUIJK JP, FLU WJ, SCHOUTEN O, et al. Timing of noncardiac surgery after coronary artery stenting with bare metal or drug-eluting stents. Am J Cardiol 2009; 104:1229-34
- WASOWICZ M, SYED A, WIJEYSUNDERA DN et al. Effectiveness of platelet inhibition on major adverse cardiac events in noncardiac surgery after percutaneous coronarxy intervention: a prospective cohort study. Br J Anaesth 2016; 116:493-500
- WIJEYSUNDERA DN, WIJEYSUNDERA HC, YUN L, et al. Risk of elective major noncardiac surgery after coronary stent insertion. A population-based study. Circulation 2012; 126:1355-62
- WILLIS N, SACHDEVA R, URETSKY BF. Bare-metal stent thrombosis after noncardiac surgery greater than 10 years after stent implantation. Catheter Cardiovasc Interv 2011; 78:234-6
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2014; 35:2541-619
