Dans le syndrome du truncus arteriosus, un vaisseau commun surplombant une CIV donne naissance à l’aorte et à l’artère pulmonaire. Ce vaisseau possède une seule grande valve ventriculo-artérielle à 3 ou 4 feuillets, souvent dysplasique et insuffisante, parfois sténosante. Il existe 4 types de truncus (Figure 14.70) [3].
- Type I : l’AP prend racine sur la face latérale gauche du vaisseau commun;
- Type II : les deux artères pulmonaires naissent séparément du truncus;
- Type III : il n’existe qu’une seule artère pulmonaire, le poumon controlatéral étant vascularisé par des collatérales ou des artères bronchiques (MAPCA : major aorto-pulmonary collateral arteries);
- Type IV : défini non par l’origine de l’AP mais par la présence d’une interruption de l’arc aortique, l’origine des AP étant variable.
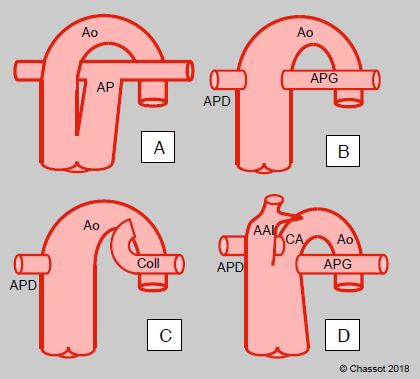
Figure 14.66 : Représentation schématique des différents types de truncus arteriosus. A : type I ; l’AP prend racine sur la face latérale gauche du vaisseau commun. B : type II ; les deux artères pulmonaires naissent séparément du truncus. C : type III ; il n’existe qu’une seule artère pulmonaire, l’autre est remplacée par une grande collatérale ou des artères bronchiques (Coll). D : type IV ; l’arc aortique est interrompu (AAI) après le tronc brachio-céphalique, la crosse et l’aorte descendante (Ao) font suite au canal artériel (CA) ; l’origine des AP est variable [3].
La large CIV assure une égalisation des pressions systémiques et pulmonaires et un mélange complet des sangs veineux et artérialisés, d'où une hypoxémie et une cyanose. Le rapport Qp:Qs dépend du rapport entre les RAP et les RAS (physiologie de ventricule unique). Au fur et à mesure que les RAP baissent après la naissance, le flux pulmonaire augmente au détriment du flux systémique, d'où une acidose métabolique. Pour rétablir l'équilibre, il faut augmenter les RAP (hypoxie, hypercarbie). La présence d'une insuffisance de la valve ventriculo-artérielle impose en plus une surcharge de volume aux ventricules.
La malformation est associée au syndrome de Di George dans 20-25% des cas; ce syndrome est caractérisé par une difficulté d’intubation, un risque d’hypocalcémie et des risques infectieux élevés. La cardiopathie est rapidement symptomatique après la naissance, et se manifeste par une cyanose modérée et une insuffisance ventriculaire congestive. La pression diastolique est basse à cause de la fuite vers le lit pulmonaire, d'où une menace d'ischémie sous-endocardique. La circulation pulmonaire est surchargée et soumise à une pression systémique; sans une restriction au flux (banding), les lésions vasculaires irréversibles de l’HTAP se développent rapidement.
La malformation est associée au syndrome de Di George dans 20-25% des cas; ce syndrome est caractérisé par une difficulté d’intubation, un risque d’hypocalcémie et des risques infectieux élevés. La cardiopathie est rapidement symptomatique après la naissance, et se manifeste par une cyanose modérée et une insuffisance ventriculaire congestive. La pression diastolique est basse à cause de la fuite vers le lit pulmonaire, d'où une menace d'ischémie sous-endocardique. La circulation pulmonaire est surchargée et soumise à une pression systémique; sans une restriction au flux (banding), les lésions vasculaires irréversibles de l’HTAP se développent rapidement.
La correction chirurgicale est conduite entre 10 et 20 jours de vie [2]. Elle consiste en un patch sur la CIV qui redirige le flux du VG vers l’aorte (en l’occurrence, le truncus); la valve néo-aortique est reconstruite ou remplacée si elle est insuffisante. L’AP est déconnectée du tronc et anastomosée à un conduit valvé VD-AP (homogreffe, Contegra™). Dans certains cas, on crée une petite CIA de décharge si les pressions droites sont très élevées; elle aide à maintenir le débit cardiaque, mais au prix d’une désaturation artérielle. La mortalité opératoire est de 5-18% [1]. Les facteurs aggravants sont le jeune âge (< 1 mois), l’insuffisance de la valve, la défaillance ventriculaire et la présence d’anomalie coronaire ou d’interruption de l’arc aortique.
La fenêtre aorto-pulmonaire est une large fistule congénitale entre l'aorte ascendante et le tronc de l'AP. Bien qu'elle ne lui soit pas apparentée anatomiquement, elle se comporte comme un truncus arteriosus du point de vue hémodynamique et implique les mêmes contraintes anesthésiques.
La fenêtre aorto-pulmonaire est une large fistule congénitale entre l'aorte ascendante et le tronc de l'AP. Bien qu'elle ne lui soit pas apparentée anatomiquement, elle se comporte comme un truncus arteriosus du point de vue hémodynamique et implique les mêmes contraintes anesthésiques.
Anesthésie
Le but est de maintenir un flux systémique adéquat, mais de diminuer le plus possible le flux pulmonaire, de manière à obtenir un Qp/Qs équilibré (Qp/Qs = 1). Le départ en CEC est parfois précipité en raison d’un déséquilibre réfractaire du Qp/Qs.
- Hypoventilation, hypercarbie (éventuellement FiCO2 2-4%), FiO2 0.21-0.3;
- PEEP 5-10 cm H2O;
- Vasodilatation systémique ; la pression artérielle doit cependant rester sufffisante pour assurer la perfusion coronarienne, surtout si une insuffisance de la valve ventriculo-artérielle abaisse la PA diastolique;
- Soutien inotrope; milrinone (0.5-1.0 mcg/kg/min) ± adrénaline (0.01-0.1 mcg/kg/min);
- Anesthésie profonde avec hautes doses de fentanyl (50-75 mcg/kg), adjonction de midazolam, éventuellement etomidate pour l’induction.
Un lac serré autour de l’AP dès l’ouverture du péricarde permet de contrôler momentanément le débit pulmonaire pour le départ en pompe. Après la CEC, il est important de prévenir les crises vasospastiques pulmonaires (hyperventilation, fentanyl, NO•, PGE1, magnésium, normothermie), car ces enfants ont un arbre vasculaire pulmonaire hyperréactif et l’HTAP est courante. Il est judicieux de placer un cathéter dans l’AP pour mesurer la SvO2 en continu. Un soutien inotrope (dobutamine, adrénaline-milrinone) est habituellement nécessaire. L’extubation est tardive (> 24 heures).
Les complications immédiates les plus fréquentes sont la crise d’HTAP avec insuffisance du VD, l’insuffisance du VG, la régurgitation néo-aortique et le bloc AV complet. A long terme, la reconstruction et le conduit deviennent relativement sténotiques par rapport à la croissance de l’enfant et obligent à une réintervention.
| Truncus arteriosus |
|
Un vaisseau commun surplombe une CIV et donne naissance à l’aorte et à l’artère pulmonaire.
Prise en charge: augmenter le flux systémique et diminuer le flux pulmonaire pour Qp/Qs = 1
- Hypoventilation, hypercarbie, acidose respiratoire, vasodilatation systémique
- Risque ischémique si PA diastolique basse (insuffisance de la valve ventriculo-artérielle)
- Insuffisance ventriculaire congestive (dobutamine, milrinone)
Après correction, risque élevé d’HTAP et d’insuffisance ventriculaire congestive
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- BROWN JW, RUZMETOV M, OKADA Y, et al. Truncus arteriosus repair : outcomes, risk factors, reoperation and managment. Eur J Cardiothorac Surg 2001 ; 20 :221-7
- HONJO O, Van ARSDELL GS. Cardiovascular procedures : surgical considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1589-608
- VAN PRAAGH R, VAN PRAAGH S. The anatomy of common aortico-pulmonary trunk (truncus arteriosus communis) and its embryologic implications. A study of 57 necropsy cases. Am J Cardiol 1965; 16:406-25
