Lorsque l’anticoagulation est assurée pas un agent de longue durée et ne peut pas être interrompue, comme c’est le cas dans la FA à haut risque ou la prothèse valvulaire mécanique, il est d’usage de relayer le traitement par une héparine de courte demi-vie pour limiter à la durée de l’intervention chirurgicale le temps pendant lequel le malade est hors de l’effet anticoagulant. Les mêmes remarques faites pour le renversement s’appliquent ici: le but n’est pas la normalisation de la coagulation, qui présenterait un danger majeur d’accident vasculaire, mais le meilleur compromis entre le risque hémorragique chirurgical et le risque thrombo-embolique de la maladie. La substitution est essentiellement justifiée par la mortalité plus élevée en cas de thrombose veineuse (embolie pulmonaire) ou artérielle (infarctus, ictus) qu’en cas d’hémorragie majeure.
Bien qu’elle soit traditionnellement considérée comme une règle de l’art, la substitution par une héparine est actuellement remise en question, particulièrement pour les nouveaux anticoagulants [1,7,17]. En effet, les études récentes démontrent qu’elle augmente 3 à 5 fois le risque hémorragique sans mettre à l’abri des complications thrombotiques (incidence inchangée). Une méta-analyse portant sur 7'118 patients sous AVK ayant été substitués par une héparine en préopératoire montre que le risque de saignement mineur et majeur est accru (HR 5.4 et 3.6, respectivement), alors que le risque thrombo-embolique est inchangé (HR 0.84) [14]. Il se peut même que le taux d’hématome soit supérieur avec la substitution par rapport à la continuation du traitement de base [3]. Un registre prospectif de 2'179 patients sous NACO (rivaroxaban, apixaban et dabigatran) trouve une incidence d’évènements thrombo-emboliques similaire chez les patients substitués (1.6%) et chez ceux qui ne le sont pas (0.8%), mais des pertes sanguines cinq fois plus importantes chez les premiers (2.7%) par rapport aux seconds (0.5%) (OR 5.0) [2]. Avec des critères sélectifs très stricts dans la sélection des études, une revue systématique démontre que l'interruption des AVK n'augmente pas le risque de thrombo-embolie (RR 0.65) mais diminue celui d'hémorragie (RR 0.41); de plus, la substitution semble déstabiliser le traitement anticoagulant [11]. Dans l’état actuel de nos connaissances, la substitution n’est donc formellement indiquée que chez les malades à très haut risque thrombotique (score CHADS élevé, prothèse valvulaire cardiaque mécanique, anamnèse d'AVC embolique) qui sont sous AVK. Dans les autres situations, elle est n’offre probablement aucun bénéfice et relève d’une décision au cas par cas. Hormis les très hauts risques thrombotiques lors d'une interruption de > 96 heures, elle n’est pas justifiée pour les NACO, car elle augmente le risque hémorragique (HR 3.5) sans diminuer le risque d’AVC ni de thrombo-embolie [2,4,7,13]. Comme une bonne partie des saignements survient dans le postopératoire, il est recommandé de ne pas redémarrer l’anticoagulation de substitution avant 24 à 72 heures, selon la qualité de l’hémostase [16].
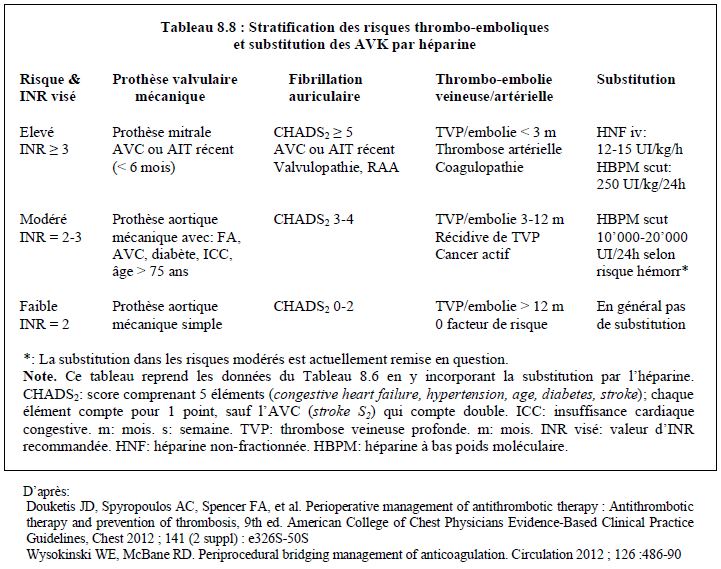
La prise en charge périopératoire des patients sous AVK peut être représentée par un algorithme (Figure 8.15) [5,6,9]. Elle est basée sur une stratification du risque thrombo-embolique en 3 catégories comme décrites dans le Tableau 8.8.
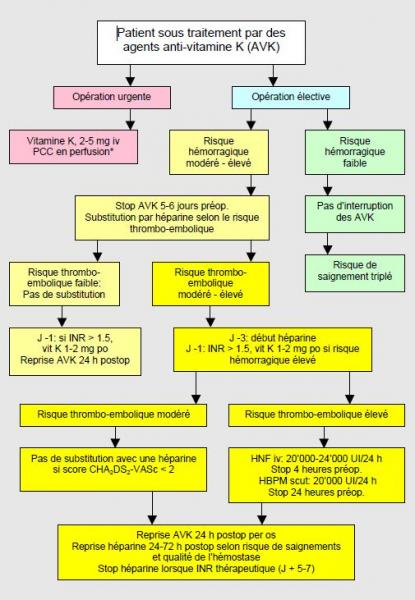
Figure 8.15 : Algorithme de prise en charge des malades sous agents anti-vitamine K (AVK) en préopératoire de chirurgie non-cardiaque, basé sur le risque hémorragique chirurgical et sur le risque de la maladie thrombo-embolique [adapté d’après références [9,17]. La substitution par une héparine n'est plus recommandée lorsque le risque thrombo-embolique est modéré (score CHA2DS2-VASc ≤ 2). PCC: prothrombin complex concentrate. *: selon pertes sanguines et non à titre prophylactique.
- Les opérations mineures ou non-hémorragiques (dentisterie, excision cutanée, cataracte, biopsie, endoscopie, pace-maker, etc) peuvent se dérouler sans interruption des AVK, bien que le taux de saignement soit 3 fois plus élevé. Le bloc rétrobulbaire présente un risque d’hématome de 0.7% seulement sous AVK [12]. En périopératoire, l’INR visé est à la limite inférieure de la zone thérapeutique.
- Arrêt des AVK 5-6 jours avant les interventions à risque hémorragique intermédiaire ou majeur (Marcoumar® : arrêt 10 jours).
- Substitution avec une héparine 3 jours avant l’opération en fonction du risque thrombo-embolique.
- Cas à risque thrombo-embolique élevé : HNF 12-15 UI/kg/h (20’000-30’000 UI/24 h) en perfusion, sans bolus; arrêt 4-6 heures avant l’intervention. Alternative : HBPM à dose thérapeutique (250 UI/kg/24 h, ≥ 20’000 UI/24 h) en 2 doses quotidiennes sous-cutanées; arrêt 24 heures avant l’intervention ; si le risque hémorragique est élevé, la dernière administration (24 h préop) est une demi-dose.
- Cas à risque thrombo-embolique modéré : HBPM à dose thérapeutique (250 UI/kg/24 h) en 2 doses quotidiennes sous-cutanées; arrêt 24 heures avant l’intervention. Alternative dans les cas à risque hémorragique élevé: HBPM à dose prophylactique (10’000 UI/24h sous-cut); arrêt 12-24 heures avant l’intervention. Dans cette indication, la substitution n'est plus recommandée: dans les CHADS2 2-3, elle ne modifie pas le risque thrombotique par rapport à l'arrêt simple, mais elle augmente le risque de saignement [4,8].
- Cas à risque thrombo-embolique faible : pas de substitution.
- Préférence pour l’HBPM sous-cutanée autant que possible, sauf si la clairance de la créatinine est < 30 mL/min, où l’HNF iv est recommandée.
- L’administration intraveineuse nécessite une hospitalisation, alors que la forme sous-cutanée permet un traitement à domicile.
- Patients avec une anamnèse de HIT et anticorps anti-héparine: bivalirudine ou argatroban.
- Interruption de l’héparine 4 heures (HNF intraveineuse) à 12-24 heures (HBPM) avant l’intervention.
- Risque embolique élevé (< 1 mois après une thrombose veineuse des membres inférieurs ou du petit bassin) et opération en urgence (substitution impossible): pose d’un filtre amovible sur la veine cave inférieure.
- Reprise des AVK 12-24 heures postopératoires (le soir ou le lendemain de l’opération).
- Reprise de l’héparine dans les 24-48 heures postopératoires pour 4-6 jours ; le délai peut être prolongé à 72 heures si le risque hémorragique est très élevé ; la reprise à moins de 24 heures double le risque hémorragique postopératoire mais est préférable en cas de risque thrombo-embolique élevé [15]. L’héparine est arrêtée seulement lorsque l’INR est de retour dans la zone thérapeutique.
Les nouveaux anticoagulants oraux (dabigatran, rivaroxaban, apixaban, edoxaban) ont des demi-vies d’environ 12 heures nécessitant une interruption de 48 heures, voir 3-5 jours chez les personnes âgées et les insuffisants rénaux. Leurs antidotes ne sont pas encore disponibles, sauf pour le dabigatran. Généralement, il n’y a pas lieu de mettre en route un relai avec une héparine pour ces substances, sauf dans les cas à très haut risque de thrombose comme les prothèses valvulaires mécaniques, mais ces derniers sont de préférence sous AVK [16]. Les NACO ayant une pharmacocinétique superposable à celle des HBPM, une substitution par ces dernières n'a aucun sens ni aucune indication [2,10,13]. En cas de doute dans le cadre préopératoire, la meilleure attitude est de doser l’anticoagulant (effet anti-Xa calibré pour la substance pour le rivaroxaban, l'edoxaban et l’apixaban, effet anti-IIa ou Hemoclot™ pour le dabigatran). Si le taux est élevé, la substitution n’est pas nécessaire ; s’il est bas, l’attente est inutile et le malade est opérable sans délai.
Lors de la reprise postopératoire dans les cas à haut risque hémorragique et haut risque thrombo-embolique, il est concevable de débuter le traitement anticoagulant pas de l'héparine non-fractionnée pour laquelle la protamine est un antidote efficace et toujours disponible. Le NACO est repris lorsque la situation est stabilisée, en veillant à ce que les deux substances ne soient jamais administrées simultanément.
| Substitution périopératoire des anticoagulants |
|
La substitution des AVK par une héparine est réservée aux cas à haut risque thrombo-embolique. Dans les autres situations, elle augmente 3 à 5 fois le risque de saignement sans diminuer le risque thrombo-embolique. Elle n’est pas conseillée dans les interventions à haut risque hémorragique ni chez les malades à bas risque thrombo-embolique. Elle n’est pas recommandée avec les nouveaux anticoagulants oraux (dabigatran, rivaroxaban, apixaban, edoxaban).
Dans les situations à risque thrombo-embolique élevé (thrombose veineuse profonde récente, FA CHADS2 > 4, prothèse mécanique mitrale), l’AVK est remplacé par une héparine de courte demi-vie. Le but n’est pas la normalisation de la coagulation, qui présenterait un danger majeur d’accident vasculaire, mais le meilleur compromis entre le risque hémorragique chirurgical et le risque thrombo-embolique de la maladie.
Substitution des AVK :
- Stop AVK 5 jours préop (Marcoumar 10 j)
- Substitution avec une héparine 3 jours avant l’opération
- Interruption de l’héparine 4-6 heures (HNF iv) à 24 heures (HBPM scut) préopératoires
- Reprise des AVK à ≤ 24 heures postopératoires
- Reprise de l’héparine 12-48 heures postopératoires, stoppée lorsque que l’INR est dans les
valeurs thérapeutiques
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- BARON TH, KAMATH PS, McBANE RD. Management of antithrombotic therapy in patients undergoing invasive procedures. N Engl J Med 2013; 368:2113-24
- BEYER-WESTENDORF J, GELBRICHT V, FORSTER K, et al. Peri-interventional management of novel oral anticoagulants in daily care : results from prospective Dresden NOAC registry. Eur Heart J 2014 ; 35:1888-96
- BIRNIE DH, HEALEY JS, WELLS GA, et al. Pacemaker or defibrillator surgery without interruption of anticoagulation. N Engl J Med 2013 ; 368 :2084-93
- DOHERTY JU, GLUCKMAN TJ, HUCKER WJ, et al. 2017 ACC Expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017; 69:871-98
- DOUKETIS JD. Perioperative management of patients who are receiving warfarin therapy: an evidence-based and practical approach. Blood 2011; 117:5044-9
- DOUKETIS JD, BERGER PB, DUNN AS, et al. The perioperative management of antithrombotic therapy. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest 2008; 133:299S-339S
- DOUKETIS JD, HEALEY JS, BRUECKMANN M, et al. Perioperative bridging anticoagulation during dabigatran or warfarin interruption among patients who had an elective surgery ot procedure. Thromb Haemost 2015 ; 113:625-32
- DOUKETIS JD, SPYROPOULOS AC, KAATZ S, et al. Perioperative bridging anticoagulation in patients with atrial fibrillation. N Engl J Med 2015; 373:823-33
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy : Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ; 141 (2 suppl) : e326S-50S
- DROUET L, BAL DIT SOLLIER C, STEINER T, et al. Measuring non-vitamin K antagonist oral anticoagulant levels: When is it appropriate and which methods should be used ? Int J Stroke 2016; 11:748-58
- HOVAGUIMIAN F, KÖPPEL S, SPAHN DR. Safety of anticoagulation interruption in patients undergoing surgery or invasive procedures: A systematic review and meta-analyses of randomized trials and non-randomized studies. World J Surg 2017; doi 10.1007/s00268-017-4072-x
- KATZ J, FELDMAN MA, BASS EB, et al. Risks and benefits of anticoagulant and antiplatelet medication use before cataract surgery. Ophthalmology 2003; 110:1784-8
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- SIEGAL D, YUDIN J, KAATZ S, et al. Periprocedural heparin bridging in patients receiving vitamin K antagonists : systematic review and meta-analysis of bleeding and thromboembolic rates. Circulation 2012 ; 126 :1630-9
- TAFUR AJ, McBANE R, WYSOKINSKI WE, et al. Predictors of major bleeding in peri-procedural anticoagulation management. J Thromb Haemost 2012; 10:261-7
- VAN VEEN JJ, MAKRIS M. Management of perioperative anti-thrombotic therapy. Anaesthesia 2015 ; 70 (Suppl.1) : 58-67
- WYSOKINSKI WE, McBANE RD. Periprocedural bridging management of anticoagulation. Circulation 2012 ; 126 :486-90
