La CIV représente 10% des cardiopathies congénitales rencontrées chez l'adulte et 30% de celles découvertes à la naissance [2]. Le septum interventriculaire est musculaire, à l'exception de sa partie supérieure située sous la valve aortique, qui est membraneuse. Une communication entre les deux ventricules peut survenir à quatre endroits différents (Figure 15.27) [1].
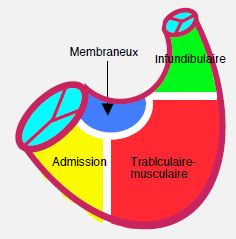
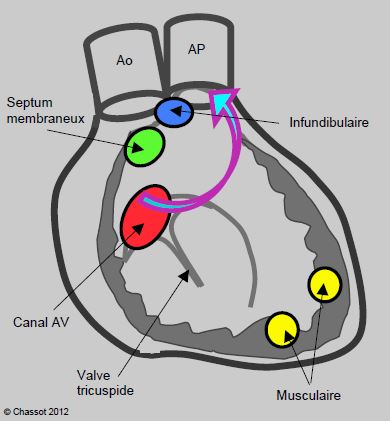
Figure 15.27 : Schéma représentant les différentes possibilités anatomiques de communications interventriculaires (CIV). La CIV du septum membraneux est typique de la tétralogie de Fallot ; la CIV de la chambre d’admission est celle que l’on rencontre ans le canal AV. Les CIV basales (septum membraneux, chambre d’admission et infundibulaire ou supracristale) sont situées près de la chambre de chasse du VD ; de ce fait, leur flux court-circuite la cavité du VD (flèche) [5,6]. A gauche, schéma du septum interventriculaire vu depuis le VD.
- CIV membraneuse ou périmembraneuse (Vidéo et Figure 15.28): la plus fréquente (70% des cas) ; elle est typique de la tétralogie de Fallot. Elle peut se fermer progressivement de manière spontanée.
Vidéo: CIV membraneuse en position sous-aortique dans un cas de tétralogie de Fallot.
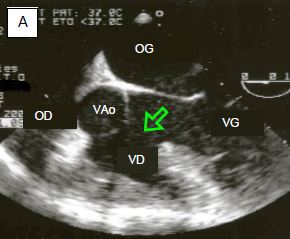
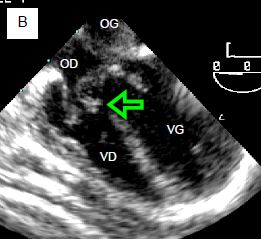
Figure 15.28 : CIV membraneuse. A : orifice bien visible là où devrait se trouver la partie membraneuse du septum interventriculaire ; cette CIV est typique de la tétralogie de Fallot. B : CIV en voie de fermeture par un accolement du feuillet septal de la valve tricuspide.
- CIV musculaire (20% des cas): elle est souvent multiple (swiss cheese septum) et peut se refermer par hypertrophie du septum (Vidéo et Figure 15.29).
Vidéo: CIV musculaire à travers le septum interventriculaire; elles est mieux visible au flux couleur qu'en imagerie bidimensionnelle simple.
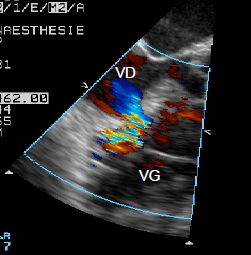
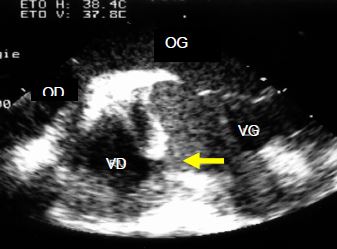
Figure 15.29 : Image ETO de CIV musculaire. Bien qu’elle serpente habituellement entre les trabéculations et ne soit bien visible qu'au flux couleur (à gauche), la CIV illustrée à droite offre un aspect à l'emporte-pièce, ce qui est assez rare.
- CIV de la chambre d'admission (5-10% des cas): elle fait partie du canal AV et apparaît en dessous et entre les feuillets septaux de la valve mitrale et de la valve tricuspide (Vidéo et Figure 15.30); elle peut être spontanément occluse par le feuillet septal de la tricuspide.
Vidéo: CIV de la chambre d'admission située sous la valve tricuspide; elle est typique du canal atrio-ventriculaire.
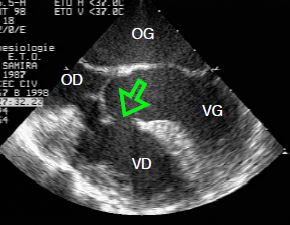
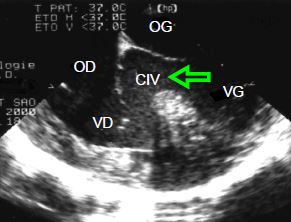
Figure 15.30 : Images ETO de CIV de la chambre d’admission, situées sous la valve tricuspide, dans la partie proximale du septum interventriculaire. Ce type de CIV fait partie du canal AV, en l’occurrence partiel puisqu’il n’y pas de CIA ostium primum associée. Les insertions septales de la valve mitrale et de la tricuspide sont au même niveau, ce qui est typique du canal AV.
- CIV infundibulaire ou supracristale (5% des cas) (Vidéo et Figure 15.31): elle se situe juste en dessous de la valve pulmonaire et communique avec la chambre de chasse gauche sous la valve aortique; ce voisinage induit fréquemment le prolapsus d'un ou de deux feuillets de la valve aortique (coronaire droit et plus rarement non-coronaire), ce qui conduit à une insuffisance aortique.
Vidéo: CIV supracristale, située entre les chambres de chasse gauche et droite; présence d'une minime insuffisance aortique.
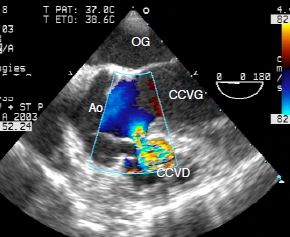
Figure 15.31 : Image de CIV infundibulaire ou supracristale, située sous la valve aortique ; le passage est démontré par le flux Doppler couleur. Cette CIV fait communiquer les deux chambres de chasse entre elles.
La fermeture spontanée est un évènement assez fréquent dans les CIV de la chambre d’admission, périmembraneuses et musculaires, puisque ceci survient dans 40% des cas [13]. La CIV réalise un shunt G-D non-cyanogène qui surcharge la circulation pulmonaire. Contrairement aux CIV acquises qui sont musculaires, inférieures et apicales, la majorité des CIV congénitales se situent anatomiquement très haut au niveau de la chambre d'admission et de la chambre de chasse des ventricules. Le sang qui emprunte le shunt court-circuite en quelque sorte la cavité ventriculaire droite; le travail de pression et de volume est effectué par le VG, qui est la force propulsive du flux à travers le shunt et à travers les poumons. Le VD est un conduit passif qui n'est mis à contribution et ne s’hypertrophie que lorsque se développe une hypertension pulmonaire. La CIV provoque donc une surcharge de volume pour le VG, qui doit propulser le sang à travers le shunt dans le circuit pulmonaire; ce volume lui revient par l'OG (Vidéo et Figure 15.32). C'est donc en premier lieu une insuffisance gauche qui guette le malade porteur d'une CIV (Figure 15.33) [4].
Vidéo: Hypertrophie dilatative du VG due à la surcharge de volume par la CIV.
Vidéo: Hypertrophie dilatative du VG due à la surcharge de volume par la CIV.
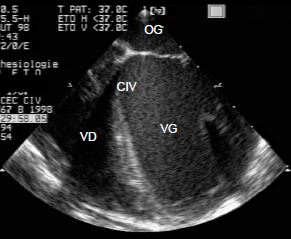
Figure 15.32 : Représentation schématique du shunt d'une CIV. Le sang propulsé par le VG à travers la CIV est éjecté dans l’AP, d’où il revient à l’OG et au VG. La surcharge de volume est donc pour le ventricule gauche. Le ventricule droit fonctionne comme un conduit passif et ne s'hypertrophie que lorsque la pression pulmonaire devient élevée.
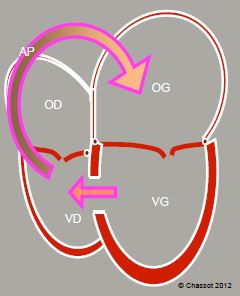
Figure 15.33 : Surcharge de volume et dilatation du VG en cas de CIV.
L'auscultation révèle un souffle systolique râpeux irradiant en roue de char depuis le bord gauche du sternum, avec un thrill systolique prononcé. Les patients adultes peuvent se subdiviser en quatre groupes en fonction du retentissement hémodynamique de la lésion [8,12,19].
- CIV fermée spontanément ou chirurgicalement; il n'y a plus de shunt, ou seulement un débit résiduel minime sans importance hémodynamique; les pressions droites sont normales. L'espérance de vie de ces patients est normale si la fermeture a eu lieu avant l'âge de 3 ans.
- CIV petite et restrictive avec un shunt faible; le débit pulmonaire est peu augmenté et les pressions pulmonaires sont à la limite supérieure de la norme, mais il ne se développe pas d'HTAP. Même si le risque d'endocardite est augmenté, l'espérance de vie est bonne.
- CIV modérée avec shunt significatif; les pressions pulmonaires sont élevées; le VD est hypertrophié. L'espérance de vie est de 86% à 25 ans.
- CIV non-restrictive et HTAP sévère avec syndrome d'Eisenmenger (RAP > 800•dynes•cms-5) et shunt bidirectionnel (voir Hypertension pulmonaire); la surcharge de pression provoque une hypertrophie puis une défaillance ventriculaire droite avec dilatation du VD, insuffisance tricuspidienne et stase systémique. Le débit du shunt diminue à cause de l'égalisation progressive des pressions entre le VG et le VD; non-traités, 40% des patients décèdent avant 25 ans. Un rapport RAP/RAS > 0.7 est une contre-indication à la correction chirurgicale car le risque est prohibitif [7].
A l'examen échocardiographique, l'artère pulmonaire et les cavités gauches sont dilatées parce que ce sont les chambres de réception du shunt [3,5,10]. Le VD est hypertrophié et dilaté en fonction du degré d'hypertension pulmonaire. L'échocardiographie Doppler révèle le passage du flux G-D. Celui-ci présente plusieurs caractéristiques (Figure 15.34).
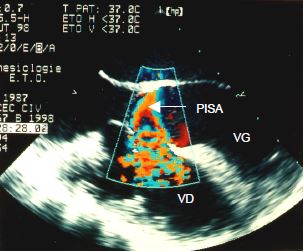
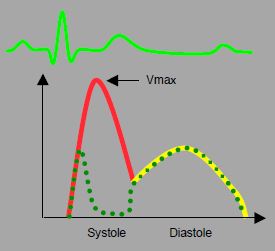
Figure 15.34 : Caractéristiques du flux d’une CIV. Au Doppler couleur, on voit un une zone d’accélération concentrique (PISA) en amont de l’orifice, du côté ventriculaire gauche, et des tourbillons au sein de la cavité du VD ; on peut suivre le flux à travers la CIV. Au Doppler spectral, l’image est celle d’un flux systolo-diastolique à prédominance systolique. La vélocité du flux est fonction du gradient de pression entre le VD et le VG ; elle va diminuer au fur et à mesure que s’installe une hypertension pulmonaire et une décompensation droite. Le flux diastolique peut s’inverser (D-G) en cas de défaillance droite, la Ptd devenant plus haute à droite qu’à gauche. La trace pointillée est celle d’un flux de CIV musculaire, dont le conduit est obstrué momentanément par la contraction myocardique en systole.
- Flux systolo-diastolique; la composante systolique a une vélocité maximale de 2-4 m/s. Elle est atténuée ou absente dans les CIV musculaires à cause de la contraction du myocarde.
- Dans les shunts restrictifs (orifice de petite taille), la Vmax du flux est élevée (4 m/s) et de direction strictement G-D. Dans les shunts non-restrctifs (orifice de grande taille), les pressions gauche et droite tendent à s'égaliser et la Vmax du flux est basse; ce shunt peut devenir bidirectionnel.
- Passage continu au flux couleur, avec tourbillons de réception au sein du VD, en général mieux visibles pendant la diastole car ils sont emportés par le flux normal en systole.
- Zone d'accélération concentrique du côté gauche (PISA: proximal isovelocity surface area); lorsque le shunt est restritif, la dimension du PISA est proportionnelle à la quantité de sang qui passe à travers la CIV (Vidéo CIV flux) [11]. Le PISA est absent dans les shunts non-restrictifs.
En présence d'une CIV, la pression qui règne dans le VD en systole est contaminée par celle du VG qui propulse le flux du shunt, ce qui biaise le calcul de la pression pulmonaire par l’intermédiaire de la vélocité de l'IT (voir Figure 15.7). Par contre, il est possible de calculer la pression systolique du VD par la vélocité du flux du shunt. La vélocité maximale (Vmax) du shunt représente la différence de pression en systole entre le VG et le VD; soustraite de la pression artérielle systémique (PAs) (en l'absence de pathologie aortique), elle donne la pression systolique (Ps) du VD [5]:
PsVD = PAs - 4 (Vmax CIV)2
La fermeture chirurgicale de la CIV (patch ou fermeture directe) est impérative si le shunt est modéré ou majeur (Qp/Qs ≥ 1.5), si le VG est dilaté à cause de la surcharge de volume, si la lésion fait partie d'un syndrome anatomique complexe (canal AV, tétralogie de Fallot), ou si elle est située entre les chambres de chasse à cause du risque d'insuffisance aortique [9,15,16]. Une correction intervenue dans les trois premières années de vie assure une conservation de la fonction ventriculaire et une circulation pulmonaire normale. Mais la proximité des faisceaux de conduction rend fréquents les blocs de branche ou blocs AV complets dans le postopératoire, avec une forte proportion de malades dépendant d'un pace-maker définitif [14]. Beaucoup de CIV musculaires et certaines CIV périmembraneuses peuvent être occluses par voie percutanée avec une morbi-mortalité très basse (1-2%). Après correction, les complications les plus courantes sont l’insuffisance aortique ou tricuspidienne, la CIV résiduelle, l’obstruction d’une chambre de chasse et les blocs AV. La fermeture de CIV est contre-indiquée si le rapport RAP/RAS est > 0.65, la PAPm > 0.5 PAM ou en cas d’HTAP irréversible [15,16,18].
Anesthésie
Afin de ne pas déséquilibrer l'hémodynamique, on recherche les conditions qui diminuent le débit du shunt G-D (voir Figure 15.20). Ce sont:
- Une diminution des pressions systémiques (vasodilatation artérielle);
- Une augmentation des pressions droites (vasoconstriction pulmonaire).
L'anesthésie générale sera conduite sous légère hypercarbie, FiO2 basse (0.3) et PEEP, par exemple avec de l’isoflurane. Ceci est valable pour autant qu'il n'existe pas d'hypertension pulmonaire préalable, auquel cas cette dernière pathologie est prioritaire. En chirurgie non-cardiaque, l'anesthésie loco-régionale rachidienne rempli bien les conditions requises [6].
Les patients porteurs de CIV sont très sensibles à l'hypovolémie. Bien que leur volume circulant soit augmenté, une partie de celui-ci ne fait que tourner dans les poumons par le shunt; or cette portion est obligatoire (elle dépend du diamètre de l'orifice), et se trouve sous un régime de pression inférieur à la pression systémique. Une perte de volume circulant se fera donc essentiellement aux dépens du volume qui circule en périphérie. La vasoconstriction artérielle de l'hypovolémie ne fait que déverser une plus grande proportion de volume dans le circuit du shunt au détriment de la perfusion systémique. Par ailleurs, la CIV est la cardiopathie qui occasionne le moins d’arythmies [2].
Après correction de CIV par patch, une petite fuite résiduelle est tolérable pour autant que les conditions suivantes soient remplies [17]:
- Diamètre de la CIV résiduelle < 2 mm;
- Pas de zone de convergence de flux du côté gauche;
- Enrichissement de la saturation dans l'AP < 5%.
Un examen attentif de la tricuspide est recommandé, car le feuillet septal peut être soumis à une traction lors de la fermeture d'une CIV périmembraneuse ou de la chambre d’admission. Lors d'une réparation de CIV infundibulaire, c'est le feuillet coronarien droit ou le feuillet non-coronaire de la valve aortique qui peut être rétracté et conduire à une insuffisance aortique. La technique de réparation trans-auriculaire droite nécessite une désinsertion partielle de la tricuspide, qui doit être reconstruite; le degré de fuite résiduelle doit être clairement évalué [4].
| Communication interventriculaire (CIV) |
|
Caractéristiques :
- Shunt G → D non cyanogène, débit pulmonaire augmenté (Qp ↑, Qp/Qs > 1.5)
- Chambres de réception dilatées: AP, OG, VG
- Surcharge de volume pour le VG
- Shunt restrictif: PAP à la limite supérieure de la norme
- Shunt non-restrictif: HTAP, surcharge de pression pour le VD, HVD
- HTAP sévère chez 50% des adultes (RAP 500-800 dynes•cm•s-5)
Pour diminuer le shunt: abaisser les RAS, augmenter les RAP (en l’absence d’HTAP)
Recommandations pour l’anesthésie :
- AG avec isoflurane
- ALR rachidienne (rachianesthésie, péridurale)
- Ventilation: FiO2 0.3, hypercarbie (sauf si HTAP)
- Hypovolémie mal tolérée à cause de la séquestration de volume dans le circuit pulmonaire
- Le cas échéant, prise en charge spécifique de l’insuffisance du VG et de l’HTAP (HVD)
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Décembre 2019
Références
- AMMASH NM, WARNES CA. Ventricular septal defects in adults. Ann Int Med 2001; 135:812-9
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BETTEX D, CHASSOT PG. Malformations congénitales de l'adulte. In: BETTEX D, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie – réanimation. Paris: Pradel-Masson, Williams & Wilkins, 1997, 171-87
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital hesart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- CHASSOT PG, BETTEX D. Perioperative transoesophageal echocardiography in adult congenital heart disease. In: POELAERT J, SKARVAN K. Transoesophageal echocardiography in anaesthesia. London, BMJ Book, 2004
- CHASSOT PG, BETTEX DA. Anesthesia and adult congenital heart disease. J Cardiothorac Vasc Anesth 2006; 20:414-37
- DALIENTO L, SOMERVILLE J, PRESBITERO P, et al. Eisenmenger syndrome. Factors relating to deterioration and death. Eur Heart J 1998; 19:1845-55
- KIDD L, DRISCOLL DJ, GERSONY WM, et al. Second natural history study of congenital heart defects. Results of patients with ventricular septal defects. Circulation 1993; 87(Suppl I):38-51
- LUN K, LI H, LEUNG MP. Analysis of indications for surgical closure of subarterial ventricular septal defect without aortic cusp prolapse and aortic regurgitation. Am J Cardiol 2001; 87:1266-70
- MILLER-HANCE WC, SILVERMAN NH. Transesophageal echocardiography (TEE) in congenital heart disease with focus on the adult. Cardiol Clinics 2000; 18:861-92
- MOISES VA, MACIEL BC, HOMBERGER LK, et al. A new method for non-invasive estimation of ventricular septal defect shunt flow by color Doppler flow mapping: imaging of the laminar flow convergence region on the left septal surface. J Am Coll Cardiol 1991; 18:824-32
- NEUMAYER U, STONE S, SOMERVILLE J. Small ventricular septal defects in adults. Eur Heart J 1998; 19:1573-82
- PERLOFF JK. Survival patterns without cardiac surgery or interventional catheterization: a narrowing base. In: PERLOFF JK, CHILD JS, Eds. Congenital heart disease in adults. 2nd edition. Philadelphia: WB Saunders, 1998, 15-53
- PERLOFF JK, WARNES CA: Challenges posed by adults with repaired congenital heart disease. Circulation 2001; 103:2637-43
- SILVERSIDES CK, DORE A, POIRIER N, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Shunt lesions. Can J Cardiol 2010; 26:e70-e79
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- TEE SDG, SHIOTA T, WEINTRAUB R, et al. Evaluation of ventricular septal defect by transesophageal echocardiography: Intraoperative assessment. Am Heart J 1994; 127:585-92
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
- WEIDMAN WH, DUSHANE JW, ELLISON RC. Clinical course of adults with ventricular septal defect. Circulation 1977; 56(Suppl I):78-9
