La prise en charge hémodynamique est déterminée par le degré de dysfonction droite. Le but est d’abaisser la postcharge du VD pour faciliter son éjection antérograde et diminuer la fraction régurgitée. En cas d’IT secondaire, la prise en charge est guidée par la thérapeutique des lésions gauches, le plus souvent une maladie mitrale. Les recommandations ci-dessous ne concernent que l’IT sévère isolée.
- Précharge: l'augmentation de précharge est le moyen physiologique du VD hypertrophié pour améliorer ses performances systoliques en utilisant le phénomène de Starling ; mais lorsque la défaillance a déjà entraîné une dilatation ventriculaire et une stase en amont avec insuffisance tricuspidienne, il faut au contraire diminuer cette précharge (dérivés nitrés, diurétiques, position de contre-Trendelenburg). Le remplissage doit être réglé en fonction de l’hémodynamique droite: PAP et débit cardiaque par le cathéter pulmonaire, fonction systolique du VD à l’ETO, variations de l’IT. La PVC est un critère peu fiable de la volémie et de l’insuffisance tricuspidienne, parce que l’OD est très compliante et accepte de grands volumes avec de faibles variations de pression.
- Résistances systémiques: vu le risque d'ischémie du VD et de bascule du septum interventriculaire vers la gauche en cas d'hypotension systémique, les RAS doivent être maintenues par une perfusion de nor-adrénaline pour assurer la perfusion coronarienne et l'équilibre septal. Le lit vasculaire pulmonaire étant très pauvre en récepteurs alpha, il n’y a pas de risque d’augmentation significative des résistances pulmonaires.
- Résistances pulmonaires: l’importance de l’IT est directement proportionnelle à celle des RAP. D’autre part, le VD supporte d’autant plus mal une augmentation de postcharge qu’il est déjà dilaté par la surcharge de volume. Les RAP doivent donc être abaissées par les techniques habituelles : hyperventilation normobarique, NO, prostacyclines, etc (voir Tableau 12.11). Eviter toute vasoconstriction pulmonaire (hypercapnie, acidose, hypoxie, N2O, desflurane, protamine, stress, douleur, hypothermie).
- Contractilité: soutien inotrope nécessaire par des amines béta (dobutamine) et des inhibiteurs des phosphodiestérases-3 (amrinone, milrinone) ou levosimendan. Si nécessaire, non-fermeture du péricarde et du sternum pour éviter la compression du VD dilaté et diminuer l’interférence interventriculaire avec le VG.
- Fréquence : la tachycardie est bénéfique : baisse du volume télédiastolique du VD ; maintenir le rythme sinusal.
- IPPV: l'IPPV et la PEEP peuvent provoquer une décompensation droite si les pressions générées sont excessives; l’hyperventilation nécessaire à diminuer les RAP doit se faire à la pression intrathoracique moyenne (Pitmoy) la plus basse possible.
| Hémodynamique recherchée dans l’insuffisance tricuspidienne sévère |
|
Précharge droite élevée si HVD
Précharge droite diminuée si insuffisance congestive du VD
Tachycardie modérée
Vasodilatation pulmonaire (baisse des RAP)
RAS élevée (perfusion coronarienne droite, équilibre du septum interventriculaire)
Stimulation inotrope β (dobutamine) ou inodilatateur (milrinone, levosimendan)
Ventilation spontanée ou IPPV à basse pression
Si associée, la valvulopathie gauche est dominante
RAP basses – Soutien inotrope du VD – Pit basse
|
Ventilation et dysfonction droite
Les effets de la ventilation en pression positive (IPPV) sont délétères sur la fonction ventriculaire droite: baisse de la précharge, gène à l'expansion diastolique, augmentation de la postcharge. Le rétablissement de la performance du VD nécessite en général une augmentation du volume circulant et une baisse des pressions de ventilation (Pitmoy basse). En cas d’insuffisance droite, la situation peut évidemment être très difficile. Cependant, il faut distinguer trois cas de figure différents s’accompagnant tous d’insuffisance tricuspidienne.
- Insuffisance ventriculaire droite sur dysfonction myocardique (infarctus droit, cardiomyopathie arythmogène du VD, défaillance droite aiguë post-CEC);
- Insuffisance ventriculaire droite sur excès aigu de postcharge (embolie pulmonaire, protamine);
- Hypertrophie ventriculaire droite sur HTAP chronique : maladie mitrale, insuffisance VG, BPCO sévère, syndrome d’Eisenmenger, etc.
Dans les deux premier cas, le but recherché est quadruple : 1) maintenir optimale la précharge du VD, 2) diminuer sa postcharge le plus bas possible, 3) soutenir sa fonction avec un agent inotrope (dobutamine, milrinone), et 4) assurer la perfusion coronarienne droite maximale (nor-adrénaline pour élever la pression aortique). Le remplissage est adapté à la situation : la PVC doit être suffisante, mais il faut l’abaisser si le VD est congestif (nitroglycérine, diurétique, position en anti-Trendelenburg). La tolérance à la ventilation en pression positive est très faible en cas de dysfonction du VD, car le ventricule défaillant peut décompenser sur l’augmentation de postcharge que représente l’IPPV. Dans le cas d’une défaillance sur excès de postcharge, la situation est complexe, car l’IPPV ajoute peu à la postcharge déjà très élevée, mais cette petite aggravation peut occasionnellement être suffisante pour déclencher la décompensation. Ces deux catégories de patients bénéficient davantage de la respiration spontanée ; lorsqu’elle est requise, la ventilation mécanique doit maintenir la Pitmoy la plus basse possible en réglant adéquatement le respirateur et en évitant la PEEP. La tolérance à l’IPPV peut être testée en préopératoire en faisant faire au malade une manœuvre de Valsalva et en observant son retentissement sur la pression artérielle (cathéter en place).
Dans le troisième cas, une pathologie vasculaire pulmonaire chronique a entraîné une hypertrophie du VD, et la situation est très différente. Le VD hypertrophié fonctionne comme le VG : son débit est dépendant de la précharge (courbe de Starling redressée) ; il a besoin d’une PVC élevée. En ce qui concerne la ventilation, quatre phénomènes entrent en ligne de compte [4,6].
- Dans le BPCO, les pressions de ventilation sont mal transmises par le parenchyme pulmonaire peu compliant; la Pit engendrée est inférieure à la pression ventilatoire, et la postcharge droite est moins augmentée que ne le laissent supposer les pressions respiratoires.
- En cas d'hypertension pulmonaire chronique (PAPmoy > 30 mmHg), l’augmentation de Pit par l’IPPV représente une faible proportion de la pression de perfusion pulmonaire habituelle ; une Pitmoy de 12 mmHg, par exemple, ne représente qu’un accroissement d'un quart de l’impédance à l'éjection du VD lorsque celui-ci travaille face à une HTAP chronique de 70/35 mmHg, alors que cela double la postcharge pour un VD normal. L’IPPV est mieux supportée en cas d’HTAP qu’en cas de PAP normale.
- Lors d’HTAP chronique, les parois artérielles sont épaissies, muscularisées et fibrosées ; elles résistent à la compression par la pression ventilatoire, ce qui n’est pas le cas d’artères pulmonaires normales.
- Même en cas d’HTAP, la réactivité des artérioles à l’acidose et à l’hypocapnie persiste ; la PAP peut encore s’élever en cas d’hypoventilation. L’IPPV peut donc baisser les résistances pulmonaires par hyperventilation (hyperoxie, hypocarbie et alcalose).
Les patients souffrant d’HTAP chronique bénéficient donc clairement de la ventilation mécanique en pression positive.
Technique d'anesthésie
Le type d’anesthésie dépend essentiellement de la fonction du VD et, le cas échéant, des pathologies gauches. Il s’agit ici de recommandations pour l’anesthésie en cas d’IT sévère isolée ; lorsque l’IT est associée à une valvulopathie mitrale, c’est cette dernière qui commande la technique d’anesthésie.
- Induction : choisir des substances sans effets significatifs sur la fonction du VD ni sur les RAP.
- Etomidate : ne modifie ni la précharge, ni la postcharge, ni la contractilité du VD.
- Midazolam : adéquat, la baisse du tonus sympathique central diminue les RAP.
- Propofol : il baisse la précharge davantage que la postcharge ; possible à dosage adapté et lent chez les malades stables, en compensant par du volume ; à éviter en cas de défaillance du VD.
- Fentanils : administration lente à cause de la bradycardie.
- Thiopental, kétamine : l’augmentation des RAS (kétamine) et des RAP (thiopental, kétamine) sont prohibitives ; l’effet inotrope négatif du thiopental est excessif.
- Maintien de l’anesthésie : rechercher la baisse des RAP et le maintien des RAS ; éviter la bradycardie.
- Sevoflurane : peu d’effet sur les RAS et les RAP.
- Perfusion de propofol ou de midazolam : adapter les dosages pour que l’hémodynamique reste stable.
- Desflurane : déconseillé (↑ RAP).
- Ventilation à Pit basse, pas de PEEP ; trouver le meilleur compromis entre l’hyperventilation nécessaire à abaisser les RAP et la Pit moyenne la plus basse possible ; en cas d’HVD et d’HTAP chronique, l’augmentation de la Pit est sans effet significatif sur la postcharge du VD.
- Hypotension systémique : vasopresseur α.
- Soutenir la performance contractile du VD.
- Vasodilatation pulmonaire (hyperventilation normobarique, NO•, prostacyclines, magnésium, anesthésie profonde, fentanils).
- Optimalisation de la précharge.
- Soutien inotrope (dobutamine, milrinone ± adrénaline).
- Maintien de la perfusion coronarienne et de l'équilibre septal (nor-adrénaline).
- Monitorage : même s’il est utile à la mesure de la PAP, le cathéter pulmonaire de Swan-Ganz donne des valeurs incorrectes du DC, qui est faussé par le flux rétrograde de l’IT ; il est très difficile à flotter à travers la tricuspide à cause de la régurgitation et gène l'opérateur lors de la plastie (il faut alors retirer le cathéter en VCS) ; son utilisation est impossible en cas de remplacement valvulaire. Alternatives :
- Mesure du VS et DC par un système PiCCO ou analogue.
- Cathéter placé chirurgicalement dans la chambre de chasse du VD si la mesure de la PAP est nécessaire.
- Monitorage ETO :
- Taille et fonction du VD, degré de dilatation, mesure de la PAP par la Vmax de l’IT.
- Surveillance de la fonction du VG, position du septum interventriculaire.
- Evaluation de la volémie.
- Evaluation et mécanisme de l’IT.
- Post-CEC : résultat de la plastie.
CEC et post-CEC
La correction de l’insuffisance tricuspidienne correspond à la perte d’une soupape de pression pour le VD. Celui-ci doit éjecter contre les RAP, ce qui représente une augmentation de sa postcharge. La dysfonction droite est habituelle en sortant de CEC, et sa persistance est de mauvais pronostic. De ce point de vue, une fuite résiduelle à travers une plastie est un avantage hémodynamique, alors que l’étanchéité d’une prothèse représente une augmentation de travail. D’autre part, la prothèse présente un gradient qui limite la précharge télédiastolique, et une rigidité qui contrecarre la contraction péristaltique du VD. Lors de pose d'une prothèse tricuspidienne, les valeurs considérées comme indicatives d'une sténose sont les suivantes: Vmax du flux E > 1.7 m/s, gradient moyen > 6 mmHg, temps de demi-pression > 230 ms [7]. Traitement de la défaillance droite (voir Tableau 12.6) :
- Vasodilatation pulmonaire (hyperventilation normobarique, NO•, prostacyclines, magnésium);
- Optimalisation de la précharge;
- Soutien inotrope (dobutamine, milrinone ± adrénaline, levosimendan);
- Maintien de la perfusion coronarienne et de la position du septum interventriculaire (nor-adrénaline);
- Non-fermeture du péricarde et du sternum; ils seront refermés à 48-72 heures.
Syndrome carcinoïde
Les tumeurs neuro-endocrines (TNE) sont rares (2-5 cas par 100'000 habitants); elles se développent surtout dans le tube digestif, et se manifestent par des décharges de sérotonine (5-hydroxytryptamine) et d’agents vasodilataeurs comme le VIP (vasoactive intestinal peptide). Elles sont caractérisées par des épisodes de vasoplégie, de flush cutané, de diarrhée et de bronchospasme. Dans le cœur, atteint dans 30-50% des cas, la maladie développe des épaississements fibreux sous-endocardiques sur les feuillets des valves droites, et parfois sur les valves gauches en cas de foramen ovale perméable ou de shunt droit-gauche. La valve la plus fréquemment touchée est la tricuspide. Lorsque les signes cardiaques apparaissent sur la valve tricuspide et/ou pulmonaire, la tumeur a déjà métastasié dans le foie, et la survie ne dépasse pas 31% à 3 ans [3]. Le diagnostic est posé sur la clinique et sur le dosage de l'acide 5-hydroxy-indol-acétique (> 300 mmol/24 h dans les urines) et sur celui de NT-proBNP. A l'échocardiographie, les valves tricuspide et pulmonaire apparaissent épaissies, rigides, rétractées et peu mobiles; elles sont insuffisantes et partiellement sténoses (Figure 11.160).
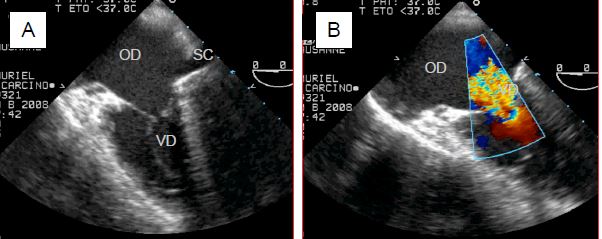
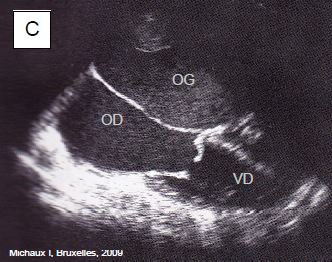
Figure 11.160 : Images ETO de lésion tricuspidienne (IT) lors de syndrome carcinoïde. A : vue 4-cavités (position en bas oesophage) d’une IT massive; les feuillets sont épaissis, restrictifs, et ne coaptent pas en systole. SC : sinus coronaire. B : Vue identique avec le flux Doppler couleur ; la vena contracta est large (> 1 cm) ; il existe un PISA important. C: Sténose tricuspidienne lors de syndrome carcinoïde ; l’ouverture diastolique, restrictive, présente un aspect en dôme ; les feuillets sont épaissis et raccornis ; le VD est petit alors que l’OD est dilatée.
Le traitement spécifique est basé sur les analogues de la somatostatine (octréotide et lanréotide), qui améliorent la symptomatologie dans les deux tiers des cas. L'embolisation ou la résection chirurgicale (debulking) des métastases hépatiques améliorent beaucoup la situation, mais au prix d'un risque opératoire élevé, d'hémorragie importante et d'insuffisance hépatique postopératoire. La cardiochirurgie permet un remplacement valvulaire de la tricuspide et/ou de la pulmonaire, mais la mortalité opératoire est élevée (18%) et la survie de seulement 69% à 1 an et de 24% à 10 ans [1,2,5]. Si nécessaire, on peut compléter par un remplacement mitral ou aortique avec fermeture du FOP. On choisit de préférences des bioprothèses pour éviter l'anticoagulation, vu les problèmes hépatiques et les possibles interventions chirurgicales ultérieures.
L’intervention est dominée par deux risques majeurs : 1) la crise sérotoninergique, et 2) l’insuffisance droite. Comme toutes deux se caractérisent par une hypotension sévère, l’ETO et le cathéter pulmonaire sont nécessaires pour faire le diagnostic différentiel. De violentes décharges de sérotonine avec effondrement tensionnel, tachycardie, arythmies et bronchospasme peuvent être déclenchées par le stress chirurgical, les substances histamino-libératrices, les catécholamines et les morphiniques. L’hyperglycémie est en général prononcée. Le traitement sélectif de la crise carcinoïde périopératoire consiste à administrer un analogue de la somatostatine comme l’octréotide ou le lanréotide, associé à un vasoconstricteur alpha non-catécholaminergique (phényléphrine en perfusion) ou un anti-NO (bleu de méthylène). L’octréotide (Sandostatine®) est administré en perfusion (50-100 mcg/h, maximum 300 mcg/h) dès 12 heures avant l'intervention et en continu au cours de celle-ci; des bolus de 100 à 200 mcg peuvent être administrés au besoin [1,3]. Les médicaments les plus sûrs pour l’anesthésie sont l’étomidate, le midazolam, les fentanils, le sevoflurane, le vecuronium et le rocuronium. Lorsqu'un soutien inotrope est requis à cause d'une défaillance du VD, on choisit de préférence la milrinone.
| Anesthésie et insuffisance tricuspidienne |
|
En cas d'IT primaire, l'anesthésie est conduite en fonction de la performance du VD. En cas d'IT secondaire, elle est gérée en fonction de la pathologie du cœur gauche.
La ventilation mécanique en présence d'une dysfonction du VD relève de 3 différentes situations:
- Insuffisance primaire du VD: l'IPPV est mal supportée parce que la postcharge du VD doit rester basse
- Elévation aiguë de la postcharge droite (embolie pulmonaire): tolérance variable à l'IPPV
- HTAP chronique avec HVD: l'IPPV est bien supportée et bénéfique
Syndrome carcinoïde: atteinte de la tricuspide et de la valve pulmonaire dans 50% des cas. Caractéristiques:
- Décharges massives de sérotonine (vasoplégie, arythmies, bronchospasme)
- Intervention sous perfusion continue de Sandostatine® (50-300 mcg/h) + bolus 100-200 mcg
- Médicaments sûrs: etomidate, midazolam, fentanils, sevoflurane, vecuronium, rocuronium
- Eviter les catécholamines
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- CASTILLO JG, FILSOUFI F, ADAMS DH, et al. Management of patients undergoing multivalvular surgery for carcinoid heart disease: the role of the anaesthetist. Br J Anaesth 2008; 101:618-26
- CONNOLLY HM, SCHAFF HV, MULLANY CJ, et al. Carcinoid heart disease: Impact of valve replacement on right ventricular function and remodeling. Circulation 2002; 106:I-51-8
- DAVAR J, CONNOLLY HM, CAPLIN ME, et al. Diagnosing and managing carcinoid heart disease in patients with neuroendocrine tumors. J Am Coll Cardiol 2017; 69:1288-304
- FISCHER LG, VAN AH, BURKLE H. Management of pulmonary hypertension: physiological and pharmacological considerations for anesthesiologists. Anesth Analg 2003; 96:1603-16
- MOKHLES P, VAN HERWERDEN LA, DE JONG PL, et al. Carcinoid heart disease: outcomes after surgical valve replacement. Eur J Cardio-Thorac Surg 2012; 41:1278-83
- STRUMPHER J, JACONSOHN E. Pulmonary hypertension and right ventricular dysfunction: physiology and perioperative management. J Cardiothorac Vasc Anesth 2011; 25: 687-704
- ZOGHBI WA, CHAMBERS JB, DUMESNIL JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultrasound. J Am Soc Echocradiogr 2009; 22:975-1014
