Une hypertension pulmonaire aiguë (embolie pulmonaire) provoque une dilatation du VD, alors qu’une hypertension pulmonaire chronique induit une hypertrophie du VD (épaisseur de paroi > 5 mm, accentuation des trabéculations) accompagnée d’une dilatation plus ou moins importante. Les complications associées à l’hypertension pulmonaire sont davantage liées au degré de défaillance du VD qu’à la valeur de la pression pulmonaire elle-même [9].
Calcul de la PAP
En présence d'une insuffisance tricuspidienne, il est possible de calculer la pression pulmonaire systolique en utilisant l'équation de Bernoulli qui permet de calculer le gradient de pression entre deux cavités (ΔP) par la mesure de la vélocité maximale du flux (Vmax) entre ces cavités (voir Figure 25.161) : ΔP = 4 • (V2max)2 – (V1max)2, où V1 est la vélocité du sang en amont de l’orifice et V2 la vélocité en aval. Comme V1 est négligeable dans le cas de la tricuspide, on simplifie l’équation :
ΔP = 4 • (Vmax)2
La valeur mesurée est la différence de pression qui règne entre le VD et l'OD en systole; en additionnant à cette valeur celle de la pression veineuse centrale (POD), on obtient la pression systolique du ventricule droit, qui est la même que la pression systolique pulmonaire s’il n’y pas de lésion sur la chambre de chasse ou la valve pulmonaire, ni de communication interventriculaire :
PAPsyst = 4 • (VmaxIT)2 + POD
La Vmax est mesurée sur le tracé spectral qui présente la valeur la plus élevée et l’enveloppe la mieux définie. Comme la Vmax de l’IT diminue en inspirium spontané, on l’enregistre de préférence en pause télé-expiratoire ; chez un malade ventilé en pression positive, on l’évalue durant une apnée. On recherche le meilleur alignement avec le flux de l’IT en position mi-oesophage entre 0° (vue 4-cavités) 60° (vue admission-chasse du VD) et 90° (vue bicave modifiée), souvent en avançant la sonde un peu plus profondément. Dans environ 40% des cas, l'angle entre le jet d'IT et l'axe des ultrasons est > 20° [19]. La POD est mesurée par le cathéter central. En l’absence de PVC, on estime la POD par des repères utilisés pour jauger la volémie: collapsibilité de la VCI et de la VCS, ou oscillations du septum interauriculaire. Toutefois, les valeurs-seuils sont différentes selon le mode ventilatoire. En ventilation mécanique contrôlée (IPPV à volume courant de 10 mL/kg), une variation de diamètre > 20% de la VCI à l'ETO est un signe d'hypovolémie qui traduit une POD < 8 mmHg [5]. En respiration spontanée et échocardiographie transthoracique, par contre, un diamètre < 1.5 cm et un collapsus respiratoire de > 50% de la VCI sont nécessaires pour estimer la POD à < 8 mmHg. Un diamètre > 2 cm et une absence de variabilité correspondent à une POD > 12 mmHg [11]. Cette approximation est certainement le facteur qui introduit le plus d'incertitude sur la mesure de la PAP par échocardiographie.
En présence d’une insuffisance pulmonaire, on peut calculer la pression pulmonaire diastolique par le biais de la vélocité (V) de cette insuffisance (IP) en télédiastole (td) : PAPdiast = 4 (VtdIP)2 + POD. La PAP moyenne est équivalente à la même mesure, mais avec la Vmax de l’IP (voir Figure 25.220):
PAPm = 4 (VmaxIP)2 + POD
Etant le rapport entre le gradient de pression et le débit transpulmonaires, la résistance artérielle pulmonaire (RAP) peut se calculer de manière non-invasive par le rapport entre la Vmax de l’IT (VmaxIT) et l’intégrale des vélocités mesurée dans la chambre de chasse du VD par voie transgastrique (ITVCCVD). En cas d’HTAP, ce rapport est > 0.2 [1]. L’équation peut s’écrire :
RAP (unités Wood) = 10 • VmaxIT / ITVCCVD
Si l'hypertension pulmonaire est liée à un haut débit comme dans un shunt G-D, le rapport VmaxIT/ITVCCVD est < 2.
Dans le diagnostic cardiologique de l'hypertension pulmonaire, la corrélation moyenne entre la PAPsyst évaluée à l'écho transthoracique et celle mesurée pas un cathéter pulmonaire est modeste (r = 0.68-0.71); la sensibilité et la spécificité de la technique échocardiographique sont respectivement de 83% et de 72% [10,16]. La corrélation tend à s'abaisser lorsque l'hypertension pulmonaire est sévère [10]. Le désaccord entre la mesure écho et celle du cathétérisme survient dans 25% des cas; chez la moitié des malades, la différence est de l'ordre de 20 mmHg [6]. La situation de l'ETO peropératoire chez des patients endormis et ventilés ne semble guère plus favorable, même si la corrélation est bonne dans quelques études: la valeur calculée de la PAPsyst est dans une limite de < 15% par rapport à la mesure par cathétérisme dans 55-75% des patients seulement [4,19]. Ce contexte bénéficie pourtant de trois avantages: la présence d'une PVC pour une mesure exacte de la POD, la simultanéité des mesures de POD et de Vmax IT, et la faible incidence d'hypertension pulmonaire majeure (la plupart des patients a une PAPsyst < 50 mmHg). L'évaluation de la PAPsyst par ETO est donc très utile pour trier les malades en trois catégories: PAP normale, hypertension pulmonaire modérée et hypertension pulmonaire sévère. La technique n'offre aucune garantie pour davantage de précision.
Modifications fonctionnelles
L’hypertension artérielle pulmonaire (HTAP) est caractérisée par plusieurs aspects typiques de l’image 2D et des flux Doppler [8,20].
Calcul de la PAP
En présence d'une insuffisance tricuspidienne, il est possible de calculer la pression pulmonaire systolique en utilisant l'équation de Bernoulli qui permet de calculer le gradient de pression entre deux cavités (ΔP) par la mesure de la vélocité maximale du flux (Vmax) entre ces cavités (voir Figure 25.161) : ΔP = 4 • (V2max)2 – (V1max)2, où V1 est la vélocité du sang en amont de l’orifice et V2 la vélocité en aval. Comme V1 est négligeable dans le cas de la tricuspide, on simplifie l’équation :
ΔP = 4 • (Vmax)2
La valeur mesurée est la différence de pression qui règne entre le VD et l'OD en systole; en additionnant à cette valeur celle de la pression veineuse centrale (POD), on obtient la pression systolique du ventricule droit, qui est la même que la pression systolique pulmonaire s’il n’y pas de lésion sur la chambre de chasse ou la valve pulmonaire, ni de communication interventriculaire :
PAPsyst = 4 • (VmaxIT)2 + POD
La Vmax est mesurée sur le tracé spectral qui présente la valeur la plus élevée et l’enveloppe la mieux définie. Comme la Vmax de l’IT diminue en inspirium spontané, on l’enregistre de préférence en pause télé-expiratoire ; chez un malade ventilé en pression positive, on l’évalue durant une apnée. On recherche le meilleur alignement avec le flux de l’IT en position mi-oesophage entre 0° (vue 4-cavités) 60° (vue admission-chasse du VD) et 90° (vue bicave modifiée), souvent en avançant la sonde un peu plus profondément. Dans environ 40% des cas, l'angle entre le jet d'IT et l'axe des ultrasons est > 20° [19]. La POD est mesurée par le cathéter central. En l’absence de PVC, on estime la POD par des repères utilisés pour jauger la volémie: collapsibilité de la VCI et de la VCS, ou oscillations du septum interauriculaire. Toutefois, les valeurs-seuils sont différentes selon le mode ventilatoire. En ventilation mécanique contrôlée (IPPV à volume courant de 10 mL/kg), une variation de diamètre > 20% de la VCI à l'ETO est un signe d'hypovolémie qui traduit une POD < 8 mmHg [5]. En respiration spontanée et échocardiographie transthoracique, par contre, un diamètre < 1.5 cm et un collapsus respiratoire de > 50% de la VCI sont nécessaires pour estimer la POD à < 8 mmHg. Un diamètre > 2 cm et une absence de variabilité correspondent à une POD > 12 mmHg [11]. Cette approximation est certainement le facteur qui introduit le plus d'incertitude sur la mesure de la PAP par échocardiographie.
En présence d’une insuffisance pulmonaire, on peut calculer la pression pulmonaire diastolique par le biais de la vélocité (V) de cette insuffisance (IP) en télédiastole (td) : PAPdiast = 4 (VtdIP)2 + POD. La PAP moyenne est équivalente à la même mesure, mais avec la Vmax de l’IP (voir Figure 25.220):
PAPm = 4 (VmaxIP)2 + POD
Etant le rapport entre le gradient de pression et le débit transpulmonaires, la résistance artérielle pulmonaire (RAP) peut se calculer de manière non-invasive par le rapport entre la Vmax de l’IT (VmaxIT) et l’intégrale des vélocités mesurée dans la chambre de chasse du VD par voie transgastrique (ITVCCVD). En cas d’HTAP, ce rapport est > 0.2 [1]. L’équation peut s’écrire :
RAP (unités Wood) = 10 • VmaxIT / ITVCCVD
Si l'hypertension pulmonaire est liée à un haut débit comme dans un shunt G-D, le rapport VmaxIT/ITVCCVD est < 2.
Dans le diagnostic cardiologique de l'hypertension pulmonaire, la corrélation moyenne entre la PAPsyst évaluée à l'écho transthoracique et celle mesurée pas un cathéter pulmonaire est modeste (r = 0.68-0.71); la sensibilité et la spécificité de la technique échocardiographique sont respectivement de 83% et de 72% [10,16]. La corrélation tend à s'abaisser lorsque l'hypertension pulmonaire est sévère [10]. Le désaccord entre la mesure écho et celle du cathétérisme survient dans 25% des cas; chez la moitié des malades, la différence est de l'ordre de 20 mmHg [6]. La situation de l'ETO peropératoire chez des patients endormis et ventilés ne semble guère plus favorable, même si la corrélation est bonne dans quelques études: la valeur calculée de la PAPsyst est dans une limite de < 15% par rapport à la mesure par cathétérisme dans 55-75% des patients seulement [4,19]. Ce contexte bénéficie pourtant de trois avantages: la présence d'une PVC pour une mesure exacte de la POD, la simultanéité des mesures de POD et de Vmax IT, et la faible incidence d'hypertension pulmonaire majeure (la plupart des patients a une PAPsyst < 50 mmHg). L'évaluation de la PAPsyst par ETO est donc très utile pour trier les malades en trois catégories: PAP normale, hypertension pulmonaire modérée et hypertension pulmonaire sévère. La technique n'offre aucune garantie pour davantage de précision.
Modifications fonctionnelles
L’hypertension artérielle pulmonaire (HTAP) est caractérisée par plusieurs aspects typiques de l’image 2D et des flux Doppler [8,20].
- Dilatation de l’OD (> 17 cm2/m) et bombement du septum interauriculaire dans l’OG; c'est souvent le premier signe lors du déclenchement d’une décompensation droite aiguë (Vidéo). Dilatation de la VCI (> 2.1 cm) et diminution de sa collapsibilité respiratoire.
Vidéo: la décompensation droite aiguë entraîne une stase auriculaire en amont; celle-ci se caractérise par une dilatation de l'OD et par un bascule permanent du septum interauriculaire dans l'OG.
- Dilatation et/ou hypertrophie du VD ; diamètre du VD ≥ 4.0 cm, surface ≥ 22 cm2. L’épaisseur de la paroi libre est > 6 mm (mode TM, vue admission-chasse 60° ou admission TG 120°). L’apex du VD dépasse celui du VG et constitue la zone apicale du cœur. Le rapport entre la surface du VD et celle du VG en 4-cavités est > 1.5 (Vidéo) (voir Figure 25.212).
Vidéo: vue 4-cavités au cours d'une embolie pulmonaire massive; le VD et l'OD sont dilatés, les septa interventriculaire et interauriculaire sont bombés dans les cavités gauches, qui sont comprimées et très réduites en volume.
- Aplatissement du septum interventriculaire; le VG en court axe a une forme en "D" au lieu d'être circulaire (indice d'excentricité > 1.1). Le septum bombe dans la gauche en diastole en cas de surcharge de volume et en systole en cas de surcharge de pression. En cas d’insuffisance aiguë du VD, le bombement du septum interventriculaire dans le VG est permanent (Vidéo) (voir Figure 25.215).
Vidéo: vue transgastrique court-axe du VG et du VD dans un cas de surcharge et de défaillance droite; le VD est hypertrophié et très dilaté. Le septum interventriculaire bombe en permanence dans la cavité gauche qui est devenue minuscule. - Dyskinésie septale (mouvement paradoxal); en cas de surcharge de volume, le septum basculé dans le VG en diastole reprend sa position convexe dans le VD en début de systole. En cas de surcharge de pression, la durée d’éjection du VD étant allongée à cause de la hausse de postcharge, la systole droite se prolonge pendant le début de la relaxation du VG et fait basculer le septum interventriculaire dans le VG en protodiastole (Vidéo) [18].
Vidéo: dyskinésie septale en cas de surcharge de pression. La durée d’éjection du VD étant allongée à cause de la hausse de postcharge, la systole droite se prolonge pendant le début de la relaxation du VG et fait basculer le septum interventriculaire dans le VG en protodiastole; en protosystole, le septum est rectiligne.
- Diminution de la parte due à la contraction longitudinale dans l'éjection du volume systolique (60% au lieu de 75% normalement); la propotion ré-augmente sous traitement vasodilatateur pulmonaire [3].
- Dilatation de l'AP (> 25 mm).
- Epanchement péricardique; l'accumulation liquidienne et sa mauvaise résorption sont liées à la surpression dans l'OD [15].
- Vmax de l’insuffisance tricuspidienne > 2.8 m/s pour autant que la fonction ventriculaire droite soit suffisante (Vidéo).
Vidéo: insuffisance tricuspidienne modérée en vue admission-chasse du VD 60°.
- Pronostic de l'HTP; la dysfonction droite (FAC < 0.3, TAPSE < 1.0 cm ou < 7 cm/s, indice de Tei > 0.4) péjore le pronostic clinique de l'hypertension pulmonaire [7].
- Flux tricuspidien; diminution de E (E/A < 1), prolongation de la durée de décélération du flux E.
- Redressement de la pente d’accélération du flux de l’AP; la durée d’accélération est < 100 ms en cas d’HTAP modérée et ≤ 70 ms en cas d’HTAP sévère (normal : > 120 ms, ou > 35% du temps éjectionnel) (Figure 25.222A). Le rapport entre la durée d’accélération et celle du flux pulmonaire est < 0.25 lorsque la PAPm est > 40 mmHg [12,17].
- Dicrotisme mésosystolique (notching) du flux systolique à travers la CCVD et la valve pulmonaire (aspect en "M") dû à une chute brusque du flux en cours de systole à cause de l'onde réfléchie par les RAP élevées; cette onde revient d'autant plus tôt que l'impédance artérielle est plus élevée. Cette silhouette particulière est typique de l'hypertension artérielle pulmonaire précapillaire, mais est absente dans l'hypertension pulmonaire postcapillaire (Figure 25.222) [2].
- Signes d'une élévation de la POD: congestion et perte de la pulsatilité respiratoire de la veine cave inférieure (diamètre VCI > 2 cm), rapport de la composante systolique à la composante diastolique du flux de la VCI < 0.5 [14].
- Réouverture d'un FOP; l'excès de pression dans l'OD par rapport à l'OG crée un gradient en faveur d'un passage D-G. Si le foramen ovale n'est pas occlus, ce qui est le cas chez 25% de la population, le sang veineux de l'OD passe dans l'OG et induit une désaturation artérielle et une cyanose. Le shunt D-G est visible au Doppler couleur (voir Figure 25.252).
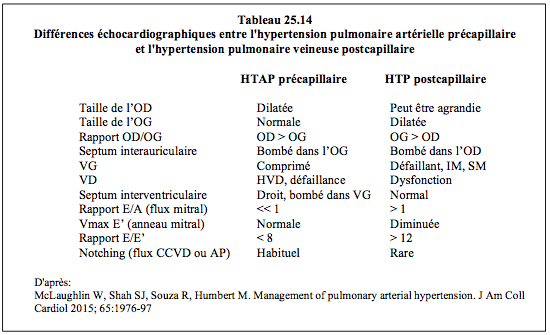
- Différenciation précapillaire-postcapillaire: plusieurs critères échocardiographiques permettent de différencier l'hypertension pulmonaire artérielle précapillaire (HTAP primaire, vasoconstriction hypoxique, pneumopathie) de l'hypertension pulmonaire veineuse postcapillaire (insuffisance ventriculaire gauche, maladie mitrale); ils sont explicités dans le Tableau 25.14 [13].
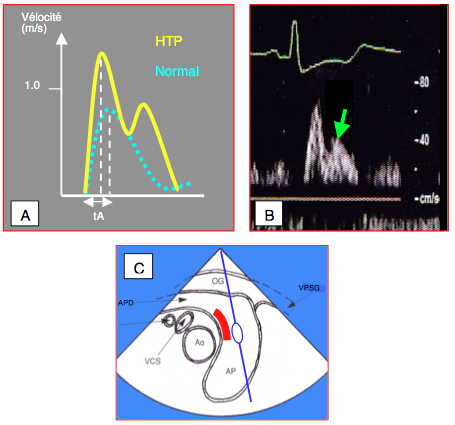
Figure 25.222 : Modifications du flux d'éjection droite en cas d'hypertension pulmonaire (HTP). A: profil du flux en AP (courbe jaune) par rapport à la situation normale (traitillé bleu). La Vmax et l'accélération protosystolique sont plus élevées, le délai jusqu'au pic de vélocité (tA) représente < 25% de la durée d'éjection. B: la forte impédance de l'AP provoque une onde réfléchie inhabituelle qui occasionne une chute du flux en mésosystole (flèche verte); la courbe prend une silhouette en "M". C: positionnement du Doppler pulsé au milieu du courant de l'AP en vue court-axe de l'aorte ascendante à 0°; la zone rouge est une aire où le flux est accéléré et donne une Vmax exagérée.
D'une manière générale, les différents indices de fonction systolique du VD sont abaissés en fonction du degré de décompensation ventriculaire. Ils ne sont pas directement corrélés à la valeur de la PAP. Lorsque les images des cavités droites sont de mauvaise qualité, on peut s’aider d’une injection de microbulles ; cette épreuve de contraste améliore la définition de l’endocarde et augmente la lisibilité du flux couleur.
L'échocardiographie permet de définir de manière simple la probabilité que présente un malade de souffrir d'une hypertension pulmonaire [8].
- Probablitié faible: absence d'IT ou Vmax de l'IT < 2.8 m/s, pas d'autres signes d'HTP;
- Probabilité intermédiaire: Vmax de l'IT 2.9-3.4 m/s, ou ≤ 2.8 m/s mais présence d'autres signes d'HTP;
- Probabilité élevée: Vmax de l'IT 2.9-3.4 m/s mais présence d'autres signes d'HTP, ou Vmax IT > 3.4 m/s.
| Indices d’hypertension pulmonaire |
| La PAPsyst est évaluée par la Vmax IT : PAPsyst = 4 • (VmaxIT)2 + POD Le retentissement sur le VD de l'augmentation de postcharge se traduit par plusieurs modifications - Insuffisance tricuspidienne (> 2.5 m/s) (peut avoir une Vmax abaissée si dysfonction VD) - Dilatation OD et VD - HVD si hypertension pulmonaire chronique - Bombement du septum interauriculaire dans l’OG - Aplatissement / bombement du septum inerventriculaire dans le VG - Mouvement systolique paradoxal (dyskinésie septale) - Bombement diastolique si surchage de volume - Bombement systolique si surcharge de pression - Flux AP : durée d’accélération < 100 msec (≤ 25% durée d’éjection) Les signes de dysfonction droite (FAC < 0.25, TAPSE < 1.0 cm ou < 6 cm/s, indice de Tei > 0.4, déformation longitudinale < 15%) sont de mauvais pronostic. |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- ABBAS AE, FORTUIN D, SCHILLER NB, et al. A simple method for noninvasive estimation of pulmonary vascular resistance. J Am Coll Cardiol 2003; 41:1021-7
- ARKLES JS, OPOTOWSKY AR, OJEDA J, et al. Shape of the right ventricular Doppler envelope predicts hemodynamics and right heart function in pulmonary hypertension. Am J Respir Crit Care Med 2011; 183:268-76
- BROWN SB, RAINA A, KATZ D, et al. Longitudinal shortening accounts for the majority of right ventricular contraction and improves after vasodilator therapy in normal subjects and in patients with pulmonary arterial hypertension. Chest 2011; 140:27-33
- COWIE B, KLUGER R, REX S, MISSANT C. The utility of transoesophageal echocardiography for estimating right ventricular systolic pressure. Anaesthesia 2015; 70:258-63
- FEISSEL M, MICHARD F, FALLER JP, TEBOUL JL. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med 2004; 30:1834-7
- FISHER MR, FORFIA PR, CHAMERA E, et al. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Respir Crit Care Med 2009; 179:615-21
- FORFIA PR, FISCHER MR, MATHAI SC, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension. Am J Respir Crit Care Med 2006; 174:1034-41
- GALIÈ N, HUMBERT M, VACHIERY JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J 2016; 37:67-119
- HADDAD F, COUTURE P, TOUSIGNANT C, DENAULT AY. The right ventricle in cardiac surgery, a perioperative perspective: II. Pathophysiology, clinical importance and management. Anesth Analg 2009; 108:422-33
- JANDA S, SHAHIDI N, GIN K, SWISTON J. Diagnostic accuracy of echocardiography for pulmonary hypertension: a systematic review and meta-analysis. Heart 2011; 97:612-22
- KIRCHER BJ, HIMELMAN RB, SCHILLER NB.. Noninvasive estimation of right atrial pressure from the inspiratory collapse of the inferior vena cava. Am J Cardiol 1990; 66:493-8
- KITABATAKE A, MICHITOSHI I, ASAO M, et al. Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique. Circulation 1983; 68:302-9
- McLAUGHLIN W, SHAH SJ, SOUZA R, HUMBERT M. Management of pulmonary arterial hypertension. J Am Coll Cardiol 2015; 65:1976-97
- NOORDEGRAAF AV, HADDAD F, BOGAARD HJ, HASSOUN PM. Noninvasive imaging in the assessment of the cardiopulmonary vascular unit. Circulation 2015; 131:899-913
- RAYMOND RJ, HINDERLITER AL, WILLIS PW, et al. Echocariographic predictors of adverse outcomes in primary pulmonary hypertension. J Am Coll Cardiol 2002; 39:1214-9
- RICH JD, SHAH SJ, SWAMY RS, et al. Inaccuracy of Doppler echocardiographic estimates of pulmonary artery pressures in patients with pulmonary hypertension. Chest 2011; 139:988-93
- RISTOW B, SCHILLER NB. Stepping away from ritual heart catheterization into the era of noninvasively measured pulmonary artery pressure. J Am Soc Echocardiogr 2009; 22:820-2
- SANZ J, SANCHEZ-QUINTANA D, BOSSONE E, et al. Anatomy, function, and dysfunction of the right ventricle. J Am Coll Cardiol 2019; 73:1463-82
- SOLIMAN D, BOLLIGER D, SKARVAN K, et al. Intra-operative assessment of pulmonary artery pressure by transoesophageal echocardiography. Anaesthesia 2015; 70:264-71
- THUNBERG CA, GAITAN BD, GREWAL A, et al. Pulmonary hypertension in patients undergoing cardiac surgery: pathophysiology, perioperative management, and outcomes. J Cardiothorac Vasc Anesth 2013; 27:551-72
