Durant la phase de sevrage de la CEC, on n'administre plus d'agents anesthésiques volatils pour éviter leur effet dépresseur myocardique marqué chez le petit enfant. Les produits sanguins et dérivés doivent être prêts et réchauffés. La salle d'opération est réchauffée. Avant de stopper la CEC, il faut s'assurer que le rythme et la fréquence cardiaque soient rétablis (la bradycardie est un signe d'alarme), que la contractilité soit adéquate, que la température soit normale (36°C oesophagien et 35°C rectal minimum) et que la ventilation soit parfaite (inflation pulmonaire contrôlée dans le champ opératoire, aspiration endotrachéale). Le ventilateur est réglé de manière à induire une hypocapnie (PaCO2 30-35 mm Hg) ou une normocapnie selon les circonstances; la FiO2 est de 0.8-1.0. Il faut vérifier l'équilibre acido-basique et assurer un pH ≥ 7.4 pour éviter une vasoconstriction pulmonaire et permettre le plein effet des catécholamines. Les petits enfants accumulent beaucoup d'eau intersticielle dans le parenchyme pulmonaire; l’utilisation d’une hémofiltration modifiée devrait être envisagée pour toute CEC d’une durée modérée ou prolongée.
L'utilisation des vasopresseurs et des agents inotropes pour la mise en charge est dictée par l'observation du coeur dans le champ opératoire et à l’ETO, par l’analyse des pressions artérielles et veineuses centrales, et par les modifications hémodynamiques imposées par la chirurgie pratiquée. Vu la paucité de leurs récepteurs β-adrénergiques, les nourrissons ont besoin de substances spécifiques agissant sur les récepteurs α-adrénergiques (adrénaline) ou par voie non catécholaminergique (milrinone). La dysfonction droite est souvent l’élément dominant.
- La contractilité du coeur immature est très dépendante du taux de Ca2+ extracellulaire; administration de CaCl2 0.2 ml/kg, à répéter si nécessaire (hypocalcémie, transfusions).
- La milrinone (0.25-0.75 mcg/kg/min) est très utile chez les petits enfants car elle agit par une voie non-adrénergique et baisse les RAP.
- L'adrénaline (0.01-0.5 mcg/kg/min) agit sur les récepteurs β1, β2 et α.
- La combinaison milrinone – adrénaline est extrêmement efficace dans toutes les cardiopathies; dans beaucoup de centres, c’est l’inotrope de premier choix pour les cas standards ou complexes.
- La dobutamine (5-10 mcg/kg/min) provoque une certaine tachycardie et peut induire une poussée hypertensive; elle est plutôt réservée aux cas simples (CIV isolée, par exemple).
- En cas de résistances systémiques basses, la nor-adrénaline (0.05-1.0 mcg/kg/min) peut être indiquée pour maintenir la perfusion de perfusion, en particulier coronarienne, si la pression diastolique systémique est trop basse (0.05 mcg/kg/min), notamment en cas de dysfonction du VD; s’assurer que le VG peut soutenir l’augmentation de postcharge.
- En cas de bloc AV complet ou de bradycardie sévère, on peut administrer de l'isoprénaline (1 mcg/kg) en attendant la mise en place d'un pace-maker; plus l'enfant est petit, plus sont débit est dépendant de la fréquence cardiaque.
- Une PAP élevée ou une défaillance du ventricule sous-pulmonaire est une indication au NO• (10-30 ppm).
- D'une manière générale, le ventricule le plus à risque au sortir de CEC est celui qui est le plus hypertrophié ou celui qui a subi une ventriculotomie.
Dès la sortie de pompe, l'approche conventionnelle du soutien inotrope chez le petit enfant est centrée sur le maintien du débit cardiaque.
- Administration de béta-stimulant: dopamine (5-10 mcg/kg/min), dobutamine (5-10 mcg/kg/min), adrénaline (0.1-0.2 mcg/kg/min), isoprénaline en cas de bradycardie (0.01-0.1 mcg/kg/min).
- Adjonction de milrinone (0.5-0.75 mcg/kg/min) si la béta-stimulation est insuffisante; la combinaison milrinone + adrénaline est particulièrement efficace.
- Maintien de la calcémie (1-1.4 mmol/L), de la magnésémie (≥ 0.7 mmol/L) et de la kaliémie (4 mmol/L).
- Problèmes principaux liés à cette approche:
- Amélioration prédominant sur le flux systolique, baisse relative du flux diastolique;
- Tachycardie;
- Augmentation de la demande métabolique et de la mVO2;
- Risque de compromettre la perfusion myocardique et l'équilibre DO2/VO2.
Une approche novatrice consiste à porter davantage d'attention à la fonction diastolique et à la pression de perfusion des organes [4].
- Utilisation restreinte de béta-stimulants; abandon de la dobutamine et de l'isoprénaline; l'adrénaline est limitée au choc cardiogène.
- Inodilatation: perfusion systématique de milrinone (0.75 mcg/kg/min); dose de charge (50 mcg/kg) pendant la CEC. Le levosimendan peut remplacer la milrinone dans les cas à haut risque.
- Vasodilatation mésentérique et rénale: dopamine à faible dose pour l'effet sur les récepteurs DA1 (2-3 mcg/kg/min).
- Maintien de la pression de perfusion des organes; la vasodilatation induite par les deux points ci-dessus baisse la postcharge du VG mais peut compromettre la perfusion tissulaire. Il est donc nécessaire d'y adjoindre une perfusion de nor-adrénaline (0.1-0.4 mcg/kg/min) pour maintenir la pression de perfusion (PP = PAM – PVC); valeurs recherchées:
- Prématuré: 35 mmHg;
- Nouveau-né à terme: 40 mmHg;
- Enfant: 50 mmHg;
- Grand enfant, adolescent: 60 mmHg.
- L'indication et le dosage de la noradrénaline sont confrontés à l'analyse de l'aspect analogique de la courbe artérielle (Figure 12.32C).
- Dans l'expérience du CHUV, cette approche a diminué significativement la mortalité postopératoire (1.4% versus 7.3%) et la durée de ventilation (35 heures versus 69 heures) [4].
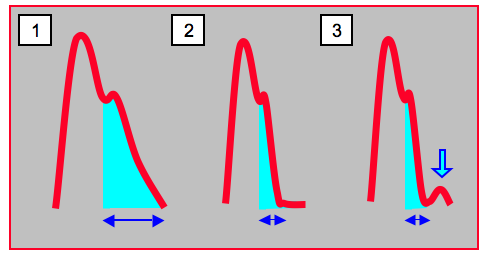
Figure 12.32C: Aspect analogique de la courbe artérielle en diastole. 1: courbe normale; le flux antérograde diastolique est proportionnel à la surface sous la courbe diastolique (surface jaune). Dans ce cas, la nor-adrénaline peut être utilisée généreusement pour améliorer la pression de perfusion. 2: absence de flux diastolique; la courbe diastolique est pratiquement plate, le flux antérograde est inexistant. Cet aspect est typique de l'hypovolémie; il est une contre-indication à l'utilisation d'un vasopresseur. 3: une perfusion de noradrénaline mise en route dans le cas précédent péjore la situation, car elle induit un flux diastolique rétrograde (flèche) [d'après réf 4].
Dans les heures qui suivent une CEC, les RAP répondent à l’alcalose respiratoire (baisse de la PaCO2) mais sont peu sensibles à l'oxygène, alors que ce dernier est habituellement un bon vasodilatateur pulmonaire [3]. On ventile cependant avec une FiO2 élevée (0.8-1.0), de manière à maintenir une PaO2 d'au moins 100 mmHg. La persistance d’une HTAP et d’une dysfonction droite malgré les vasodilatateurs pulmonaires (PGE1, NO•) et les agents inotropes (milrinone, adrénaline) peut inciter à ne pas fermer le péricarde ni le sternum pour éviter un "effet tamponnade" sur des cavités dilatées et une augmentation de la pression intrathoracique, particulièrement si l’enfant est petit (< 3 kg, < 7 jours) [7]. En cas de stase majeure, on peut créer une petite CIA de décharge. Le sang qui passe alors de l’OD à l’OG décharge le VD et augmente le débit du VG, au prix d’une désaturation artérielle [5]. Une série de circonstances incite à refermer le sternum 24-48 heures plus tard lorsque la situation s'est stabilisée:
- Risque élevé de distension ventriculaire;
- Fortes doses d’agent inotrope (adrénaline > 0.3 mcg/kg/min);
- Instabilité hémodynamique, HTAP;
- Compliance pulmonaire très altérée;
- Œdème tissulaire important;
- Longue CEC (> 180 minutes), long clampage aortique (> 90 minutes);
- POG très élevée, SvO2 < 51%.
La contre-pulsion intra-aortique n’est pas utilisable chez le petit enfant à cause de sa taille, de sa tachycardie, de la souplesse de son aorte et des éventuelles collatérales aorto-pulmonaires. Par contre, l’ECMO (extra-corporeal membrane oxygenation) est une assistance efficace en cas de défaillance ventriculaire, mais la mortalité reste élevée quand l’indication est une incapacité à sortir de CEC. Le but de l’ECMO est de restaurer le débit cardiaque, de suppléer la ventilation, de diminuer les agents inotropes et d’attendre la récupération fonctionnelle du myocarde. Chez l’enfant, ses indications sont les suivantes.
- Défaillance hémodynamique;
- Défaillance du VD sur HTAP sévère;
- Long clampage aortique;
- Défaut de protection myocardique;
- Ischémie coronarienne;
- Problème chirurgical.
La difficulté à sevrer l’enfant de la CEC peut aussi être due à une correction chirurgicale inadéquate ou insuffisante. L’ETO prend ici toute son importance pour décider d’un éventuel retour en CEC pour améliorer la réparation [1,2,6,8]. La persistance d’une anomalie péjore significativement le pronostic vital. Les problèmes potentiels rencontrés en sortant de CEC sont résumés dans le Tableau 14.14.
| Sortie de CEC |
|
Ventilation : FiO2 0.8-1.0, PetCO2 30-35 mmHg, NO si HTAP ou insuffisance du VD
Soutien inotrope : adrénaline-milrinone, dobutamine, Ca2+, levosimendan
Vasoconstricteur (noradrénaline) si RAS basses ou pression de perfusion (PP = PAM - PVC) insuffisante
Vasodilatateur si RAS hautes Pace-maker si fréquence < 100 batt/min chez le petit enfant et < 70 batt/min chez le grand enfant
Contrôle ETO : fonction ventriculaire, volémie, correction chirurgicale, éventuel défaut résiduel
Si défaillance ventriculaire réfractaire: ECMO
En chirurgie néonatale (< 7 jours, < 3 kg), ne pas hésiter à laisser le sternum ouvert (24-48 heures) en cas de longue CEC, distension ventriculaire, hautes doses d’inotrope, instabilité hémodynamique, HTAP ou compliance pulmonaire altérée.
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- BETTEX DA, PRETRE R, JENNI R, SCHMID ER: Cost effectiveness of routine intraoperative transesophageal echocardiography in pediatric cardiac surgery: a ten-year experience. Anesth Analg 2005; 100:1271-5
- BETTEX DA, SCHMIDLIN D, BERNATH MA, PRETRE R, HURNI M, CHASSOT PG. Intraoperative trasnesophageal echocardiography in pediatric congenital heart surgery: A two-center observational study. Anesth Analg 2003; 97:1275-82995; 60:S539-42
- GIGLIA TM, WESSEL DL. Effects of oxygen on pulmonary and systemic hemodynamics in infants after cardiopulmonary bypass. Circulation 1990; 82(suppl III):III-78
- HOSSEINPOUR AR, VAN STEENBERGHE M, BERNATH MA, et al. Improvement in perioperative care in pediatric cardiac surgery by shifting the primary focus of treatment from cardiac output to perfusion pressure: are beta stimulants still needed ? Cong Heart Dis 2017; 12:570-7
- LAKS H, PEARL JM, HAAS GS, et al. Partial Fontan : Advantages of an adjustable interatrial communication. Ann Thorac Surg 1991 ; 52 :1084-95
- RANDOLPH GR, HAGLER DJ, CONNOLLY HM, et al. Intraoperative transesophageal echocardiography during surgery for congenital heart defects. J Thorac Cardiovasc Surg 2002; 124:1176-82
- SAMIR K, RIBERI A, GHEZ O, et al. Delayed sternal closure : a life-saving measure in neonatal open heart surgery : could it be predictable ? Eur J Cardiothorac Surg 2002 ; 21 :787-93
- UNGERLEIDER RM, KISSLO JA, GREELEY WJ, et al. Intraoperative echocardiography during congenital heart operations: Experience from 1000 cases. Ann Thorac Surg 1995; 60:S539-42
