Discordance patient-prothèse
La surface utile de la prothèse est trop petite par rapport à la taille du patient lorsqu'elle est < 0.85 cm2/m2 au niveau aortique ou < 1.2 cm2/m2 au niveau mitral. Ce défaut d’appariement (PPM, patient-prosthesis mismatch) donne lieu à un gradient transvalvulaire excessif et pénalise le devenir du malade. Lorsqu'il est sévère, il entraîne une persistance du remodelage ventriculaire ou de l'hypertension pulmonaire, une aggravation de la dysfonction ventriculaire à long terme et une augmentation de la mortalité à 5 ans jusqu'à 15-25% [2,24]. La discordance peut être [22] :
- Modérée: S aortique 0.65 - 0.85 cm2/m2, S mitrale 0.9 – 1.2 cm2/m2;
- Sévère: S aortique < 0.65 cm2/m2, S mitrale < 0.9 cm2/m2.
L'incidence de la discordance patient-prothèse sévère est de 9-12% et celle de la discordance modérée de 30-50% [3,13]. Son impact clinique est important chez l'individu jeune dont le débit cardiaque est élevé, mais moins marqué chez l’individu âgé de > 70 ans [7]. Une augmentation dispproportionnée du gradient au test d’effort (> 20 mmHg pour une prothèse aortique et > 12 mmHg pour une prothèse mitrale) signale un rétrécissement significatif [23]. Alors que la forme sévère altère considérablement la qualité de vie et la mortalité, l'impact d'une discordance modeste est sujet à controverse car il n'est pas significatif si la fonction ventriculaire est normale.
La surface d'une prothèse doit donc être > 0.85 cm2/m2 en position aortique et > 1.2 cm2/m2 en position mitrale. Dans le choix de la taille d'une valve, il est important de prendre en compte la surface effective calculée à l'écho (voir Tableau 11.8 et Tableau 11.9) et non la surface nominale fournie par le fabricant dont la valeur diffère selon le mode de calcul [22]. D'autre part, la performance hémodynamique varie selon les modèles: elle est supérieure pour les valves mécaniques comparée aux bioprothèses montées, pour les bioprothèses sans monture comparée aux bioprothèses montées et pour les prothèses supra-annulaires comparée aux prothèses intra-annulaires. La mesure ETO de la dimension de l’anneau aortique avant la CEC est capitale pour déterminer la taille de la prothèse et décider du modèle à choisir ou d’un éventuel agrandissement de l’anneau aortique pour éviter l’implantation d’une valve trop petite. Le calcul de la taille minimale de la prothèse est simple :
- En position aortique: S corporelle x 0.85 cm2; S pour un adulte normal: > 1.5 cm2;
- En position mitrale: S corporelle x 1.2 cm2; S pour un adulte normal: > 2.0 cm2.
Un appariement correct est particulièrement important chez les individus de < 65 ans, chez ceux qui sont très actifs et chez ceux qui ont une longue espérance de vie. Une discordance patient-prothèse importante chez une personne âgée ne justifie probablement pas un retour en pompe pour tenter la mise en place d'une valve plus grande.
Fuites sur les prothèses
Pour éviter un blocage accidentel et assurer un autolavage, les valves à ailettes et à disque ne sont volontairement pas étanches et présentent toujours plusieurs petits jets de régurgitation dont la configuration est particulière à chaque modèle, mais qui sont toujours situés à l'intérieur de l'anneau. Ils correspondent à une fraction de régurgitation inférieure ou égale à 5% et sont sans signification hémodynamique (voir Figure 11.43) (Vidéos).
Vidéo: Fuite d'autolavage normale d'une prothèse St-Jude en position mitrale; le flux couleur qui apparaît en amont de la prothèse représente le déplacement du sang lié à la fermeture des ailettes.
Vidéo: Fuite d'autolavage normale d'une prothèse St-Jude en position mitrale, sous forme de deux jets fins situés entre l'ailette et l'anneau.
Les bioprothèses présentent une fuite de configuration variable, en général centrale et très modeste. Les prothèses stentless, qui sont souples et plus délicates à mettre en place, peuvent présenter des fuites significatives si l’implantation n’est pas parfaite.
Vidéo: Fuite d'autolavage normale d'une prothèse St-Jude en position mitrale; le flux couleur qui apparaît en amont de la prothèse représente le déplacement du sang lié à la fermeture des ailettes.
Vidéo: Fuite d'autolavage normale d'une prothèse St-Jude en position mitrale, sous forme de deux jets fins situés entre l'ailette et l'anneau.
Les bioprothèses présentent une fuite de configuration variable, en général centrale et très modeste. Les prothèses stentless, qui sont souples et plus délicates à mettre en place, peuvent présenter des fuites significatives si l’implantation n’est pas parfaite.
Les valves à ailettes présentent une certaine inertie à l'occlusion, et, lorsqu'elles se ferment, poussent en arrière la masse sanguine située à l'intérieur de leur anneau. Ce reflux peut être visible à l'échocardiographie Doppler couleur (closure backflow), mais ne constitue pas une fuite proprement dite.
La valve aortique et la valve mitrale sont insérées côte-à-côte sur le trigone fibreux. De ce fait, les points de fixation d'une prothèse aortique ou mitrale peuvent opérer une traction sur la valve oppposée et entraîner une nouvelle insuffisance ou aggraver une régurgitation pré-existante (V426-7 IM post RVA). Au niveau mitral, cette insuffisance est due à une rétraction du feuillet antérieur ou à une déchirure à la base du feuillet; au niveau aortique, elle est secondaire à une rétraction des cuspides aortiques gauche et/ou non-coronaire.
Les fuites extérieures à l’anneau prothétique sont des fuites paravalvulaires (FPV), qui sont toujours pathologiques (voir Figure 11.46). Leur apparition est plus fréquente chez le patient âgé, dans les anneaux calcifiés, dans les reconstructions annulaires, dans les réopérations et après endocardite (Vidéos). Leur impact varie selon leur importance (voir Chapitre 26, Prothèses valvulaires, Examen perop).
Vidéos: Fuite pravalvulaire majeure postérieure après remplacement valvulaire mitral.
Vidéos: Fuite paravalvulaire majeure inférieure après RVM par une prothèse St-Jude.
Vidéos: Orifice de fuite para-annulaire suite à une plastie mitrale en reconstruction tridimensionnelle (vue depuis l'OG); il est situé en regard de la valve tricuspide.
Vidéos: Fuite paravalvulaire majeure antérieure après RVM par une bioprothèse.
Vidéos: Fuites paravalvulaires après remplacement valvulaire aortique; la vue court-axe montre deux orifices de fuite à 3 heures et à 6 heures, en regard de la cuspide coronarienne gauche et de la cuspide coronarienne droite, respectivement.
Vidéos: Fuite paravalvulaire majeure après remplacement valvulaire aortique en vue long-axe; la fuite est située à l'angle mitro-aortique, où la prothèse n'a plus de contact avec la paroi.
Vidéos: Fuite pravalvulaire majeure postérieure après remplacement valvulaire mitral.
me>
Vidéos: Fuite paravalvulaire majeure inférieure après RVM par une prothèse St-Jude.
>
Vidéos: Orifice de fuite para-annulaire suite à une plastie mitrale en reconstruction tridimensionnelle (vue depuis l'OG); il est situé en regard de la valve tricuspide.
Vidéos: Fuite paravalvulaire majeure antérieure après RVM par une bioprothèse.
Vidéos: Fuites paravalvulaires après remplacement valvulaire aortique; la vue court-axe montre deux orifices de fuite à 3 heures et à 6 heures, en regard de la cuspide coronarienne gauche et de la cuspide coronarienne droite, respectivement.
Vidéos: Fuite paravalvulaire majeure après remplacement valvulaire aortique en vue long-axe; la fuite est située à l'angle mitro-aortique, où la prothèse n'a plus de contact avec la paroi.
- Le taux moyen de fuites paravalvulaires est de 12% [30]. Les fuites mineures sont fréquentes (6-18% après RVA, 22-32% après RVM) mais ne sont pas significatives [16] ; au niveau aortique, elles disparaissent rapidement avec la protamine ou en quelques jours avec le dépôt de fibrine et l’endothélialisation. Au niveau mitral, la moitié persiste à une année sans que cela influence la mortalité ni les complications cardiovasculaires [30].
- Des fuites peu importantes sont inévitables lorsque l’anneau valvulaire est très calcifié et que la congruence avec l’anneau prothétique est impossible.
- Au niveau tricuspidien, il arrive que le chirurgien ne fixe pas la prothèse du côté septal pour éviter de léser le faisceau de His, ce qui laisse un orifice extra-annulaire.
- Les fuites modérées-à-sévères (1-2% des cas) affichent une zone de convergence (PISA) clairement visible sur la face d'amont de la valve et une vena contracta significative. A l'échocardiographie 3D, elles se manifestent par un orifice paravalvulaire représentant > 10% de la circonférence de la valve. Elles doivent être corrigées immédiatement pour autant que cela soit faisable, car elles tendent à s’aggraver avec le temps (déhiscence) ; parfois, les conditions techniques de la mise en place de la prothèse sont telles que toute tentative d’amélioration est vouée à l’échec. La correction chirurgicale de la fuite échoue dans 10-20% des cas [9].
- La tolérance vis-à-vis des FPV est plus grande pour les fuites aortiques que pour les fuites mitrales, car leur vélocité est moins élevée et le risque d’hémolyse moins grand. La tolérance est très élevée pour les FPV tricuspidiennes dont la vélocité est basse.
- Indications opératoires des FPV chroniques: régurgitation entraînant une symptomatologie clinique et/ou une décompensation ventriculaire, endocardite, hémolyse (LDH > 600 U/mL) avec anémie nécessitant des transfusions répétées [22].
Immédiatement après la mise en place d'une prothèse, la décision de retourner en CEC pour occlure l’orifice paravalvulaire n’est pas fondée que sur l’image ETO, mais sur une série de contingences : valve incriminée, état de l’anneau, faisabilité chirurgicale de la réparation, risque clinique d’une 2ème CEC, etc. Si la chirurgie est trop risquée, il est possible de réduire une fuite paravalvulaire au moyen d’un dispositif d’occlusion utilisé pour fermer les CIA (occluder type Amplatzer™) (voir Figure 11.47B). Le taux de succès varie de 60 à 90% des cas ; souvent, la fuite est diminuée mais non totalement exclue ; l’effet sur l’hémolyse est inconstant [8].
Obstruction dynamique de la CCVG ("effet CMO")
Dans le cadre de la chirurgie valvulaire, l’obstruction dynamique de la CCVG, ou effet cardiomyopathie obstructive (effet CMO), survient essentiellement en sortant de CEC dans trois situations différentes: après une plastie mitrale, après un RVM avec une bioprothèse et après un remplacement aortique pour sténose. Normalement, le point de coaptation entre les deux feuillets de la valve mitrale est maintenu éloigné postérieurement de la chambre de chasse par plusieurs éléments (Figure 13.9) [17,18].
- L'angle mitro-aortique est assez ouvert pour éloigner la chambre d'admission de la chambre de chasse ; le flux de remplissage diastolique et le flux d'éjection systolique sont presque parallèles.
- Le feuillet mitral antérieur est plus long que le postérieur.
- Le déplacement radiaire vers l’intérieur de la paroi postérieure est plus faible que celui de la paroi antérieure et de la paroi latérale.
- La paroi postéro-basale est activée électriquement en dernier.
- La pression intraventriculaire assure l'étanchéité de la valve mitrale en appuyant les deux feuillets l'un contre l'autre.
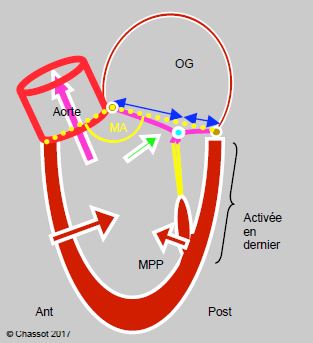
Figure 13.9: Schématisation du rapport normal entre la valve mitrale et la chambre de chasse du VG (CCVG). L'angle mitro-aortique (MA, en jaune) est ouvert (> 150°). Le point de coaptation de la valve mitrale est situé au quart postérieur du diamètre de la valve (flèches bleues). La paroi postérieure a moins de course que la paroi antérieure; elle est activée en dernier. La pression intraventriculaire maintient l’occlusion de la mitrale en appuyant les deux feuillets l'un contre l'autre (flèche verte). Le système est construit pour maintenir le point de coaptation de la mitrale aussi éloigné que possible de la CCVG en systole.
Plusieurs phénomènes structurels contribuent au déplacement antérieur du point de coaptation de la valve mitrale (Figure 13.10) [10].
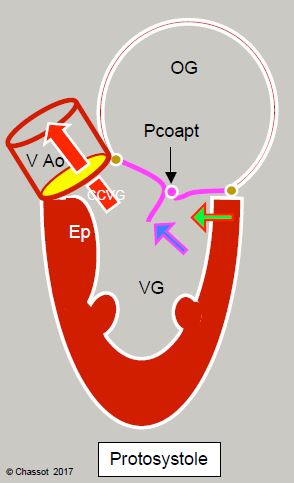
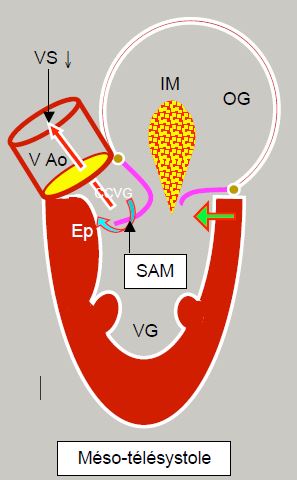
Figure 13.10 : Sténose sous-aortique dynamique dans la cardiomyopathie hypertrophique. L’hypertrophie concentrique et le rétrécissement de la cavité ventriculaire (souvent agravé par l'hypovolémie, par la baisse de postcharge ou par la sur-stimulation inotrope béta) déplacent la partie postérobasale du VG vers l'avant (flèche verte). En protosystole, le feuillet antérieur et le point de coaptation (Pcoapt) de la valve mitrale sont déplacés vers la chambre de chasse (CCVG), l’angle entre le plan de la valve aortique et celui de la valve mitrale se referme (angle mitro-aortique : pointillé vert). Le point de coaptation est situé entre le bord du feuillet postérieur et le corps du feuillet antérieur, la partie distale de ce dernier flottant à l'intérieur du VG (flèche bleue). En début de systole, la pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. L’accélération du flux dans la CCVG crée ensuite un effet Venturi qui aspire secondairement le feuillet antérieur de la mitrale (SAM). En mésotélésystole, le feuillet mitral contribue à l’obstruction dynamique de la CCVG. Comme la valve mitrale n’est plus occluse, une régurgitation mitrale (IM) apparaît dans la deuxième moitié de la systole. Ep : éperon septal hypertrophié. HVG: hypertrophie ventriculaire gauche. SAM : systolic anterior motion. VAo: valve aortique.
- Lors d’hypertrophie concentrique du VG (sténose aortique), la cavité ventriculaire diminue de taille, la paroi postérieure se rapproche de la chambre de chasse, car la jonction antérieure entre l'aorte et la mitrale est un point fixe ancré sur le trigone, qui forme le squelette fibreux reliant entre elles les valves mitrale, aortique et tricuspide. Seule la partie postéro-latérale peut se déplacer vers l'intérieur lorsque le VG se rétrécit.
- L'angle mitro-aortique est plus fermé à cause de l’hypertrophie septale et du déplacement vers l’avant de la paroi postérieure.
- La fonction du VG est bonne (FE > 60%). Une stimulation β excessive augmente encore la course systolique radiaire de la paroi postérieure qui se déplace trop en avant.
- L’hypovolémie et la vasoplégie diminuent le volume ventriculaire au point que le diamètre antéro-postérieur se réduit excessivement au cours de la systole. Le même processus survient après RVA: la levée de l'obstacle à l'éjection que représentait une sténose aortique serrée produit une baisse soudaine de postcharge pour le VG, qui aboutit à un véritable collapsus du ventricule en télésystole.
- Un excès de tissu dans le feuillet mitral postérieur modifie le rapport de longueur entre les deux feuillets et déplace le point de coaptation vers l’avant en direction de la CCVG ; ceci survient typiquement dans la maladie de Barlow. Après plastie mitrale, une résection insuffisante du feuillet postérieur et/ou un anneau trop restrictif déplace également le point de coaptation vers l'avant.
- Un certain nombre de facteurs préopératoires sont des marqueurs de risque pour le déplacement antérieur du point de coaptation et le basculement du feuillet antérieur dans la CCVG (SAM, systolic anterior motion) (Figure 11.49) [20,27].
- FE > 60% et dimension réduite de la cavité ventriculaire gauche;
- Hauteur du feuillet postérieur > 15 mm;
- Angle aorto-mitral diminué (< 140°);
- Distance entre le septum interventriculaire et le point de coaptation mitral (C-sept) diminué (< 2.5 cm);
- Déplacement antérieur du muscle papillaire antéro-latéral.
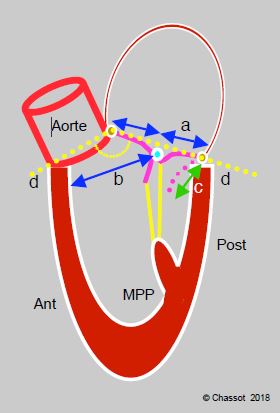
Figure 11.49 : Eléments prédicteurs de bascule du feuillet antérieur dans la chambre de chasse en postopératoire (SAM systolic anterior motion). a : rapport hauteur du feuillet antérieur / hauteur du feuillet postérieur < 1.3. b : distance entre le point de coaptation et le septum < 2.6 cm. c : hauteur du feuillet postérieur déployé en diastole > 1.5 cm. d : angle mitro-aortique refermé (< 140°) [20].
La coaptation n'a plus lieu par les bords libres des deux feuillets; l'extrémité du feuillet postérieur vient en contact avec le coprs du feuillet antérieur, laissant la partie distale de ce dernier flotter dans la cavité ventriculaire. Ces phénomènes rapprochent le point de coaptation mitral de la chambre de chasse au cours de la systole. La pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. Comme cela survient en cours de systole, le flux est déjà accéléré dans la chambre de chasse et le feuillet antérieur peut alors être aspiré par effet Venturi (VDom SAM post RVA 1, VDom SAM post RVA 2). De ce fait, il occlut plus ou moins complètement la CCVG. C’est le SAM (systolic anterior motion), qui survient en méso-télésystole. La vélocité maximale atteinte dans la CCVG est > 2.5 m/s; le gradient est > 30 mmHg au repos et > 50 mmHg à l'effort [10,15]. Le rétrécissement mésosystolique de la CCVG fait chuter le volume systolique, ce qui se traduit par un collapsus partiel des feuillets de la valve aortique en cours de systole (Vidéos) (Figure 13.13).
Vidéos: Déplacement antérieur dans la chambre de chasse gauche du feuillet mitral antérieur (SAM); la fuite induite par la réouverture mésosystolique de la mitrale est importante mais de brêve durée.
Vidéos: Déplacement antérieur dans la chambre de chasse gauche du feuillet mitral antérieure (SAM); la fuite induite par la réouverture mésosystolique de la mitrale ne dure que la moitié de la systole.
Vidéos: Déplacement antérieur dans la chambre de chasse gauche du feuillet mitral antérieur (SAM); la fuite induite par la réouverture mésosystolique de la mitrale est importante mais de brêve durée.
Vidéos: Déplacement antérieur dans la chambre de chasse gauche du feuillet mitral antérieure (SAM); la fuite induite par la réouverture mésosystolique de la mitrale ne dure que la moitié de la systole.
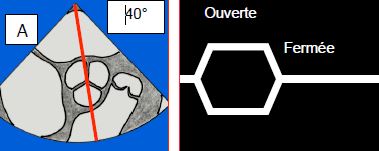
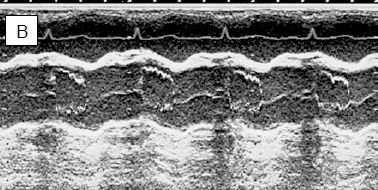
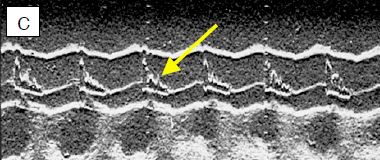
Figure 13.13: Vues échocardiographiques en mode TM (temps-mouvement) de la valve aortique. La chute du volume systolique (VS) conduit à un collapsus des feuillets de la valve aortique, parce que l'effondrement du VS ne la maintient plus ouverte. A: axe TM à travers une vue court-axe de la valve aortique; schéma de l'ouverture et de la fermeture de la valve aortique. B: l'image normale est quasi-quadrangulaire, la valve est ouverte pendant toute la systole. C: l'image dans une CMO montre un collapsus des feuillets (flèche) en méso-systole. Cet aspect est pathognomonique de la subocclusion de la CCVG.
Le phénomène de SAM survient en sortant de CEC dans 14% des RVA pour sténose [1]. Dans cette situation, il est essentiel de calculer le gradient trans-valvulaire avec l’équation de Bernoulli prenant en compte la vélocité dans la chambre de chasse : ΔP = 4 • (Vtotale2 – VCCVG2), car celle-ci (VCCVG) est largement au dessus de 1.5 m/s ; à elle seule, elle induit un ΔPmax > 25 mmHg qu’il faut soustraire du gradient total de la voie d’éjection (Vtotale) pour mesurer le gradient propre à la prothèse. Le rapport entre la vélocité dans la CCVG et celle à travers la valve (VCCVG / VVAo) est utile pour apprécier le degré d’accélération généré par la prothèse; normalement, ce rapport doit être > 0.4 [32].
Après remplacement mitral avec une bioprothèse montée, on peut rencontrer un effet CMO induit par un des 3 picots de la prothèse qui obstrue partiellement la CCVG. Après une plastie mitrale, la zone de coaptation mitrale se rapproche de la CCVG, car le point fixe de l’anneau mitral est au niveau de la jonction mitro-aortique (trigone fibreux), alors que la partie postérieure est fine et n’est soutenue que par la musculature ventriculaire ; c’est donc elle qui va se déplacer vers l’avant (Vidéos) (voir Figure 11.57). Un déplacement antérieur excessif (SAM) est présent dans 4-11% des plasties mitrales [28]. Il est possible pour quatre raisons différentes [19].
Vidéo: Déplacement du feuillet mitral antérieur dans la chambre de chasse du VG (SAM) dans un cas de cardiomyopathie hypertrophique (vue long-axe).
Vidéo: Déplacement du feuillet mitral antérieur dans la chambre de chasse du VG (SAM) dans un cas de cardiomyopathie hypertrophique (vue long-axe).
Vidéo: Déplacement du feuillet mitral antérieur dans la chambre de chasse du VG (SAM) après plastie mitrale (vue 4-cavités).
- L’anneau de valvuloplastie est trop restrictif ; le SAM est plus fréquent après pose d'un anneau rigide complet et restrictif qu'après celle d'un anneau ouvert semi-rigide.
- La longueur du feuillet postérieur est excessive (excès de tissu).
- La cavité ventriculaire est trop petite : hypovolémie, HVG concentrique.
- La course radiaire de la paroi postérieure en systole est trop grande : sur-stimulation β, vasoplégie.
Les deux premiers points sont liés à l’intervention chirurgicale ; ils surviennent dans 7% des plasties mitrales [11,28]. Les deux autres points sont beaucoup plus fréquents mais ne réclament pas une reprise chirurgicale; ils sont liés à l’hémodynamique et se corrigent par le traitement de l'obstruction dynamique de la CCVG [28]:
- Augmentation de la précharge (remplissage);
- Augmentation de la postcharge par des vascoconstricteurs (néosynéphrine, nor-adrénaline);
- Baisse de la contractilité (arrêt des catécholamines, β-blocage à l’esmolol);
- Réopération: rarement nécessaire (6-8% des cas).
Le résultat de l'"effet CMO" est un bas débit cardiaque caractérisé par une hypotension systémique sévère et un choc cardiogène réfractaire aux catécholamines, mais des pressions de remplissage conservées, voire élevées. Le diagnostic ne peut être posé qu'à l'échocardiographie. La seule thérapeutique est l'arrêt des catécholamines β, le remplissage et l'augmentation des résistances artérielles systémiques (vasoconstricteur α) ; dans les cas rebelles, le β-blocage est nécessaire.
Anticoagulation
L'anticoagulation requise pendant les 3 premiers mois avec les bioprothèses et à vie avec les valves mécaniques est une source majeure de complications hémorragiques. Comme le risque thrombogène est plus grand en position mitrale qu'en position aortique, on vise un INR de 3.0 – 3.5 pour les RVM et de 2.0 – 3.0 pour les RVA, avec addition d'aspirine (75-250 mg/j) s'il n'y a pas de contre-indication (voir Tableau 11.6). Les agents anti-vitamine K (AVK) sont les seuls appropriés pour l'anticoagulation des prothèses valvulaires; l'interruption du traitement en cas d'intervention chirurgicale nécessite une substitution par une héparine (HNF ou HBPM) (voir Valvulopathies et chirurgie non-cardiaque). Les nouveaux anticoagulants oraux (dabigatran, rivaroxaban, apixaban, edoxaban) se sont avérés insuffisants pour protéger efficacement des accidents thrombo-emboliques en cas de sténose mitrale rhumatismale, de plastie mitrale avec matériel prothétique, de prothèse valvulaire mécanique ou de bioprothèse; ces quatre situations restent du domaine des AVK [6]. Par contre, les NACO peuvent être utilisés en cas de FA dans les valvulopathies natives comme la sténose aortique, l'insuffisance mitrale ou l'insuffisance aortique, mais non la sténose mitrale où les AVK restent recommandés [5,14]. Vu le risque hémorragique, l'anticoagulation optimale pour les prothèses mécaniques reste incertaine, et le bénéfice de l'addition d'antiplaquettaires n'est pas prouvé, sauf chez les polyvasculaires [21].
Autres complications
A long terme, les prothèse mécaniques présentent un risque substantiel de thrombose et de thrombo-embolie; elles requièrent une anticoagulation à vie, qui est elle-même source de complications hémorragiques. Les bioprothèses, au contraire, ne nécessitent pas d'anticoagulation, mais leur durée de vie est limitée par une dégénérescence et une calcification progressives. Un certain nombre de complications sont communes aux différents types de valves [12,22,26,29].
- Thrombo-embolie: incidence de 1-2% patient/année; la thrombose se rencontre essentiellement dans les prothèses mécaniques en cas d'anticoagulation inefficace, plus fréquemment en position mitrale qu'en position aortique. Les facteurs de risque concommittants sont la fibrillation auriculaire, la dilatation de l'OG, la dysfonction gauche et un état hypercoagulable [22]. Si l'amélioration de l'anticoagulation (augmentation de l'INR, addition d'aspirine) ne suffit pas à régler le problème thrombo-embolique ou que le thrombus est grand (≥ 10 mm) et mobile, une ablation chirurgicale est nécessaire; si celle-ci est trop risquée (mortalité 4-15%), on peut envisager une thrombolyse de sauvetage. Dans le coeur droit, on privilégie la thrombolyse.
- Saignements: le risque d'événement hémorragique grave chez les patients anticoagulés est de 1% patient/année.
- Blocage: l'incidence est de 0.3-1.3%/patient/année pour les prothèses mécaniques [25]. Le développement d'un pannus fibreux peut survenir dans n'importe quel type de prothèse; il limite les mouvements des ailettes ou des cuspides et peut complètement bloquer la prothèse (RVM ailette bloc1) [4]. Que ce soit un thrombus ou un pannus, la chirurgie est indiquée si l'effet sténosant est sévère ou si la masse est importante (> 5-10 mm) et flottante (mortalité 4-20% selon l'état clinique). La thrombolyse est une option possible si le risque chirurgical est excessif.
- Détérioration structurelle: le taux de dégradation des bioprothèses est de 15-30% à 10 ans et de 20-50% à 15 ans selon les modèles; les facteurs qui l'accélèrent sont le jeune âge (< 40 ans), la position mitrale, l'insuffisance rénale, l'hyperparathyroïdisme. Le traitement des tissus au gluaraldéhyde favorise la calcification ultérieure, mais une partie du phénomène est lié à des processus actifs tels que l'athéromatose et les réactions immunes (le tissu n'est pas totalement inerte).
- Endocardite: incidence 0.5% patient/année malgré une prophylaxie adéquate, mortalité 30-50%. La chirurgie est indiquée en cas d'échec du traitement médical, de régurgitation majeure, de végétation > 10 mm, de fistule, ou de défaillance progressive du ventricule.
- Fuite paravalvulaire: les fuites sévères sont rares (1-2%); la correction chirurgicale s'impose lorsqu'elles sont symptomatiques et/ou entraînent une défaillance ventriculaire ou une hémolyse importante.
- Hémolyse: la majorité des patients porteurs de prothèses mécaniques présente un faible degré d'hémolyse, mais seuls ceux qui deviennent anémiques réclament un traitement de la cause, le plus souvent une fuite paravalvulaire. L'hémolyse est due à la collision, au cisaillement et à la fragmentation d’un jet de régurgitation avec une surface étrangère rigide, par exemple l’anneau de la valve [31].
- Les accidents mécaniques (rupture, perte d'ailette) sont extrèmement rares.
Vidéo: Blocage d'une ailette dans un cas de prothèse St-Jude en position mitrale.
En cas de doute sur le fonctionnement d’une prothèse valvulaire, seule la cinéangiographie permet de visualiser avec certitude le mouvement des ailettes.
| Complications des prothèses valvulaires |
|
Discordance patient-prothèse: la surface effective de la prothèse est trop petite pour le débit cardiaque du patient lorsqu'elle est < 0.85 cm2/m2 au niveau aortique ou < 1.2 cm2/m2 au niveau mitral.
Les prothèses ne sont pas totalement étanches et présentent de petites fuites. Les valves mécaniques maintiennent une minime régurgitation lorsqu'elles sont fermées pour éviter le dépôt de fibrine et de thrombus (fuite d'autolavage). Toutes ces fuites sont situées à l'intérieur de l'anneau prosthétique.
Les fuites paravalvulaires sont situées à l'extérieur de cet anneau et sont toujours pathologiques. Lorsqu'elles sont faibles, elles peuvent être ignorées; la plupart disparaissent spontanément. Lorsqu'elles sont importantes, elles nécessitent un retour immédiat en CEC ou une réopération ultérieure si la réparation est faisable et le risque pas trop élevé. Indications opératoires: fuite majeure, défaillance ventriculaire, hémolyse, endocardite.
Une obstruction dynamique de la CCVG par déplacement en avant du feuillet mitral antérieur survient fréquemment lorsque certaines circonstances sont réunies:
- Levée de l'obstacle d'une sténose aortique
- Plastie mitrale trop restrictive
- Diminution de la cavité du VG (hypovolémie, HVG concentrique sévère)
- Baisse de postcharge (RVA pour sténose, vasoplégie, CPIA)
- Excès de stimulation catécholaminergique β
Le taux de complication moyen des prothèses est de 3%/an. Les complications les plus fréquentes des remplacements valvulaires sont:
- Thrombo-embolie (0.6 – 2.3% patient/année)
- Hémorragie sur anticoagulation (1% patient/année)
- Dégradation structurelle des bioprothèses (10-30% à 10 ans et de 20-50% à 15 ans)
- Endocardite (0.5% patient/année)
- Fuite paravalvulaire (1-2%)
- Hémolyse
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- BARTUNEK J, SYS SU, RODRIGUEZ AC, et al. Abnormal systolic intraventricular flow velocities after valve replacement for aortic stenosis. Circulation 1996; 93:712-9
- BLAIS C, DUMESNIL JG, BAILLOT R, et al. Impact of valve prosthesis-patient mismatch on short-term mortality after aortic valve replacement. Circulation 2003; 108:983-8
- BLEIZIFFER S, EICHINGER WB, HETTICH I, et al. Impact of patient-prosthesis mismatch on exercise capacity in patients after bioprosthetic aortic valve replacement. Heart 2008; 94:637-41
- CANNEGIETER SC, TORN M, ROSENDAAL FR. Oral anticoagulant treatment in patients with mechanical heart valves: How to reduce the risk of thromboembolic and bleeding complications. J Intern Med 1999; 245:369-74
- DOHERTY JU, GLUCKMAN TJ, HUCKER WJ, et al. 2017 ACC expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017; 69:871-98
- EIKELBOOM JW, CONNOLLY SJ, BRUECKMANN M, et al. Dabigatran versus warfarin in patients with mechanical heart valves, N Engl J Med 2013; 369:1206-14
- FEINDEL CM. Counterpoint: aortic valve replacement: size does matter. J Thorac Cardiovasc Surg 2009; 137:284-5
- GARCIA-FERNANDEZ MA,CORTES M, GARCIA-ROBLES JA, et al. Usefulness of transesophageal echocardiography in evaluating the success of percutaneous transcatheter closure of mitral paravalvukar leaks. J Am Soc Echocardiogr 2010; 23:26-32
- GENONI M, FRANZEN D, VOGT P, et al. Paravalvular leakage after mitral valve replacement: Improved long-term survival with aggressive surgery? Eur J Cardiothorac Surg 2000; 17:14-9
- GERSH BJ, MARON BJ, BONOW RO, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: Executive summary. Circulation 2011; 124:2761-96
- GILLINOV AM, COSGROVE DM, LYTLE BW, et al. Reoperation for failure of mitral valve repair. J Thorac Cardiovasc Surg 1997; 113:467-73
- HAMMERMEISTER KE, SEHTI GK, HENDERSON WG, et al. Outcomes 15 years after valve replacement with a mechanical versus bioprosthetic valve: final report of the Veterans Affairs randomized trial. J Am Coll Cardiol 2000; 36:1152-8
- HEAD SJ, MOKHLES MM, OSNABRUGGE RI, et al. The impact of prosthesis-patient mismatch on long-term survival after aortic valve replacement: a systematic review and meta-analysis of 34 observational studies comprising 27'186 patients with 133'141 patient-years. Eur Heart J 2012; 33:158-29
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. European Heart Rythm Association Practical Guide on the use of non- vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015 ; 17:1467-507
- HENSLEY N, DIETRICH J, NYHAN D, et al. Hypertrophic cardiomyopathy: a review. Anesth Analg 2015; 120:554-69
- IONESCU A, FRASER AG, BUTCHART EG, et al. Prevalence and clinical significance of incidental paraprosthetic valvular regurgitation: A prospective study using transesophageal echocardiography. Heart 2003; 89:1316-21
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- LEFEBVRE XP, HE S, LEVINE RA, et al. Systolic anterior motion of the mitral valve in hypertrophic cardoimyopathy: an in vitro pulsatile flow study. J Heart Valve Dis 1995; 4:422-38
- LOULMET DF, YAFFEE DW, URSOMANNO PA, et al. Systolic anterior motion of the mitral valve: a 30-year perspective. J Thorac Cardiovasc Surg 2014; 148:2787-94
- MASLOW AD, HAERING JM, LEVINE RA, et al. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease. J Am Coll Cardiol 1999; 34:2096-104
- MACISAAC S, JAFFER IH, BELLEY-CÔTÉ EP, et al. How did we get here ? A historical review and critical analysis of anticoagulation therapy following mechanical valve replacement. Circulation 2019; 140:1933-42
- PIBAROT P, DUMESNIL JG. Prosthetic heart valves: selection of the optimal prosthesis and long-term management. Circulation 2009; 119:1034-48
- PICANO E, PIBAROT P, LANCELLOTTI P, et al. The emerging role of exercise testing and stress echocardiography in valvular heart disease. J Am Coll Cardiol 2009; 54:2251-60
- RAHIMTOOLA SH. Choice of prosthetic heart valve in adults. An update. J Am Coll Cardiol 2010; 55:2413-26
- ROUDAUT R, SERRI K, LAFITTE S. Thrombosis of prosthetic heart valves: diagnosis and therapeutic considerations. Heart 2007; 93:137-42
- RUEL M, KULIK A, RUBENS FD, et al. Late incidence and determinants of reoperation in patients with prosthetic heart valves. Eur J Cardiothorac Surg 2004; 25:364-70
- TAVLASOGLU M, DURUKAN AB, GURBUZ HA. Is a "narrow aorto-mitral angle and associated factors" associated with development of systolic anterior motion? J Thorac Cardiovasc Surg 2013; 145:617
- VARGHESE R, ANYANWU AC, ITAGAKI S, et al. Management of systolic anterior motion after mitral valve repair: an algorithm. J Thorac Cardiovasc Surg 2012; 143:S2-7
- VESEY JM, OTTO CM. Complications of prosthetic heart valves. Curr Cardiol Rep 2004; 6:106-11
- WASOWICZ M, MEINERI M, DJAIANI G, et al. Early complications and immediate postoperative outcomes of paravalvular leaks after valve replacement surgery. J Cardiothorac Vasc Anesth 2011; 25:610-4
- YEO TC, FREEMAN WK, SCHAFF HV, et al. Mechanisms of hemolysis after mitral valve repair: Assessment by serial echocardiography. J Am Coll Cardiol 1998; 32:717-23
- ZOGHBI WA, CHAMBERS JB, DUMESNIL JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultrasound. J Am Soc Echocradiogr 2009; 22:975-1014
